NaCl胁迫对美国金钟连翘生理特性的影响
薛腾笑, 任子蓓, 任士福
(河北农业大学林学院,河北保定 071000)
美国金钟连翘(ForsythiaintermeliaZabel)为木犀科连翘属落叶灌木,为金钟花(ForsythiaviridissimaLindl.)和连翘(Forsythiasuspensa)的杂交种[1]。其花色金黄,着花繁密,花期3~4个月,早春开花;喜光,稍耐阴,耐寒,耐干旱,抗旱性强,适生范围广,不择土壤,是优良的护坡植物[2]。美国金钟连翘花色金黄,花朵繁密,美丽的花朵与优美的树姿使其广泛应用于园林绿化。美国金钟连翘还是优良的水土保持树种,有着较强的固土能力,可以防止土块滑移,保持水土和维持地力[3]。
当土壤中盐碱过多时,就会危害植物的正常生长,称为盐害[4]。植物的耐盐性一般都很弱,当土壤表层的含盐量超过0.6%时,大多数植物已不能生长;当土壤中的可溶性盐含量超过1.0%时,只有一些特殊的适应于盐土的植物才能生长[5],而土壤中的致害盐类以中性盐NaCl为主[6]。在滨海盐碱地区,盐渍化土壤使该地区植物种类受到很大的限制,树种较为单一。近年来,滨海盐碱地区除了种植乡土树种,也在积极引进一些抗盐碱能力较强的树种,以丰富当地的园林绿化及造林树种种类。本试验以美国金钟连翘为试验材料,研究不同浓度NaCl胁迫对其各项生理指标的影响,旨在为连翘抗盐性研究提供参考,从而为连翘在滨海盐碱地区园林绿化及造林方面的应用提供基础的理论依据。
1 材料与方法
1.1 试验材料
以美国金钟连翘(F.intermeliaZabel)为试验材料,选取生境长势一致的一年生实生苗木进行盆栽试验。盆栽试验选用底部有孔的花盆(25 cm×20 cm),就地取土(土壤中含盐量为0.103%),每盆装土5 kg,栽种苗木2株,每个品种25盆,共计75盆。
1.2 试验方法
本试验于2016年7月在河北农业大学标本园(地理位置115°26′36.28″E,38°49′18.62″N)塑料大棚内进行,采用随机区组设计,共设CK(0.103%)、T1(0.2%)、T2(0.3%)、T3(0.4%)和T4(0.5%)5个盐分处理,各个处理设5次重复。根据试验需要将相应量的NaCl(以干土质量分数计算)溶于水,在第1、8、15天08:00分3次等量地浇灌NaCl溶液,最终土壤累积含盐量分别为0.103%(CK)、0.2%(T1)、0.3%(T2)、0.4%(T3)和0.5%(T4),各处理具体浇灌的盐溶液质量见表1。在盐胁迫过程中,需要定期浇少量水,以此来平衡蒸发量。为了防止盐分的流失,在花盆底部垫塑料托盘,将渗出的溶液及时倒回盆中。分别在盐胁迫第2、9、16、23天采集样品,进行相关指标的测定。

表1 各处理浇灌NaCl总质量及累积含盐量
1.3 测定方法
1.3.1 盐胁迫危害调查 调查方法参照孙晶等的报道[7]。分别于盐胁迫后第7、14、21、28、35、42天观察记录美国金钟连翘的生长状态和叶片颜色等的变化。植株盐害症状根据受危害程度的轻重可分为5个级别:0级,无盐胁迫危害症状;1级,少部分叶尖、叶缘和叶脉变黄;2级,约1/2的叶尖和叶缘焦枯;3级,大部分叶片有叶尖、叶缘焦枯和落叶现象;4级,枝枯、叶落直至死亡。
1.3.2 叶片生理指标测定 质膜相对透性的测定采用电导率法[8],叶绿素含量的测定采用乙醇提取法[8],可溶性糖含量的测定采用蒽酮比色法[8],可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[9],游离脯氨酸含量的测定采用酸性茚三酮法[8],丙二醛(malonaldehyde,简称MDA)含量的测定采用硫代巴比妥酸(thiobarbituric acid,简称TBA)法[8],超氧化物歧化酶(superoxide dismutase,简称SOD)活性的测定采用氮蓝四唑(nitro-blue tetrazolium,简称NBT)法[8],过氧化物酶(peroxidase,简称POD)活性的测定采用愈创木酚显色法[8]。
1.4 数据处理
采用Excel和DPS软件对数据进行统计和分析,采用Duncan’s新复极差法进行数据处理。
2 结果与分析
2.1 苗木受盐害情况调查
由表2可以看出,随着NaCl含量的升高及盐胁迫时间延长,植株受害症状越严重。在盐胁迫第7天,当盐分含量为0.5%时,苗木受盐害等级为1级,即少部分叶尖、叶缘和叶脉变黄;在盐胁迫第14天,当盐分含量为0.4%、0.5%时,苗木少部分叶尖、叶缘和叶脉变黄;在盐胁迫第21、28天,当盐分含量为0.3%、0.4%、0.5%时,苗木少部分叶尖、叶缘和叶脉变黄;在盐胁迫第35天,当盐分含量为0.4%、0.5%时,苗木受盐害等级为2级,即约1/2的叶尖和叶缘焦枯;在盐胁迫第42天,当盐分含量为0.5%时,苗木受盐害等级为3级,即大部分叶片有叶尖、叶缘焦枯和落叶现象。

表2 NaCl胁迫下苗木受盐害症状等级
2.2 NaCl胁迫对叶片细胞膜透性的影响
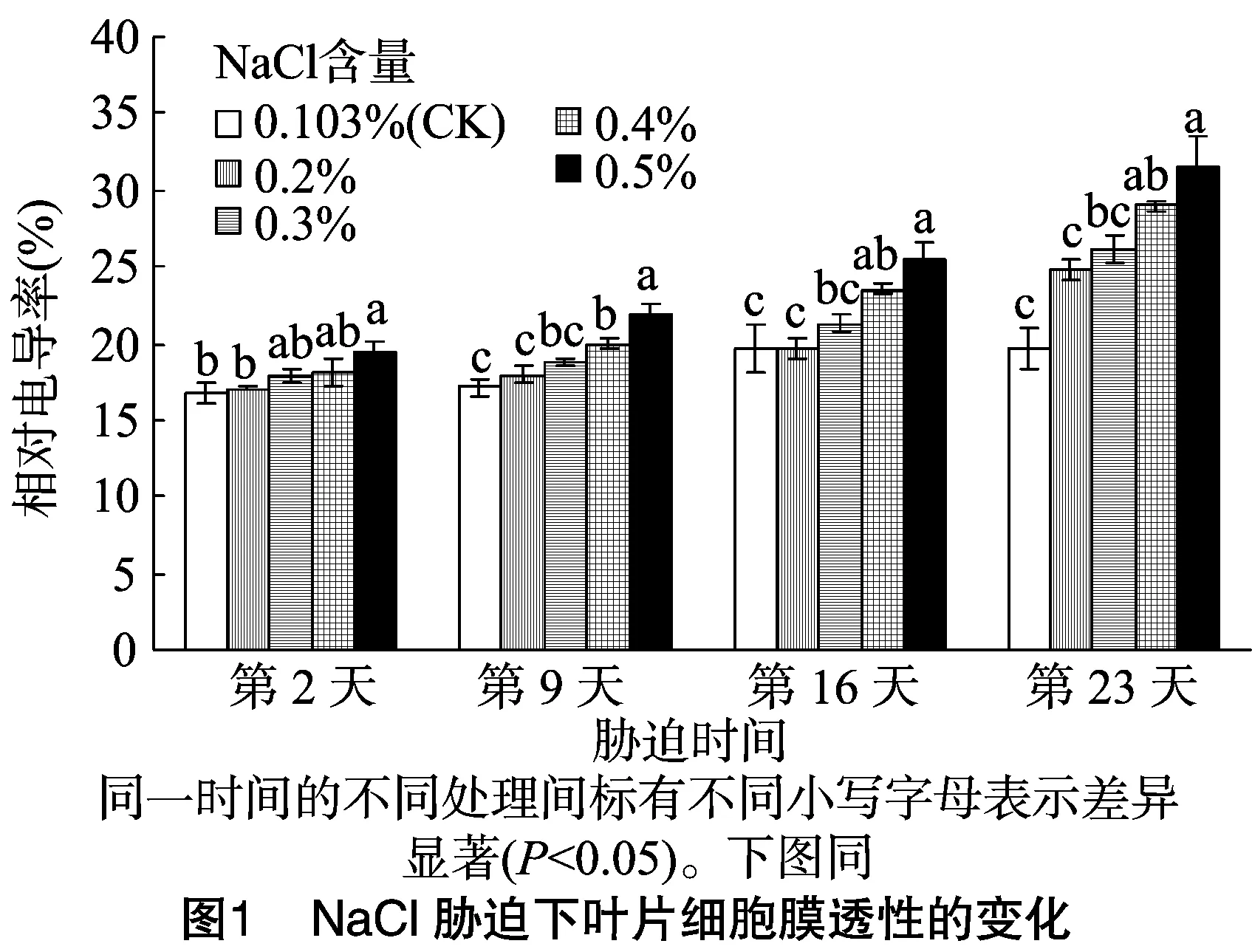
由图1可见,美国金钟连翘叶片相对电导率随着胁迫时间和NaCl含量的增加呈上升趋势。在盐胁迫第2天,当盐分含量为0.5%时,相对电导率与对照差异显著,说明该含量对叶片细胞膜有明显影响。在盐胁迫第9、16天,当盐分含量为0.4%、0.5%时,其相对电导率分别与对照差异显著。在胁迫第23天,此时累积含盐量达到预期值后又进行7 d盐胁迫处理,在0.4%、0.5%含量的盐分处理下,相对电导率均与对照差异显著。在盐胁迫第2、9、16、23天,当盐分含量为 0.5% 时,美国金钟连翘叶片相对电导率分别为对照的1.16、1.27、1.30、1.61倍,说明NaCl对叶片细胞膜的伤害逐渐加深。
2.3 NaCl胁迫对叶绿素含量的影响
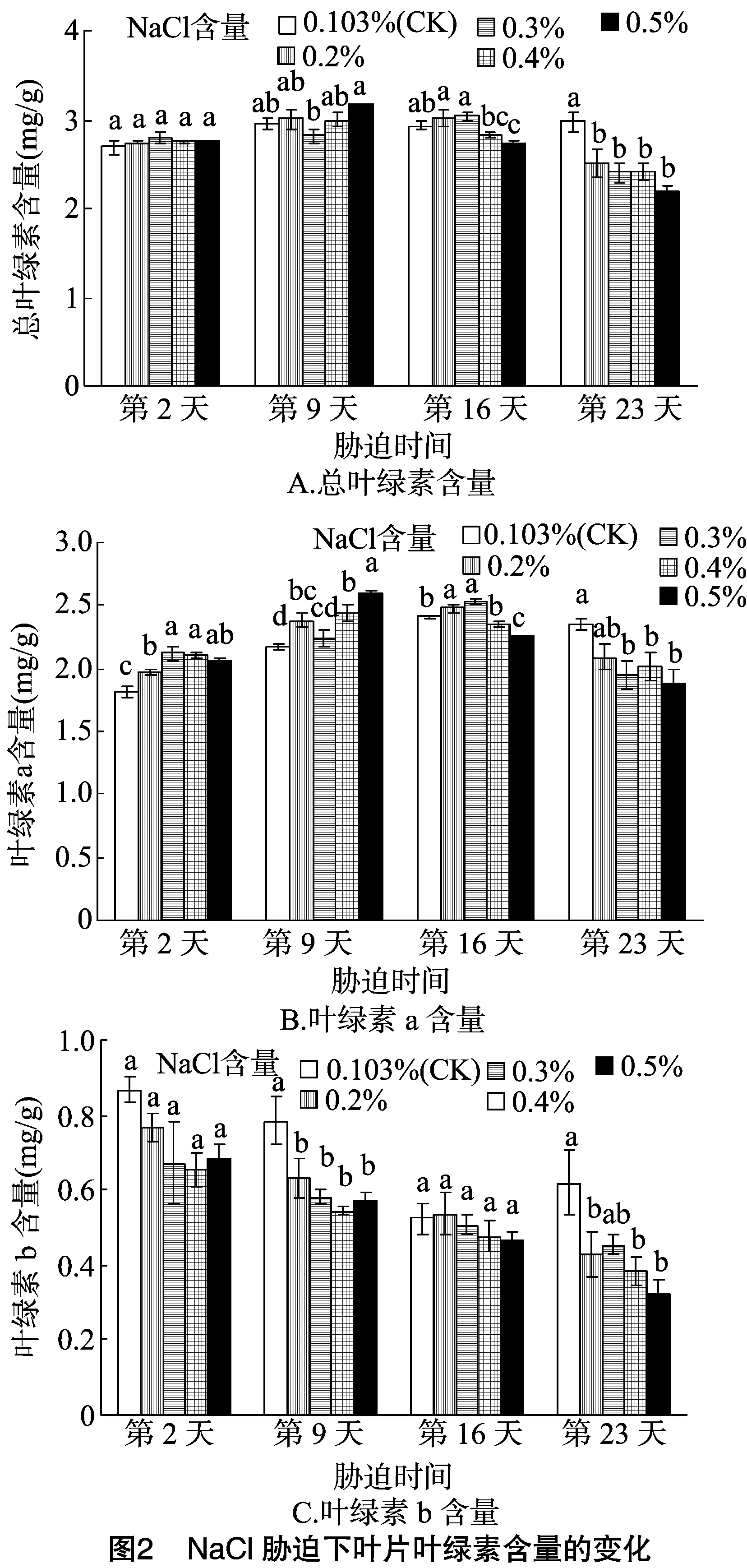
研究表明,盐胁迫会使叶绿素含量降低,且降低程度随盐含量的增大而增大[10-11]。由图2-A可见,在一定范围内,叶绿素总含量随着胁迫时间的增加和NaCl含量的升高呈先升后降的趋势。在盐胁迫第2天和第9天,各处理与对照均无显著差异;在盐胁迫第16天,当盐分含量为0.5%时,显著低于对照;在盐胁迫第23天,各处理均显著低于对照,即叶绿素含量显著下降。
由图2-B可见,在一定范围内,叶绿素a含量随着胁迫时间和NaCl含量的增加呈先升后降的趋势。在盐胁迫的第2天,各处理均与对照差异显著;在盐胁迫的第16天,当盐分含量为0.5%时显著低于对照;在盐胁迫第23天,当盐分含量为0.3%、0.4%、0.5%时,显著低于对照,即叶绿素a含量显著下降。
由图2-C可见,叶绿素b含量随着胁迫时间和NaCl含量的增加呈波动下降趋势。在盐胁迫第2天,各处理间无显著差异;在盐胁迫第9天,对照显著高于各处理,叶绿素b含量显著下降;在盐胁迫第16天,各处理间均无显著差异;在盐胁迫第23天,当盐分含量为0.2%、0.4%、0.5%时,均显著低于对照,即叶绿素b含量显著下降。
2.4 NaCl胁迫对丙二醛含量的影响
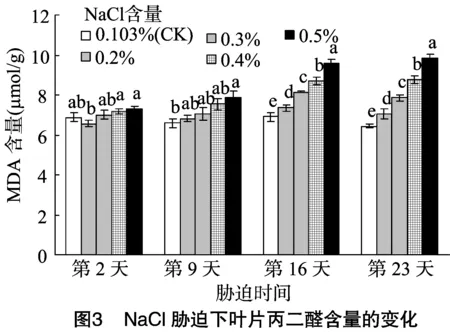
MDA是膜系统受害的重要标志之一,在盐胁迫下,植物体内丙二醛含量积累得越多,说明其组织的保护能力越弱[12]。如图3所示,随着胁迫时间及土壤中NaCl含量的增加,叶片中丙二醛含量呈上升趋势。在盐胁迫第2天,各处理与对照无显著差异;在盐胁迫第9天,当盐分含量为0.5%时,MDA含量显著高于对照;在盐胁迫的第16和第23天,各处理均与对照差异显著,即MDA含量显著高于对照;当盐分含量为0.5%时,4个胁迫时间的叶片中MDA含量分别为对照的1.06、1.20、1.39、1.53倍,说明随着盐胁迫程度的加深,其细胞膜系统的受害程度逐渐加重。
2.5 NaCl胁迫对渗透调节物质含量的影响
由图4-A可见,在一定范围内,随着胁迫时间和土壤中NaCl含量的增加,叶片中的可溶性糖含量呈先升后降再升的趋势。在盐胁迫的第2天,当盐分含量为0.3%时,可溶性糖含量显著高于对照;在盐胁迫的第16天,当盐分含量为 0.2% 时,可溶性糖含量显著低于对照;在盐胁迫的第23天,当盐分含量为0.4%、0.5%时,可溶性糖含量与对照的差异均显著。
由图4-B可见,随着盐胁迫程度的加深,叶片中可溶性蛋白含量总体呈波动下降的趋势。通过方差分析可知,在盐胁迫的第2天,叶片中的可溶性蛋白含量呈先升后降趋势,当盐分含量为0.2%、0.3%时,显著高于对照,当盐分含量为 0.5% 时,显著低于对照;在盐胁迫的第9天,当盐分含量为0.2%、0.3%时,显著高于对照;在盐胁迫的第16天,当盐分含量为0.2%时,显著低于对照;在盐胁迫的第23天,当盐分含量为0.5%时,显著低于对照。
脯氨酸是植物体内重要的渗透调节物质,在盐胁迫下能改变渗透压,起到改善细胞膜水环境和增强结构稳定的作用。相关研究表明,在盐胁迫环境下,植物体内脯氨酸会大量积累[13-14]。由图4-C可知,随着胁迫时间和土壤中NaCl含量的增加,叶片中游离脯氨酸含量呈上升趋势。当盐分含量为0.5%时,各时期游离脯氨酸含量分别为对照的1.26、1.53、2.18、2.79倍。通过方差分析可知,在盐胁迫的第2、第9天,当盐分浓度为0.2%时,与对照无显著差异,而当NaCl浓度为0.3%、0.4%、0.5%时,与对照的差异均显著。在盐胁迫的第16、23天,各处理与对照的差异均显著。

2.6 NaCl胁迫对抗氧化酶活性的影响
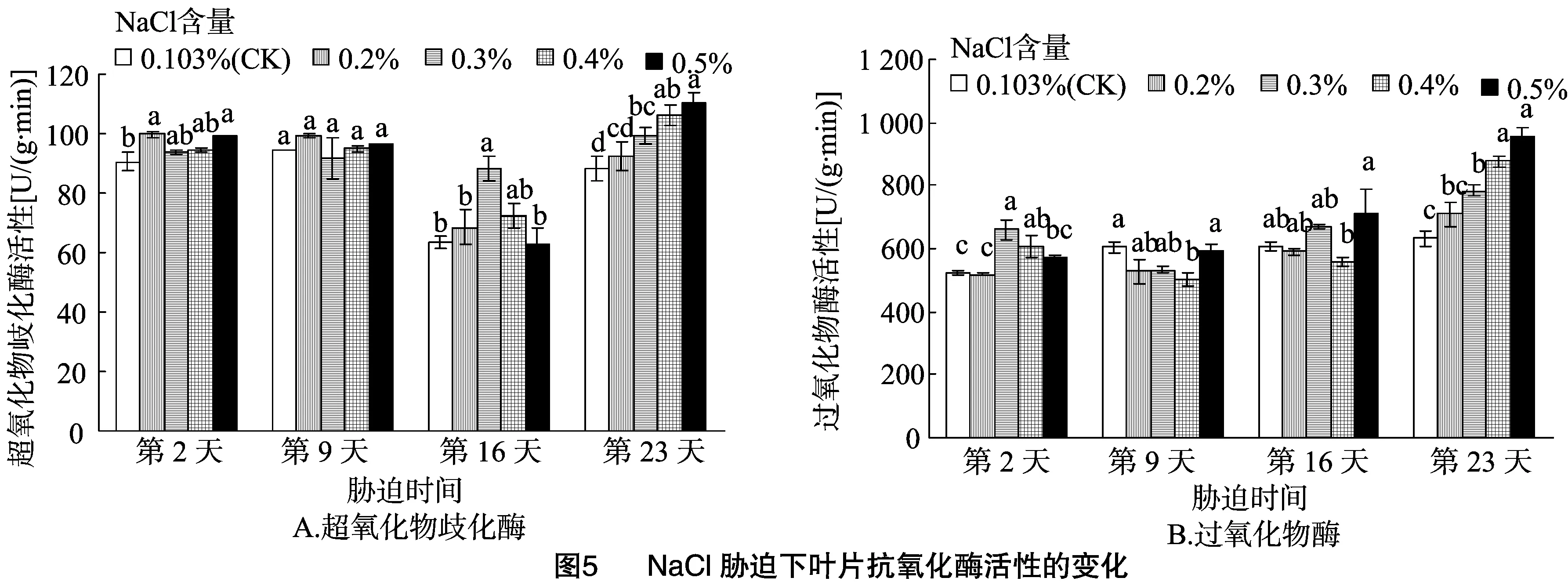
POD是一种在植物体内防护活性氧对细胞膜系统伤害的重要保护酶,可以有效清除植物体内的自由基[15]。由图 5-B 可见,叶片中POD活性逐渐上升。由方差分析可知,在盐胁迫的第2天,当盐分含量为0.3%、0.4%时,叶片中的POD活性显著高于对照;在盐胁迫的第9天,当NaCl含量为0.4%时,叶片中的POD活性显著低于对照;在盐胁迫的第23天,当盐分含量分别为0.3%、0.4%、0.5%时,POD活性显著高于对照。
3 讨论与结论
本研究发现,随着盐胁迫程度的加剧,美国金钟连翘叶片相对电导率呈上升趋势。植物在遭受盐胁迫后,其细胞膜透性会增加,胞内电解质随之外渗,因此导致植物细胞浸提液电导率增大。植物细胞膜透性的大小可反映其质膜受害程度,其数值越大,受害程度越大[16],因此在盐胁迫的第23天,当盐分含量为0.5%时,对细胞膜的影响最大,苗木受盐害程度最深。
在盐胁迫下,叶片中叶绿素含量是衡量植物耐盐性的重要指标之一。本研究发现,随着盐胁迫的加重,总叶绿素、叶绿素a和叶绿素b含量在一定范围内呈下降趋势,其中叶绿素b含量降低尤为显著。这主要是由叶绿素酶对叶绿素b的降解造成的,而对叶绿素a的影响较小。这主要是离子毒害的结果,随着NaCl浓度的增加及受盐害时间的延长,过量的Cl-渗入细胞后使原生质凝聚,导致叶绿素被破坏。这与刘行等关于盐胁迫对金露梅叶绿素的影响研究结果[10]一致。在盐胁迫的第23天,当盐分浓度为0.5%时,美国金钟连翘植株叶片约1/2的叶尖和叶缘焦枯,盐害症状加重,说明NaCl胁迫对叶绿素的抑制逐渐加强。
本研究发现,在盐胁迫下,美国金钟连翘叶片中MDA含量呈上升趋势。这与周丽霞等关于密花连翘抗盐性研究结果[17]一致。MDA是膜质过氧化的最终产物,其含量的高低反映出细胞膜质过氧化水平以及细胞膜系统受盐害程度。MDA含量升高,说明盐胁迫导致叶片中MDA迅速积累,细胞膜系统失去了原有的选择透过性,进而导致电解质渗漏,细胞水势下降。
渗透调节物质主要包括可溶性糖、可溶性蛋白质及游离脯氨酸等,渗透调节是盐胁迫的基本特征之一。本研究发现,在不同盐浓度处理下,美国金钟连翘叶片中可溶性糖含量与对照相比均有不同程度的增加。盐胁迫下植物生长受到抑制,糖利用减少,叶片内可溶性糖含量增加,调节自身的渗透平衡,从而增强自身对盐胁迫的抵御能力。随着盐胁迫程度加深,叶片正常生理功能和各种代谢受到破坏,影响了可溶性糖的合成和运输[18],导致个别处理可溶性糖含量降低。本研究发现,在盐胁迫下,在一定的时间与浓度范围内,美国金钟连翘叶片中可溶性蛋白含量呈先下降后小幅度上升的趋势。可溶性蛋白含量降低,是因为植物叶片中蛋白质分解成糖等小分子物质,这些小分子物质有稳定胶体性质的作用,从而使植物细胞在组织代谢中免受伤害或减少伤害[19];在盐胁迫下植物体内可溶性糖含量大幅增加,能有效提高自身的渗透调节能力,同时提高了胁迫蛋白的表达,引起可溶性蛋白含量的增加,所以叶片中可溶性蛋白含量小幅上升。本研究发现,随着盐胁迫的加剧,美国金钟连翘叶片中游离脯氨酸含量呈上升趋势,这与周丽霞等关于连翘抗盐性的研究结果[17,20]一致。有些研究认为,盐胁迫下游离脯氨酸含量变化与植物抗盐性存在正相关关系[21-22]。游离脯氨酸含量快速增加并代替可溶性糖和可溶性蛋白成为主要的渗透调节物质来维持渗透平衡,以减缓盐分对植物的侵害。
在盐胁迫下,植物通过增加自身SOD和POD活性来清除体内积累的活性氧和自由基,这是对盐胁迫环境的一种适应。本研究发现,美国金钟连翘叶片中SOD活性先降后升,POD活性则呈上升趋势。当盐分浓度为0.5%时,金钟连翘叶片中SOD和POD活性仍在增加,说明其对细胞膜有一定的保护作用,盐胁迫程度仍在苗木自身调节能力范围内,植物受盐害程度较轻。
本试验通过测定与抗盐性相关的指标,再结合苗木受盐害的情况可以得出,美国金钟连翘有一定的抗盐能力,当土壤中NaCl含量不超过0.3%时,植株可正常生长;当盐分含量为0.4%时,植株受盐害最高等级为2级,约1/2的叶尖和叶缘焦枯,生长状况受到一定影响;当盐分含量为0.5%时,植株受盐害最高等级为3级,大部分叶片有叶尖、叶缘焦枯和落叶现象,植株生长受到严重影响。因此,美国金钟连翘可在轻度(0.1%~0.2%)和中度(0.2%~0.4%)滨海盐碱地区栽植。为了进一步研究美国金钟连翘的抗盐能力,还可采用复合盐进行盐胁迫试验,在其实际推广应用前还须进行大田试验。
参考文献:
[1]虞 敏,虞德源. 美国金钟连翘[J]. 中国花卉园艺,2002(16):14-15.
[2]徐玮玮. 护坡植物推荐[J]. 园林,2008(11):62-63.
[3]唐家良,丁德蓉. 水土保持药用植物——连翘[J]. 中国野生植物资源,2002,21(1):45,55.
[4]Parida A K,Das A B. Salt toleranee and salinity effects on plants:a review[J]. Eeotoxieology and Environ mental Safety,2005,60(3):324-349.
[5]张华新,刘正祥,刘秋芳. 盐胁迫下树种幼苗生长及其耐盐性[J]. 生态学报,2009,29(5):2263-2271.
[6]Guo H J,Tao H U,Jin-Min F U. Effects of saline sodic stress on growth and physiological responses ofLoliumperenne[J]. Acta Prataculturae Sinica,2012,21(1):118-125.
[7]孙 晶,王庆成,刘 强,等. NaHCO3胁迫下朝鲜接骨木和茶条槭苗木的生长及生理响应[J]. 林业科学,2010,46(8):71-77.
[8]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[9]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:15-16,142-143.
[10]刘 行,张彦广. 盐胁迫对金露梅叶片酶活性和叶绿素含量的影响[J]. 西部林业科学,2016,45(4):95-100.
[11]许 兴,米海莉. NaCl胁迫对小麦幼苗生长、叶绿素含量及Na+、K+吸收的影响[J]. 西北植物学报,2002,22(2):278-284.
[12]何树斌,刘国利,杨惠敏. 不同水分处理下紫花苜蓿刈割后残茬的光合变化及其机制[J]. 草业学报,2009,18(6):192-197.
[13]Muthukumarasamy M,Gupta S D,Pannerselvam R. Enhancement of peroxidase,polyphenol oxidase and superoxide dismutase activities by triadimefon in NaCl stressedRaphanussativusL.[J]. Biologia Plantarum,2000,43(2):317-320.
[14]Singh S K,Sharma H C,Goswami A M,et al.Invitrogrowth and leaf composition of grapevine cultivars as affected by sodium chloride[J]. Biol Plant,2000,43(43):283-286.
[15]武 德. 绒毛白蜡种苗耐盐碱性研究[D]. 泰安:山东农业大学,2007.
[16]王阿丽. 四种连翘属植物抗旱性比较[D]. 保定:河北农业大学,2015.
[17]周丽霞,刘 芳,高行英,等. 盐胁迫对密花连翘生长及生理特性的影响[J]. 天津农学院学报,2011,18(4):5-8.
[18]刘炳响. 白榆耐盐差异性研究[D]. 保定:河北农业大学,2008.
[19]文 笑. 盐胁迫对台湾桤木幼苗生理生化和光合特性影响的研究[D]. 福州:福建农林大学,2011.
[20]刘昊华. 连翘的耐盐性研究[J]. 水土保持应用技术,2013(1):1-3.
[21]Petrusa L M,Winicov I. Proline status in salt-tolerant and salt-sensitive alfalfa cell lines and plants in response to NaCl[J]. Plant Physiol Biochem,1997,35(4):303-310.
[22]傅秀云,崔光泉,林 昶. 冬小麦耐盐力与脯氨酸含量的关系[J]. 山东农业科学,1988(2):5-7.

