基于TPD单元的给体光伏材料的合成及性能表征
王 坤, 张金秋, 张旺玺, 米立伟, 张小立, 穆云超, 李永舫
(1.中原工学院 材料与化工学院, 河南 郑州 450007; 2.中国科学院化学研究所 有机固体研究室, 北京 100190)
近年来,随着新型有机太阳能电池给体材料的不断问世以及光伏器件的进一步优化,聚合物太阳能电池的能量转换效率得到了很大提高。单层聚合物太阳能电池效率已经超过11%[1-4],接近于商业化应用的标准。目前研究最多的光伏电池给体材料为由给电子单元(D)和吸电子单元(A)交替共聚得到的D-A型窄带隙聚合物[5-8]。该类材料可以通过选择合适的D、A单元,利用两者的相互作用实现吸收光谱的拓宽和分子能级的有效调控。研究发现,聚合物主链上 D、A单元之间噻吩或者噻吩并噻吩类共轭桥的引入能有效改善分子的平面性,增强分子间的相互作用力,同时也能有效拓宽聚合物的吸收光谱;另一方面,不同共轭桥的引入对材料的能级会产生较大的影响。因此,通过选择D-A型窄带隙聚合物主链上共轭桥,对器件光伏性能能够进行有效调控[9-11]。
噻吩并吡咯二酮(Thieno[3,4-c]pyrrole-4,6-dione(TPD))单元的研究成果最早由Zhang Q T等在1997年发布[12],直到2010年才被用到有机太阳能电池中[13],并获得了5.5%的光电转换效率和0.85 V的开路电压,这主要得益于TPD单元较强的吸电子能力及其对称的平面结构。随后, Chu T Y及其合作者报道了一种基于TPD单元和二噻吩硅咯单元的共聚物PDTSTPD,在活性层面积为1.0 cm2的光伏器件中获得了7.3%的光电转换效率,这主要是由于该共聚物具有较窄的带隙(1.73 eV)、深的最高占据轨道(HOMO)能级(5.57 eV)和好的溶解性[14]。几乎同时,Amb C M等报道了一种类似的聚合物PDTG-TPD,发现PDTG-TPD和(6,6)-苯基C71丁酸甲基酯共混并作为反向器件的光活性层能够获得7.3%的光电转换效率[15]。随后,该课题组以ZnO修饰的聚合物纳米粒子作为电子传输层,将器件效率进一步提高到了8.5%,这主要是由于电荷收集效率得到了有效的提高[16]。2014年,Kim J H等用一种基于TPD单元的中带隙共聚物PBDTT-ttTPD,获得了6.81%的光电转换效率,在叠层光伏器件中获得了9.35%的光电转换效率[17]。不久之后,一种简单的共聚物PT-ttTPD也获得了9.21%的光电转换效率[18]。这些研究结果表明,基于TPD单元的D-A共聚物在能够以溶液形式加工的有机光伏器件中有望获得高的光电转换效率。TPD的平面结构有利于电子在聚合物主链上离域,而且其强的吸电子性可以同时调节聚合物的HOMO和最低空轨道(LUMO)能级,因此TPD单元被广泛应用于聚合物的制备。本文以TPD为受体单元,通过在其两侧连接噻吩环进一步增大电子离域范围和材料的平面结构,以合成TPD两侧共轭两个噻吩环的单体(DTTPD),并设计合成以DTTPD为受体单元的4种D-A型共聚物;分别利用核磁共振法、凝胶渗透色谱分析法、热失重法、紫外-可见光谱吸收法、电化学循环伏安法、理论模拟计算法,对材料的结构和光物理、光化学性能进行详细研究。结果表明,这4种共聚物具有较宽的吸收光谱、良好的热稳定性能、合适的能级,能够满足光伏器件对材料的要求,可用于制备有机光伏器件。
1 实 验
1.1 实验方法
(1)1H-NMR和13C-NMR法:Bruker ARX400核磁共振仪(400 MHz)。测试条件:温度为25 ℃,内标为Si(CH3)4,溶剂为CDCl3。
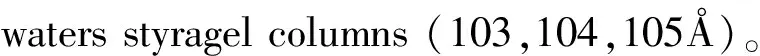
(3)热失重(TGA)法:美国TA公司的Q50热重分析仪。采用高纯氮气保护方式,升温速率为10 ℃/min,温度范围为25~650 ℃。
(4)紫外-可见光谱(UV-vis)吸收法:PE Lamda25型紫外可见光谱仪。溶液试样以三氯甲烷(CHCl3)为溶剂,固体样品成膜于石英片上。
(5)电化学循环伏安(CV)法:氧化还原电位采用CHI 660E型电化学工作站测定。以涂有聚合物薄膜的铂电极为工作电极,金属铂丝为对电极,Ag/Ag+为参比电极;以0.1 mol/L四丁基六氟磷酸铵(Bu4NPF6)的无水乙腈溶液为电解质溶液。扫描速度为100 mV/s,用于测试的样品薄膜采用三氯甲烷溶液涂膜制备。
(6) 理论模拟计算:利用密度泛函理论在6-31G基组下对3个重复单元进行模拟计算。
1.2 D-A型共聚物的合成
以3,4-噻吩二羧酸为起始原料,按照文献[13]中方法合成图1所示化合物(3)。其他原料和试剂在无特别说明的情况下购买后直接使用。
1.2.1 单体DTTPD的合成
(1)化合物(4)的合成:将化合物(3)(2.95 g,5 mmol)和4-辛基-3-四丁基锡噻吩(6.07 g,2.5 mmol,2.5 eq)溶于60 mL甲苯中,氩气保护,加入86 mg催化剂四三苯基磷钯(Pd(PPh3)4),加热至110 ℃,反应12 h,待反应冷却至室温后倒入100 mL甲醇中,再于真空中旋蒸。以石油醚/二氯甲烷(CH2Cl2)=10∶1为洗脱剂进行柱色谱分离,得到2.87 g淡黄色固体产物,其产率为70%。1H-NMR(400 MHz,CDCl3,百万分之一),化学位移(δ):7.65(d,2H),7.06(d,2H),3.52(d,6H),1.25(m,57H),0.89-0.83(m,12H)。这里,d代表双重峰,m代表多重峰。

图1 DTTPD单体合成路线
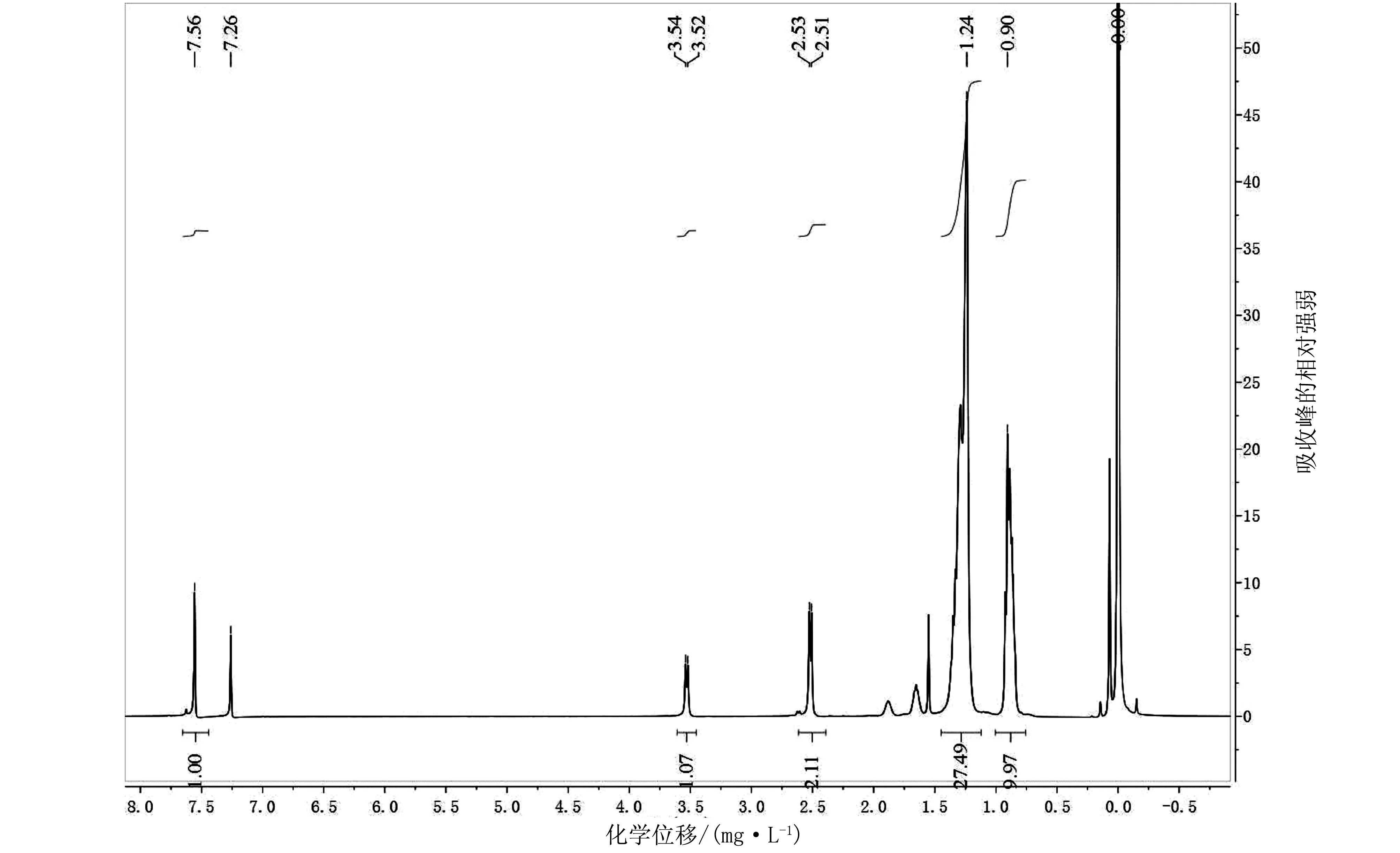
(2)化合物DTTPD的合成:将2.04 g图1所示化合物(4)(2.5 mmol)溶于50 mL CHCl3/醋酸(HAc)=1∶1的混合溶液中,冰水浴冷却至0 ℃,分批加入N-溴代琥珀酰亚胺(0.97 g,5.5 mmol,2.2 eq),室温反应12 h,倒入100 mL冰水中,经CH2Cl2萃取,饱和氯化钠溶液反萃,无水硫酸镁干燥,真空下旋蒸,柱色谱分离(以石油醚/CH2Cl2=10∶1为洗脱剂),得到2.05 g黄色油状液体,其产率为84%。1H-NMR(400 MHz,CDCl3,百万分之一),δ:7.56(s,2H), 3.54(s,2H),2.52(d,6H),1.25(m,55H),0.89(m,12H)(这里s代表单峰);13C-NMR(400 MHz,CDCl3,百万分之一),δ:162.92,143.03,135.62,131.95,130.86,128.54,114.47,43.23,40.11,37.09,33.94,32.62,32.15,32.13,31.70,30.22,29.88,29.84,29.78,29.59,29.54,28.94,26.53,25.83,23.28,22.92,14.36,11.01.
1.2.2 D-A型共聚物的合成
D-A型共聚物的合成路线如图2所示。
4种聚合物的合成步骤相似,即:将单体DTTPD(0.294 g,0.3 mmol)与0.3 mmol的双锡单体共混溶于12 mL甲苯中,氩气保护,以6% (摩尔百分比)的Pd(PPh3)4作为催化剂,反应10~16 h,趁热将反应液倒入100 mL甲醇中沉降,然后过滤,以CHCl3为洗脱剂进行柱色谱分离,得产物。
(1)PDTTPD-T:(170 mg,深蓝色),Mw=92.70 kDa,Mn=45.26 kDa,PDI=2.05。
(2)PDTTPD-Se:(150 mg,蓝黑色),Mw=121.38 kDa ,Mn=68.56 kDa,PDI=1.77。
(3)PDTTPD-TT:(180 mg,蓝黑色),Mw=154.37 kDa,Mn=57.14 kDa,PDI=2.70。
(4)PDTTPD-DT:(180 mg,蓝黑色),Mw=93.66 kDa,Mn=47.23 kDa,PDI=1.98。
这里:Mw为重均分子量;Mn为数均分子量;PDI指聚合物分散性指数。
2 结果与分析
2.1 聚合物的合成
图1中化合物(3)按照已有文献中方法进行合成;以Pd(PPh3)4为催化剂,采用Stille耦连方法合成化合物(4),由于含锡单体的纯度无法具体测定,故在使用过程中使其过量(1H-NMR谱图如图3所示);单体DTTPD的合成以CHCl3/HAC=1∶1(V/V)作为溶剂,可有效提高其产率,且后处理简单 (DTTPD单体的1H-NMR谱图见图4,其13C-NMR谱图见图5)。4类聚合物的合成方法一样,都以甲苯为溶剂,以Pd(PPh3)4为催化剂,通过给体单元和受体单元共聚获得,反应完成后先进行沉降,将部分副产物去掉,然后经过柱分离即可获得分子量分布较窄的目标产物。

图2 D-A型共聚物合成路线

注:吸收峰的相对强弱无量纲。图3 化合物(4)的1H-NMR谱图
注:吸收峰的相对强弱无量纲。图4 DTTPD单体的1H-NMR谱图
注:吸收峰的相对强弱无量纲。图5 DTTPD单体的13C-NMR谱图
2.2 聚合物的性能表征
2.2.1 紫外-可见吸收光谱


(a) 4种聚合物在CHCl3溶液中 (b) 4种聚合物在膜状态下图6 聚合物的紫外-可见吸收光谱
2.2.2 电化学性能分析
材料的能级对器件的光伏性能,尤其是器件的开路电压有直接的影响。采用电化学循环伏安法测定目标聚合物的氧化还原峰,可得图7所示的聚合物循环伏安曲线。通过公式HOMO=-e(φox+4.71)(eV)和LUMO=-e(φred+4.71) (eV)[19-21]可分别计算出材料的HOMO和LUMO能级。4种聚合物的电化学数据如表1所示。
从表1可以看出,合成的目标产物具有较高的起始氧化电位,HOMO能级都较低,这有利于获得高的开路电压。同时,高的氧化电位也表明聚合物具有较高的稳定性。因此,所合成的目标聚合物适合用作有机太阳能电池的给体材料。
2.2.3 热稳定性分析
可采用热失重分析(TGA)法来测试聚合物的热稳定性能。4种聚合物的热失重曲线如图8所示。
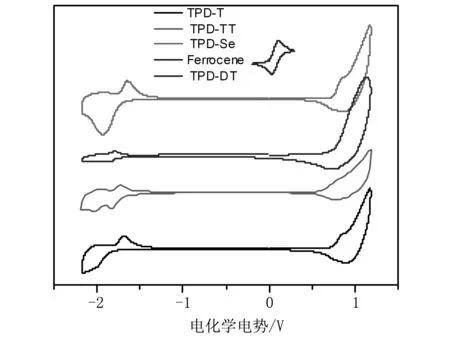
注:以Ag/Ag+为参比电极。图7 聚合物PDTTPD-T、PDTTPD-Se、PDTTPD-TT和PDTTPD-DT的循环伏安曲线
从图8可以看出,当聚合物的热失重达到5%时,PDTTPD-T、PDTTPD-Se、PDTTPD-TT和PDTTPD-DT的分解温度分别为369 ℃、421 ℃、397 ℃和319 ℃,这说明4种聚合物都具有较好的热稳定性能,完全能够应用于光电子器件。另外,这4种聚合物具有不同的主链结构,对于5%的热分解温度也表现出了很大的差别,表明分子主链结构对材料的热稳定性影响很大。同时需要注意的是,PDTTPD-T和PDTTPD-Se具有类似的结构,噻吩和硒吩也仅是一个原子的差别,但材料的性能却发生了很大的变化,这正是结构决定性能的道理。

表1 聚合物PDTTPD-T、PDTTPD-Se、PDTTPD-TT和PDTTPD-DT 的电化学数据

注:氮气氛围,升温速度为10 ℃/min。图8 4种聚合物的热失重曲线
2.2.4 分子量分布
分子量大小是聚合物的一个重要特征,有机太阳能电池中分子量的大小在某种程度上直接决定着光电转换效率的高低。聚合物的分子量具体数据如表2所示。本文采用凝胶渗透色谱(GPC)法测定了聚合物的分子量(见图9~图12)。
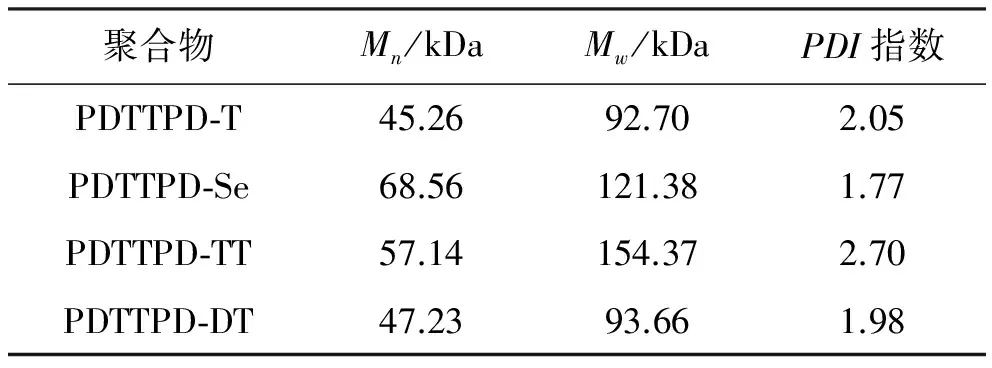
表2 聚合物PDTTPD-T、PDTTPD-Se、PDTTPD-TT和PDTTPD-DT的分子量具体数据
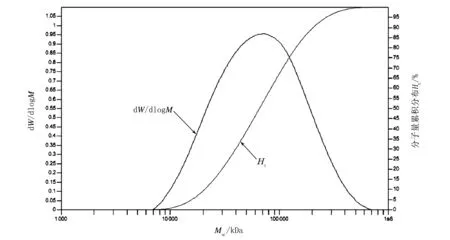
注:W为溶液中聚合物重量;M为溶液中聚合物含量。图9 聚合物PDTTPD-T的分子量分布曲线

注:W为溶液中聚合物重量;M为溶液中聚合物含量。图10 聚合物PDTTPD-Se的分子量分布曲线
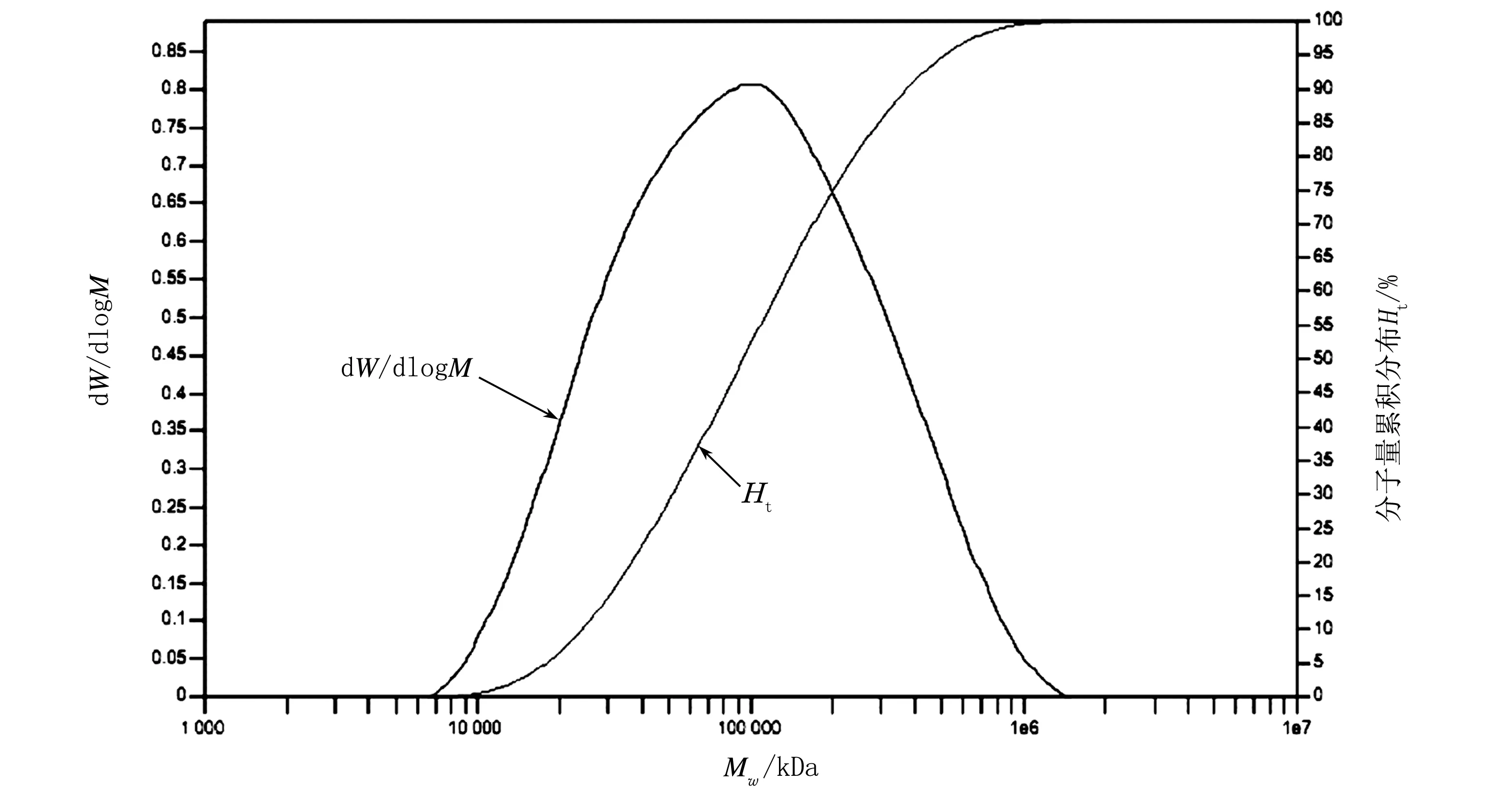
注:W为溶液中聚合物重量;M为溶液中聚合物含量。图11 聚合物PDTTPD-TT的分子量分布曲线

注:W为溶液中聚合物重量;M为溶液中聚合物含量。图12 聚合物PDTTPD-DT的分子量分布曲线
从图9~图12可以看出,所合成的聚合物都具有较大的分子量和较窄的分子量分布。从分子量及其分布来看,这4种聚合物完全能够满足有机光伏器件对材料性能的要求。
2.2.5 理论模拟计算
为了研究聚合物的几何构型和电子云分布,可利用密度泛函理论对聚合物PDTTPD-T、PDTTPD-Se、PDTTPD-TT和PDTTPD-DT进行理论模拟计算。为了节省计算时间并降低计算难度,可将含有3个重复单元的寡聚物作为模拟对象,并以甲基代替分子中的烷基链。4种聚合物的电子云分布和几何构型侧视图如图13所示。
从图13可以看出:对于HOMO轨道,电子云集中分布在聚合物主链上;对于LUMO轨道,电子云集中分布在受体单元上。HOMO和LUMO能级变化趋势大致与使用电化学循环伏安法测得的结果一致。从模拟计算的最优模型侧视图可以看出,聚合物的分子平面性较好,有利于在膜状态下获得更好的分子堆积,进而改善聚合物的电荷传输性能。另外,从侧视图看聚合物分子的平面性,能够更好地解释聚合物在溶液和膜状态下的紫外-可见吸收光谱特性,即分子具有更好的平面性时吸收光谱会红移。这也就是说,分子的平面性越好,分子间的π-π堆积就越好,红移越明显。

(a)PDTTPD-T:HOMO能级为-4.87 eV(上左);LUMO能级为-2.65 eV(上右);分子侧视图(下)

(b)PDTTPD-Se:HOMO能级为-4.83 eV(上左);LUMO能级为-2.68 eV(上右);分子侧视图(下)

(c)PDTTPD-TT:HOMO能级为-4.89 eV(上左);LUMO能级为-2.65 eV(上右);分子侧视图(下)
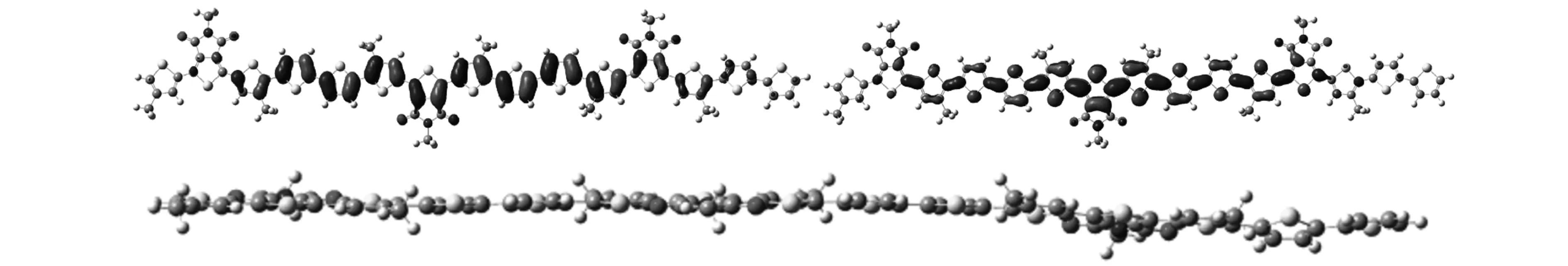
(d)PDTTPD-DT:HOMO能级为-4.80 eV(上左);LUMO能级为(上右)-2.66 eV;分子侧视图(下)图13 聚合物PDTTPD-T、 PDTTPD-Se、 PDTTPD-TT和PDTTPD-DT的电子云分布和几何构型侧视图
3 结 语
以TPD单元为受体单元,通过TPD两侧连接共轭噻吩单元设计合成了具有更大电子离域体系的DTTPD单元,并用核磁共振法对合成的单元进行了结构表征。结果表明,所得到的目标产物纯度较高。以4种简单的给体单元噻吩、硒吩、并噻吩和联二噻吩分别与DTTPD共聚,合成了4种D-A型共聚物PDTTPD-T、PDTTPD-Se、PDTTPD-TT和PDTTPD-DT。采用核磁共振法对所合成化合物进行了结构确认,并分别用紫外-可见光谱吸收法、电化学循环伏安法、热失重法、凝胶渗透色谱分析法、高斯理论模拟计算法等对所合成的聚合物进行了光物理和光化学性能表征。结果表明,所合成的4种共聚物在紫外-可见光范围内具有宽的吸收、合适的前线能级轨道、较好的热稳定性、较大的分子量以及较窄的分子量分布。理论模拟计算也在一定程度上印证了实验结果。所合成的共聚物适合用作有机太阳能电池的光活性层材料。
致谢:
谨以本文公开发表献给李永舫院士70岁生日。
参考文献:
[1] Li M, Gao K, Wan X, et al. Solution-processed organic tandem solar cells with power conversion efficiencies>12%[J].Nature Photonics, 2017, 11: 85-90.
[2] Baran D, Ashraf R S, Hanifi D A, et al. Reducing the efficiency-stability-cost gap of organic photovoltaics with highly efficient and stable small molecule acceptor ternary solar cells[J]. Nature Materials, 2017, 16: 363-369.
[3] Kumari T, Leea S M, Kanga S H, et al. Ternary solar cells with a mixed face-on and edge-on enable an unprecedented efficiency of 12.1%[J]. Energy Environmental Science, 2017, 10: 258-265.
[4] Bin H, Yang Y , Zhang Z G , et al. 9.73% efficiency nonfullerene all organic small molecule solar cells with absorption-complementary donor and acceptor[J].Journal of the American Chemical Society, 2017, 139(14): 5085-5094.
[5] Yu G, Gao J, Hummelen J C, et al. Polymer photovoltaic cells: enhanced efficiencies via a network of internal donor-acceptor heterojunctions[J]. Science, 1995, 270: 1789-1791.
[6] Zhao W , Qian D , Zhang S, et al. Fullerene-free polymer solar cells with over 11% efficiency and excellent thermal stability[J]. Advanced Materials, 2016, 28(23): 4734-4739.
[7] Zhang K, Gao K, Xia R, et al. High-performance polymer tandem solar cells employing a new n-type conjugated polymer as an interconnecting layer[J]. Advanced Materials, 2016, 28(24): 4817-4823.
[8] Zhao J, Li Y, Yang G, et al. Effcient organic solar cells processed from hydrocarbon solvents[J]. Nature Energy, 2016, 1(2): 15027.
[9] Li G, Shrotriya V, Huang J, et al. High-efficiency solution processable polymer photovoltaic cells by self-organization of polymer blends[J]. Nature Materials,2005, 4: 864-868.
[10] Dang M T, Hirsch L, Wantz G, et al. Controlling the morphology and performance of bulk heterojunctions in solar cells. Lessons learned from the benchmark poly(3-hexylthiophene):[6,6]-phenyl-C61-butyric acid methyl ester system[J].Chemical Reviews, 2013, 113(5): 3734-3765.
[11] Zhang M, Guo X, Ma W, et al. A polythiophene derivative with superior properties for practical application in polymer solar cells[J].Advanced Materials, 2014, 26(33): 5880-5885.
[12] Zhang Q T, Tour J M. Low optical bandgap polythiophenes by an alternating donor/acceptor repeat unit strategy[J].Journal of the American Chemical Society, 1997, 119(21): 5065-5066.
[13] Zou Y, Najari A, Berrouard P, et al. A thieno[3,4-c]pyrrole-4,6-dione-based copolymer for efficient solar cells[J]. Journal of the American Chemical Society, 2010, 132(15): 5330-5331.
[14] Chu T Y , Lu J, Beaupr É S, et al. Bulk heterojunction solar cells using thieno[3,4-c]pyrrole-4,6-dione and dithieno[3,2-b:2′,3′-d]silole copolymer with a power conversion efficiency of 7.3%[J].Journal of the American Chemical Society, 2011, 133(12): 4250-4253.
[15] Amb C M, Chen S, Graham K R , et al. Dithienogermole ss a fused electron donor in bulk heterojunction solar cells[J]. Journal of the American Chemical Society, 2011, 133(26): 10062-10065.
[16] Small C E, Chen S, Subbiah J, et al. High-efficiency inverted dithienogermole-thienopyrrolodione-based polymer solar cells[J]. Nature Photonics, 2012, 6: 115-120.
[17] Kim J H, Park J B, Xu F , et al. Effect of p-conjugated bridges of TPD-based medium bandgap conjugated copolymers for efficient tandem organic photovoltaic cells[J]. Energy Environmental Science, 2014, 7: 4118-4131.
[18] Kim J H, Park J B, Jung I H, et al. Well-controlled thieno[3,4-c]pyrrole-4,6-(5H)-dione based conjugated polymers for high performance organic photovoltaic cells with the power conversion efficiency exceeding 9% [J]. Energy Environmental Science, 2014, 8: 2352-2356.
[19] Li Y, Cao Y, Gao J, et al. Electrochemical properties of luminescent polymers and polymer light-emitting electrochemical cells[J]. Synthetic Metals,1999, 99(3): 243-248.
[20] Sun Q, Wang H, Yang C, et al. Synthesis and electroluminescence of novel copolymers containing crown ether spacers[J]. Journal of Materials Chemistry , 2003, 13(4): 800-806.
[21] Cardona C M , Li W, Kaifer A E, et al. Electrochemical considerations for determining absolute frontier orbital energy levels of conjugated polymers for solar cell applications[J].Advanced Materials, 2011, 23(20): 2367-2371.

