核桃多肽-苦荞-藜麦复合粉制备工艺及体外消化和抗氧化功能特性分析
陈树俊,李 乐,胡 洁,徐晓霞,石 玥,李佳益,张君梅,王翠连
(山西大学生命科学学院,山西 太原 030006)
核桃具有很高的营养和保健价值[1-2]。核桃多肽作为一种植物蛋白多肽具有还原能力强、溶解性高、抑菌性好等多种生理活性,且在食品、保健品、医药等行业中有较为广泛的应用[3-4]。苦荞是一种独特的食药两用作物之一,富含优质蛋白及黄酮、多酚、膳食纤维等多种营养成分,具有降血脂、降血糖、抗癌抑瘤、抗氧化等保健功能[5]。藜麦是一种富含钙、硒、铁、钾、锌等多种矿物质的“类全谷物”[6],酚类物质含量高于其他一般谷物,具有良好的开发前景[7-8]。现代营养学理论认为,蛋白质营养价值与氨基酸组成密切相关,氨基酸组成越接近其必需氨基酸组成模式,越接近标准蛋白,其营养价值越高[9]。张金振等[10]采用国际上通用的营养价值评价方法对13 种植物蜂花粉蛋白质进行了综合评价。胡秋辉等[11]根据蛋白质互补作用原理研究并评价了富硒米糠蛋白的营养复配。王芳等[12]以联合国粮食及农业组织与世界卫生组织(United Nations Food Agriculture Organization/World Health Organization,FAO/WHO)氨基酸模式为评价标准全面评价了桑叶蛋白的营养价值。国内外有关标准蛋白的研究方向较少,局限于评价单一食品或植物蛋白的营养价值,对于谷物蛋白的复配鲜为报道。
谷物淀粉加水糊化溶液黏稠,通过添加适当淀粉酶可以水解成小分子糖,从而降低黏稠度,取代食品中添加糖,更有利于人体消化吸收。徐晓霞等[13]根据蛋白质互补理论确定了苦荞、燕麦、杏鲍菇最佳复配比,并对复合粉进行液化和糖化工艺的研究。刘晓娟等[14]对苦荞、燕麦复合粉进行糊化、液化、糖化,研制出一种辅助食品。陈树俊等[15]以小米、藜麦为原料探讨了二者复配后最佳液化、糖化条件及乳化剂、增稠剂对体系稳定性的影响。本实验借鉴前人经验,根据蛋白质营养价值评价方法确定出核桃多肽-苦荞-藜麦最佳复配比例,先对苦荞藜麦复合粉进行糊化、液化、糖化,将淀粉大分子水解为小分子糖,再按照科学配比加入易于消化吸收的核桃多肽,经喷雾干燥后得到核桃多肽-苦荞-藜麦复合营养粉,在此基础上对复合粉进行了体外模拟消化和抗氧化功能特性的研究。旨在为大多数人群提供一种易于消化吸收且具有较高营养价值和抗氧化功能的辅助食品,为今后的相关研究提供一定的参考价值。
1 材料与方法
1.1 材料与试剂
核桃多肽液 山西大学生物工程基础实验室自制[16];苦荞粉 山西佳鑫食业有限责任公司;藜麦粉山西稼祺农业科技有限公司;α-淀粉酶(3 700 U/g)、β-淀粉酶(100 000 U/g)、糖化酶(100 000 U/g)、胃蛋白酶(10 000 U/g)、胰蛋白酶(250 000 U/g) 北京索莱宝科技有限公司;葡萄糖、碘、碘化钾、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、氢氧化钠、铁氰化钾、三氯乙酸、硫酸亚铁(均为分析纯) 天津市风船化学试剂科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;总抗氧化能力(T-AOC)检测试剂盒 南京建成生物工程有限公司。
1.2 仪器与设备
835-50型高速氨基酸分析仪 日本日立公司;YC-1800型实验室喷雾干燥机 上海雅程仪器设备有限公司;WFZ UV-2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;电热恒温水浴锅 兴化市佳明仪表有限公司。
1.3 方法
1.3.1 常规营养成分的测定
蛋白质含量的测定:凯氏定氮法(GB/T 5009.5—2010《食品中蛋白质的测定》);淀粉含量的测定:酸水解法(GB/T 5009.9—2008《食品中淀粉的测定》);氨基酸含量的测定:GB/T 5009.124—2003《食品中氨基酸的测定》。
1.3.2 其他成分的测定
糊化度测定采用酶水解法[17];还原糖含量测定采用DNS法[18];多肽、黄酮和多酚含量测定参见文献[19-21]。
1.3.3 蛋白质的评价
采用朱圣陶等[22]推荐的评价方法,将苦荞和藜麦蛋白按不同比例复合,计算不同比例复合后待测蛋白各必需氨基酸含量,选择FAO/WHO氨基酸模式评价待测蛋白与参考蛋白接近程度。按照公式(1)~(4)依次计算待测蛋白氨基酸比值(ratio of amino acid,RAA)、氨基酸比值系数(ratio coeff i cient of amino acid,RCAA)和氨基酸比值系数分(score of ratio coeff i cient of amino acid,SRCAA),从而确定苦荞和藜麦蛋白最适质量比。在此基础上,将核桃蛋白和最佳比例复合后的苦荞藜麦蛋白按照不同比例复合,重复上述计算过程进而确定核桃蛋白和苦荞藜麦蛋白的最适质量比,根据核桃多肽、苦荞和藜麦原料的蛋白含量,通过折算,最终确定3 种原料的最佳复配比。

1.3.4 苦荞-藜麦复配谷物液化条件的确定
1.3.4.1 苦荞-藜麦复配谷物液化单因素试验
通过预实验对样品糊化过程进行简便快捷的趋势分析,即以糊化度为指标,根据单因素试验确定了苦荞-藜麦粉最佳糊化条件为料液比1∶9(g/mL)、温度80 ℃、时间50 min。
在糊化的基础上,以还原糖质量浓度为指标,考察α-淀粉酶添加量(4、5、6、7、8 U/g),温度(50、60、70、80、90 ℃),时间(20、30、40、50、60 min)3 个因素对液化效果的影响,固定初始液化条件为α-淀粉酶添加量6 U/g、温度70 ℃、时间40 min,利用控制变量法进行条件筛选。
1.3.4.2 苦荞-藜麦复配谷物液化正交试验
根据单因素试验结果,以还原糖质量浓度为指标,选择α-淀粉酶添加量、温度和时间进行3因素3水平正交试验,因素与水平设计见表1。
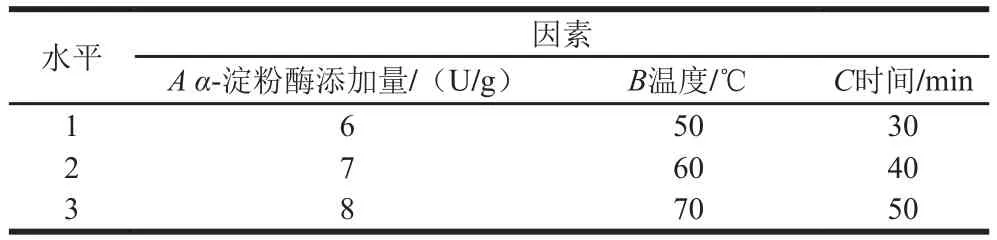
表1 液化正交试验因素与水平Table1 Coded levels and corresponding actual levels of independent variables used in orthogonal array design for optimization of liquefaction conditions
1.3.5 苦荞-藜麦复配谷物糖化条件的确定
1.3.5.1 苦荞-藜麦复配谷物糖化单因素试验
在液化基础上,以还原糖质量浓度为指标,考察β-淀粉酶添加量(50、100、150、200、250 U/g),温度(50、55、60、65、70 ℃),时间(1.0、1.5、2.0、2.5、3.0 h)3 个因素对糖化效果的影响,固定初始糖化条件为β-淀粉酶添加量150 U/g、温度60 ℃、时间2.0 h,利用控制变量法进行条件筛选。
1.3.5.2 苦荞-藜麦复配谷物糖化正交试验
根据单因素试验结果,以还原糖质量浓度为指标,选择β-淀粉酶添加量、温度和时间进行3因素3水平正交试验,因素及水平设计见表2。

表2 糖化正交试验因素与水平Table2 Coded levels and corresponding actual levels of independent variables used in orthogonal array design for optimization of saccharif i cation conditions
1.3.6 核桃多肽-苦荞-藜麦复合粉的制备
调整喷雾干燥参数为喷雾压力0.1~0.3 MPa,风机设定20~30,温度110~150 ℃,蠕动泵转速15~30 r/min,对核桃多肽液进行喷雾干燥制备出核桃多肽粉。将核桃多肽粉与苦荞-藜麦糊化液化糖化后的浓浆按原料最佳质量比混匀,进行喷雾干燥,得到核桃多肽-苦荞-藜麦经酶解后各种小分子糖的复合粉(以下简称酶解组),以未经酶解处理的高蛋白核桃粉和经糊化但未液化糖化的苦荞-藜麦复合粉为对照(以下简称未酶解组),进行体外消化和抗氧化功能特性的对比研究。
1.3.7 核桃多肽-苦荞-藜麦复合粉体外消化特性
模拟胃液消化过程:取1 g经喷雾干燥后的复合粉于50 mL离心管中,加入20 mL pH 1.7的KCl-HCl缓冲溶液及800 U胃蛋白酶,37 ℃恒温搅拌消化3 h,从开始模拟胃液消化时分别于1、2、3 h取样灭酶,测定多肽、还原糖、黄酮和多酚含量。
模拟小肠液消化过程:在胃液消化过程基础上,用1 mol/L NaHCO3溶液缓慢调节pH值至6.8,加入40 mL pH 6.8的KH2PO4-NaOH缓冲溶液及800 U胰蛋白酶、12 000 U葡萄糖苷淀粉酶、12 000 U猪胰腺α-淀粉酶,37 ℃恒温搅拌消化4 h。分别于4、5、6、7 h取样灭酶,测定多肽、还原糖、黄酮和多酚含量[23-24]。
根据淀粉成分划分等级可以计算样品不同类型淀粉含量,模拟小肠液消化过程测定还原糖含量时,酶水解20 min和120 min后取出测定葡萄糖含量,快消化淀粉(rapid digestible starch,RDS)、慢消化淀粉(slow digestible starch,SDS)及抗性淀粉(resistant starch,RS)质量分数[25]按公式(5)~(7)计算:

式中:G20为淀粉酶水解20 min后产生的葡萄糖质量/mg;G120为淀粉酶水解120 min后产生的葡萄糖质量/mg;FG为酶水解处理前淀粉中游离葡萄糖质量/mg;TS为样品总淀粉质量/mg。
1.3.8 核桃多肽-苦荞-藜麦复合粉体外抗氧化特性的测定
参考文献[26]的方法对核桃多肽-苦荞-藜麦复合粉进行还原力、DPPH自由基清除率、羟自由基清除率、O2-·清除率以及总抗氧化能力的测定与分析,并通过计算半数清除率(IC50值)比较酶解组和未酶解组抗氧化能力的强弱。
1.4 数据处理
应用Origin 6.0软件进行分析作图,各组实验重复3 次,以 ±s表示,方差分析用Minitab 15数学分析软件进行处理。
2 结果与分析
2.1 核桃多肽-苦荞-藜麦复合粉最佳复配比的确定
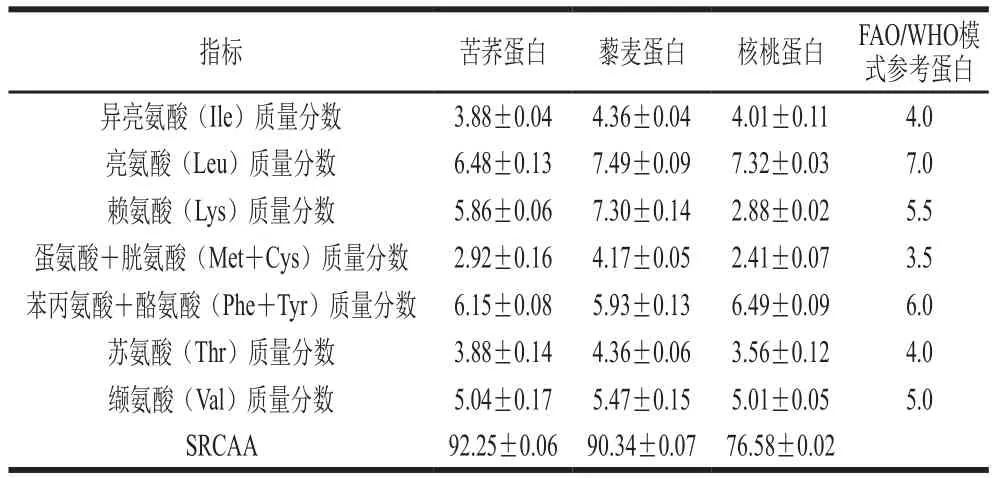
表3 原料蛋白中必需氨基酸质量分数(以蛋白质质量计)及SRCAATable3 Essential amino acid contents and SRCAA of amino acids in raw materials%
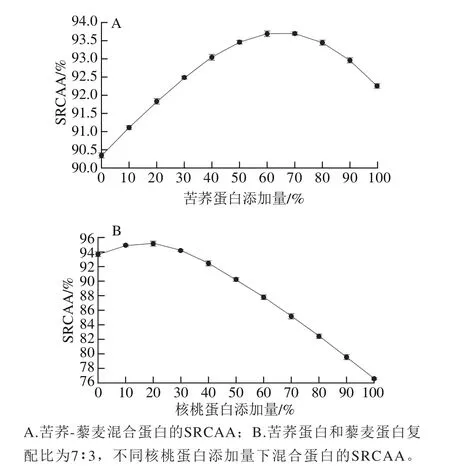
图1 核桃、苦荞和藜麦混合蛋白不同比例的SRCAAFig.1 SRCAA of mixed protein of walnut, buckwheat and quinoa in different proportions
原料蛋白及苦荞-藜麦混合谷物蛋白SRCAA的变化规律如表3、图1A所示,SRCAA随苦荞蛋白添加量增大而先增大后减小,苦荞蛋白添加量为70%,也即苦荞蛋白-藜麦蛋白质量比为7∶3时,SRCAA值最高,为93.69%,因此确定苦荞蛋白和藜麦蛋白的复配比为7∶3,实验中苦荞粉蛋白质量分数为12.61%,藜麦粉蛋白质量分数为14.27%,通过折算,确定苦荞粉和藜麦粉的质量比为13∶5,根据此比例进行糊化液化糖化工艺优化试验。
在确定苦荞蛋白和藜麦蛋白最适复配比的基础上,不同核桃蛋白添加量下SRCAA的变化规律如图1B所示,当核桃蛋白添加量为20%,也即核桃蛋白-苦荞蛋白-藜麦蛋白质量比为2.5∶7∶3时,SRCAA值达到了95.15%,超过了单一原料蛋白和苦荞-藜麦复合蛋白的SRCAA值,表明氨基酸复配更接近参考蛋白模式,实验中核桃多肽粉蛋白质量分数为91.25%,根据苦荞粉和藜麦粉的蛋白含量,通过折算,最终确定核桃多肽粉-苦荞粉-藜麦粉质量比为0.7∶13∶5。
2.2 苦荞-藜麦复配谷物最佳液化条件的确定
2.2.1 液化单因素试验结果

图2 液化单因素试验对还原糖质量浓度的影响Fig.2 Effect of three liquefaction conditions on the concentration of reducing sugar
如图2A所示,当酶添加量为7 U/g时液化效果最好,继续增加酶添加量并不能提高溶液中还原糖质量浓度,故选择最适α-淀粉酶添加量为7 U/g。由图2B可知,在60 ℃以下时液化效果随温度升高而增大,酶活性充分释放,超过60 ℃液化效果开始下降,高温使酶失活,故选择最适液化温度为60 ℃。图2C反映了不同时间液化效果,还原糖质量浓度随时间延长而呈现上升趋势,当超过40 min时,还原糖质量浓度不再有明显变化,故选择最适液化时间为40 min。
2.2.2 液化正交试验结果
如表4所示,影响α-淀粉酶液化条件的主次因素分别为温度>时间>α-淀粉酶添加量,液化后还原糖质量浓度最高的组合为试验5(A2B2C3),即α-淀粉酶添加量7 U/g、温度60 ℃、时间50 min,此时还原糖质量浓度为6.81 mg/mL,结合表5可知,液化温度对于还原糖质量浓度的影响显著(P<0.05)、α-淀粉酶添加量和液化时间两因素对还原糖质量浓度的影响不显著(P>0.05)。
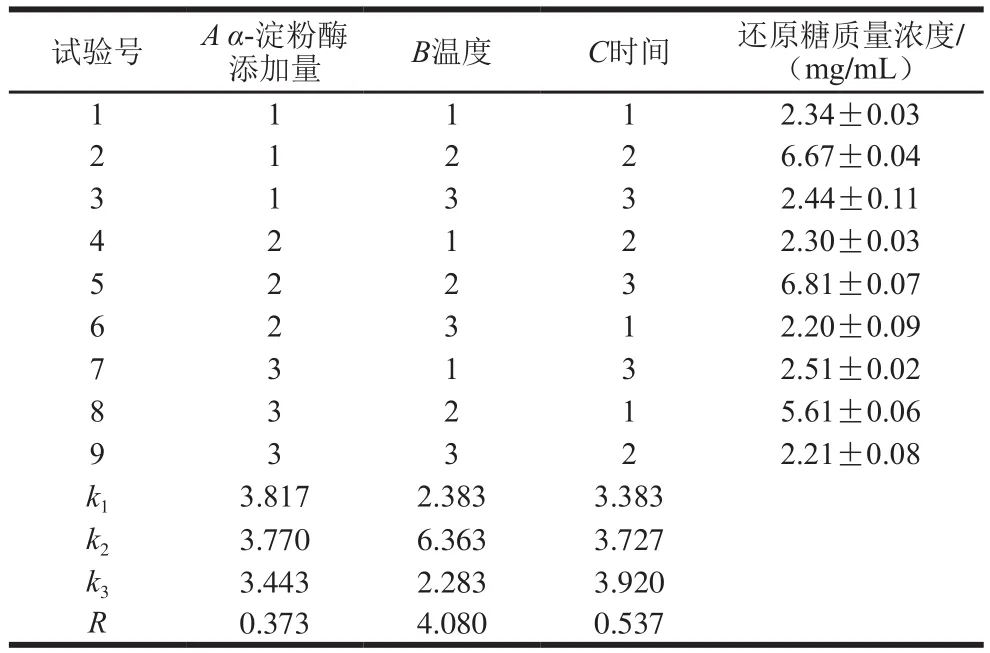
表4 苦荞-藜麦复配谷物液化正交试验设计及结果Table4 Orthogonal array design with experimental results for optimization of liquefaction
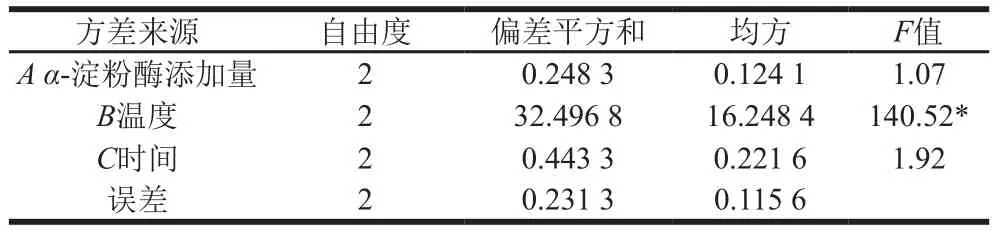
表5 液化正交试验结果方差分析Table5 Analysis of variance for the effect of liquefaction conditions on reducing sugar concentration
2.3 苦荞-藜麦复配谷物最佳糖化条件的确定
2.3.1 糖化单因素试验结果
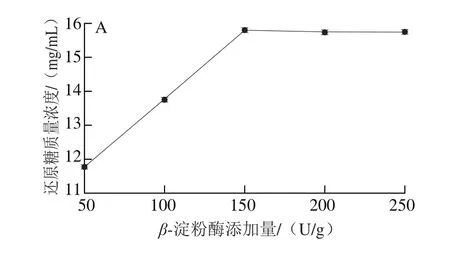
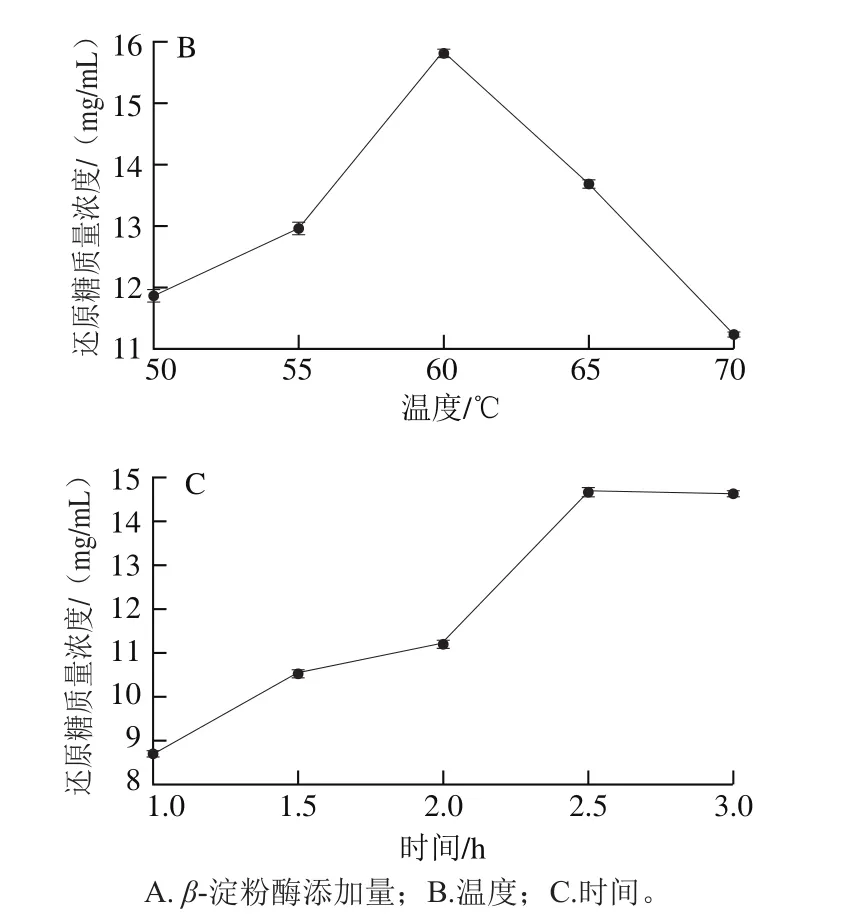
图3 糖化3因素对还原糖质量浓度的影响Fig.3 Effect of three saccharif i cation conditions on th concentration of reducing sugar
图3 A反映了不同β-淀粉酶添加量的糖化效果,当加酶量达到150 U/g时,糖化效果基本达到饱和,加大加酶量曲线趋于平缓,故选择最适β-淀粉酶添加量为150 U/g。由图3B可得,β-淀粉酶的活性随温度升高而逐渐释放,超过60 ℃酶开始失活,影响糖化效果,故选择最适糖化温度为60 ℃。不同时间糖化效果如图3C所示,还原糖质量浓度随时间延长而逐渐增大,当时间达到2.5 h时酶解基本完成,故选择最适糖化时间为2.5 h。
2.3.2 糖化正交试验结果
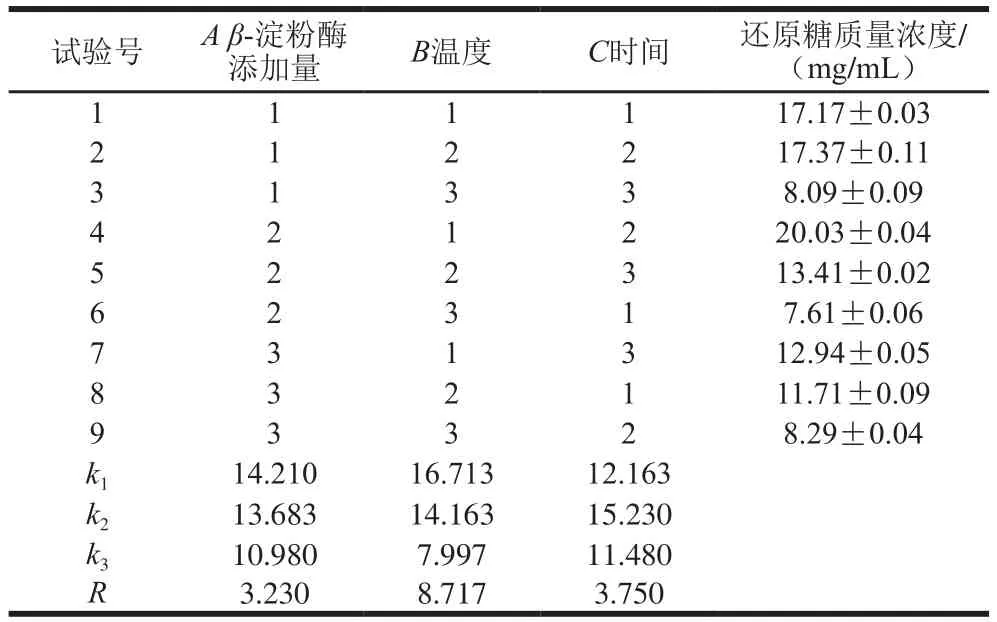
表6 苦荞-藜麦复配谷物糖化正交试验设计及结果Table6 Orthogonal array design with experimental results for optimization of saccharif i cation
如表6所示,影响β-淀粉酶糖化条件的主次因素分别为温度>时间>β-淀粉酶添加量,糖化后还原糖质量浓度最高的组合为试验4(A2B1C2),即β-淀粉酶添加量150 U/g、温度55 ℃、时间2.5 h,此时还原糖质量浓度为20.03 mg/mL,结合表7可知,β-淀粉酶添加量、温度和时间3 个因素均对还原糖质量浓度的影响显著(P<0.05)。
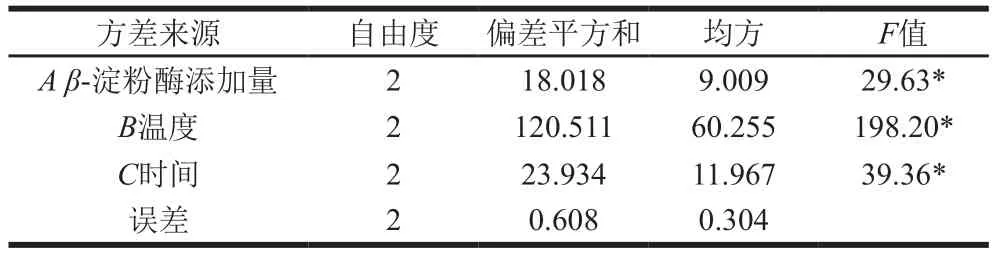
表7 糖化正交试验结果方差分析Table7 Analysis of variance for the effect of saccharif i cation conditions on reducing sugar concentration
2.4 体外消化结果
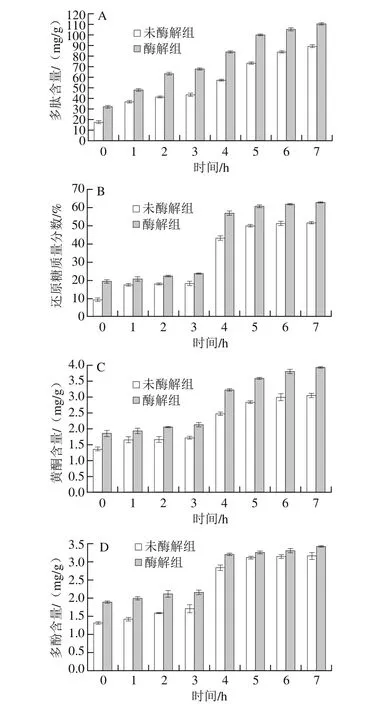
图4 模拟消化过程中多肽(A)、还原糖(B)、黄酮(C)和多酚(D)含量的变化Fig.4 Changes in peptide (A), reducing sugar (B), fl avonoid (C) and polyphenol (D) contents following simulated digestion
图4 A反映了酶解组和未酶解组在体外模拟消化过程中多肽含量的变化趋势,核桃多肽-苦荞-藜麦复合粉(酶解组)在经过胃液和小肠液的消化后,蛋白质充分水解,使得多肽含量随消化时间延长而增加,消化效果比未酶解组好。体外模拟消化过程中还原糖含量的变化如图4B所示,无论是酶解组还是未酶解组,复合粉经过小肠液消化(3~7 h)后的还原糖含量比胃液(0~3 h)高,且在小肠液消化过程中,酶解组RDS质量分数为64.19%,未酶解组RDS质量分数为41.31%,表明酶解组消化更迅速,更易于人体消化吸收,酶解组SDS质量分数为27.12%,RS质量分数仅有8.70%,未酶解组SDS质量分数为20.26%,RS质量分数为38.42%,酶解组中RS含量小于未酶解组,表明酶解组复合粉淀粉较未酶解组经过胃肠消化后水解更彻底,更适合于低血糖人群食用。由图4C和图4D可得,酶解组和未酶解组复合粉经过消化后黄酮和多酚含量均提高,且经过小肠液消化后的含量稍高于胃液,在小肠液消化过程中黄酮含量随时间延长而缓慢增加,多酚含量随时间变化趋于平衡,表明复合粉在体外模拟消化过程中可能会因为酶的消化而释放一些黄酮类和多酚类物质,且黄酮在小肠液中随时间延长而缓慢释放,多酚在消化时释放较快[24]。
2.5 体外抗氧化结果分析
2.5.1 还原力分析
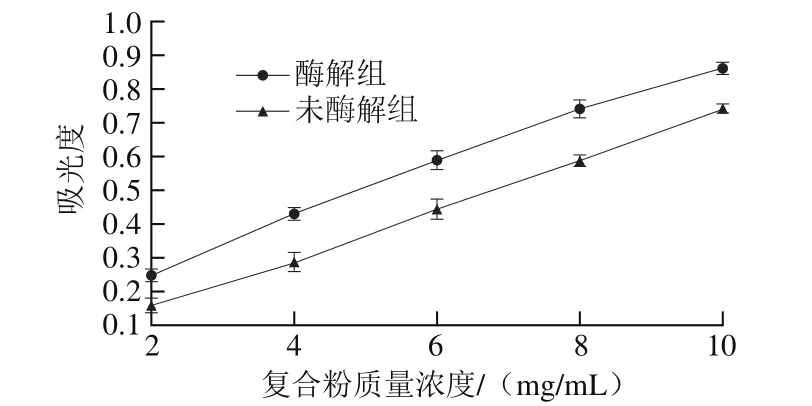
图5 不同质量浓度复合粉的还原力Fig.5 Reducing power of native and hydrolyzed composite powders
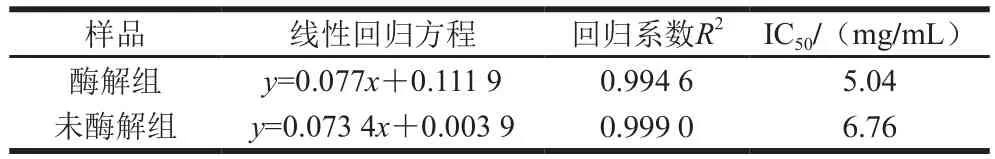
表8 不同质量浓度复合粉还原力分析Table8 Determination of reducing power of native and hydrolyzed composite powders
抗氧化剂通过将电子提供给自由基而获得一个质子从而使自由基变为稳定分子,还原力越强抗氧化性越强[27]。因此可以通过测定物质还原力反映抗氧化活性大小。样品还原性物质可将Fe3+还原成Fe2+,供电子数越多,还原出的Fe2+越多,形成普鲁士蓝化合物,反应体系颜色由黄色变成蓝色,700 nm波长处有特征吸收峰,测定吸光度可得知其还原力强弱[26]。图5反映了吸光度随复合粉质量浓度的变化趋势,在一定质量浓度范围内,酶解组和未酶解组吸光度均随质量浓度增大而增大,以复合粉质量浓度为x,吸光度为y进行线性拟合得到还原力线性回归方程如表8所示,通过IC50值的对比,可以得出酶解组复合粉的还原力高于未酶解组。
2.5.2 DPPH自由基清除能力分析
DPPH自由基是一种在乙醇溶液中呈现深紫色且最大吸收波长为517 nm的有机氮自由基。抗氧化物能和DPPH自由基的电子成对从而使波长吸收慢慢消失,溶液逐渐褪色且褪色程度和所接受电子数呈现一种线性关系,吸光度越低则表明样品对于DPPH自由基的清除能力越强[27]。由图6可得,酶解组和未酶解组复合粉DPPH自由基清除率均随质量浓度增加而增大,且有良好的量效关系,以复合粉质量浓度为x,DPPH自由基清除率为y得出DPPH自由基清除率的线性回归方程如表9所示,通过IC50值的计算,得出酶解组对DPPH自由基的清除能力强于未酶解组。
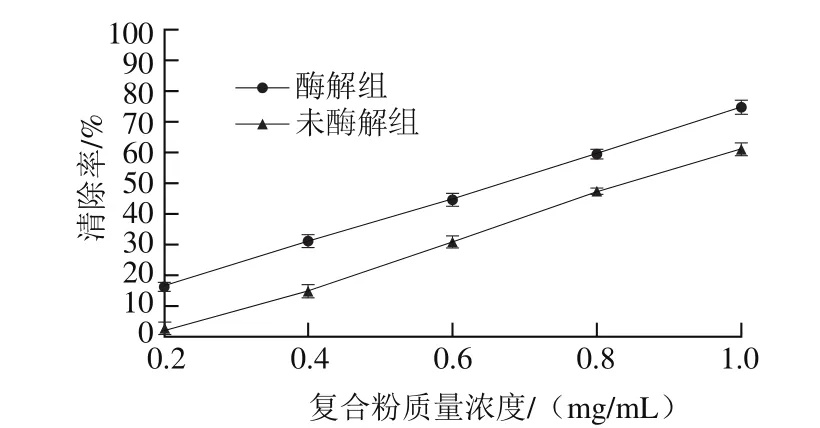
图6 不同复合粉对DPPH自由基的清除率Fig.6 DPPH radical scavenging capacity of native and hydrolyzed composite powders

表9 不同复合粉DPPH自由基的清除能力分析Table9 Determination of DPPH radical scavenging capacity of native and hydrolyzed composite powders
2.5.3 羟自由基清除能力分析
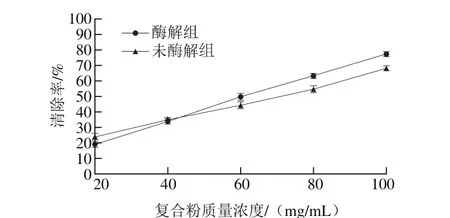
图7 不同复合粉对羟自由基的清除率Fig.7 Hydroxyl radical scavenging capacity of native and hydrolyzed composite powders

表10 不同复合粉羟自由基的清除能力分析Table10 Determination of hydroxyl radical scavenging capacity of native and hydrolyzed composite powders
羟自由基具有极强得电子能力,是生命代谢过程中所产生的毒性最大、进攻性最强的分子,可导致机体组织脂质过氧化,还能够迅速引发各类疾病发生和机体衰老加速。羟自由基由H2O2和FeSO4反应产生,可与水杨酸反应生成有色物质,在510 nm波长处有强吸收峰,在抗氧化物存在情况下能够清除羟自由基,有色物质生成就会减少,故可根据吸光度变化判断抗氧化能力[28]。图7反映了羟自由基清除率随复合粉质量浓度变化的趋势,酶解组和未酶解组复合粉对羟自由基清除率均随质量浓度增加而增大,且清除能力较接近,酶解组随质量浓度变化趋势比未酶解组快,以复合粉质量浓度为x,羟自由基清除率为y进行线性拟合得到线性回归方程如表10所示,通过IC50值的计算得出酶解组羟自由基清除能力较强于未酶解组。
2.5.4·清除能力分析
邻苯三酚在碱性条件能发生自氧化反应,产生一定浓度O2-·和中间物,两者反应得到有色物质,抗氧化物质的存在可以抑制·的产生,因此可通过测定有色物质生成量判断对·的清除能力[29]。由图8可得,酶解组和未酶解组对·清除能力随复合粉质量浓度增加而增大,且质量浓度和清除率之间有明显量效关系,以复合粉质量浓度为x,·清除率为y得到线性回归方程如表11所示,由IC50值的对比可以看出酶解组对·清除能力高于未酶解组,具有良好的抗氧化活性。

图8 不同复合粉对·的清除率Fig.8 · scavenging capacity of different composite powders
表11 不同复合粉·的清除能力分析Table11 Determination of · scavenging capacity of different composite powders

表11 不同复合粉·的清除能力分析Table11 Determination of · scavenging capacity of different composite powders
样品 线性回归方程 回归系数R2 IC50/(mg/mL)酶解组 y=3.485 4x+4.449 0.997 8 13.07未酶解组 y=2.182 3x+16.708 0.998 9 15.26
2.5.5 总抗氧化能力分析
按照试剂盒方法对不同复合粉进行总抗氧化能力的测定,保证酶解组和未酶解组复合粉质量浓度均为20 mg/mL,相对于未酶解组的总抗氧化能力(18.13 U/mL)来说,酶解组总抗氧化能力(27.63 U/mL)提高了9.50 U/mL。未酶解组中核桃、苦荞和藜麦本身就含有黄酮、多酚、低聚糖等活性成分,具备一定的抗氧化功能,酶解组中核桃多肽相对于核桃蛋白来说属于小分子活性成分,苦荞和藜麦淀粉经酶解后水解成各种小分子糖,因而酶解组较未酶解组可能会暴露更多的抗氧化基团[28-30],从而提高抗氧化能力。
3 结 论
根据必需氨基酸参考模式,通过SRCAA计算方法评价了核桃多肽、苦荞和藜麦的营养价值,确定了核桃多肽-苦荞-藜麦粉最佳复配比为0.7∶13∶5,此时SRCAA值为95.15%。在此基础上以还原糖质量浓度为指标,通过单因素和正交试验设计确定了最佳液化条件为α-淀粉酶添加量7 U/g、温度60 ℃、时间50 min,最佳糖化条件为β-淀粉酶添加量150 U/g、温度55 ℃、时间2.5 h,此时还原糖质量浓度为20.03 mg/mL。
体外模拟消化过程中酶解组蛋白质充分水解,使得多肽含量随消化时间延长而提高;无论是酶解组还是未酶解组经过小肠液消化后还原糖含量均高于胃液,而且酶解组RDS质量分数为64.19%,未酶解组RDS为41.31%,表明酶解组消化更迅速,更易于人体吸收,酶解组SDS质量分数为27.12%,RS质量分数为8.70%,未酶解组SDS质量分数为20.26%,RS质量分数为38.42%,酶解组中RS含量小于未酶解组,说明淀粉经过胃肠消化后水解更彻底;黄酮和多酚经过体外模拟消化后含量均增加。核桃多肽-苦荞-藜麦复合粉经实验证明具备一定的消化特性,富含小分子肽、糖等营养物质,更易于人体消化吸收。
体外抗氧化实验结果表明,在一定质量浓度范围内酶解组和未酶解组均表现出一定的还原能力、DPPH自由基清除能力、羟自由基清除能力、·清除能力以及总抗氧化能力,通过IC50值的比较可以发现,相对于未酶解组的还原力(IC50=6.76 mg/mL)、DPPH自由基清除能力(IC50=0.85 mg/mL)、羟自由基清除能力(IC50=69.31 mg/mL)、·清除能力(IC50=15.26 mg/mL)和总抗氧化能力(18.13 U/mL)来看,酶解组的还原力(IC50=5.04 mg/mL)、DPPH自由基清除能力(IC50=0.67 mg/mL)、羟自由基清除能力(I C50=6 2.3 2 m g/m L)、·清除能力(I C50=1 3.0 7 m g/m L)和总抗氧化能力(27.63 U/mL)均有了一定的提高。本实验研制出的核桃多肽-苦荞-藜麦复合粉营养搭配合理,易于消化吸收且具有一定抗氧化活性,为今后相关产品开发提供了一定的理论指导和参考价值。
[1] SHIBU M P, DONNA F B, BARBARA S H. Walnut diet reduces accumulation of polyubiquitinated proteins and inflammation in the brain of aged rats[J]. Journal of Nutritional Biochemistry, 2013, 24:912-919. DOI:10.1016/j.jnutbio.2012.06.009.
[2] SEYED M T G, SEYED M M, MANUCHEHR H, et al. Evaluation of physicochemical properties and antioxidant activities of Persian walnut oil obtained by several extraction methods[J]. Industrial Crops and Products, 2013, 45: 133-140. DOI:10.1016/j.indcrop.2012.11.040.
[3] WANG Z H, MA X L, LI J, et al. Peptides from sesame cake extend healthspan of Caenorhabditis elegans via upregulation of skn-1 and inhibition of intracellular ROS levels[J]. Experimental Gerontology,2016, 82: 139-149. DOI:10.1016/j.exger. 2016.07.001.
[4] 王帅, 戴涟漪, 库雪晶, 等. 核桃营养组成与保健功能研究进展[J]. 中国油脂, 2016, 35(6): 30-33. DOI:10.11882/j.issn.0254-5071.2016.06.007.
[5] 陈慧, 李建婷, 秦丹. 苦荞的保健功效及开发利用研究进展[J]. 农产品加工, 2016(8): 63-66. DOI:10.16693/j.cnki.1671-9646(X).2016.08.019.
[6] VERENA N, JUAN D, RUTH C U. Assessment of the nutritional composition of quinoa (Chenopodium quinoa Willd.)[J]. Food Chemistry, 2016, 193: 47-54. DOI:10.1016/j.foodchem.2015.02.111.
[7] ABUGOCH J L E. Quinoa (Chenopodium quinoa Willd.):composition, chemistry, nutritional, and functional properties[J].Advances in Food and Nutrition Research, 2009, 58: 1-31.DOI:10.1016/S1043-4526(09)58001-1.
[8] ALVAREZ-JUBETE L, WUNGAARD H, ARENDT E K, et a1. Polyphenol composition and in vitro antioxidant activity of amaranth, quinoa, buckwheat and wheat as affected by sprouting and backing[J]. Food Chemistry, 2010, 119(2): 770-778. DOI:10.1016/j.foodchem.2009.07.032.
[9] 颜孙安, 林香信, 钱爱萍, 等. 化学分析法的理想参考蛋白模式及其化学生物价研究[J]. 中国农学通报, 2010, 26(23): 101-107.
[10] 张金振, 吴黎明, 赵静, 等. 13 种植物源蜂花粉蛋白质的营养学评价[J]. 食品科学, 2014, 35(1): 254-257. DOI:10.7506/spkx1002-6630-201401050.
[11] 胡秋辉, 陈曦, 方勇, 等. 富硒米糠蛋白的优化制备及其蛋白营养复配研究[J]. 中国农业科学, 2014, 47(2): 374-382. DOI:10.3864/j.issn.0578-1752.2014.02.017.
[12] 王芳, 乔璐, 张庆庆, 等. 桑叶蛋白氨基酸组成分析及营养价值评价[J].食品科学, 2015, 36(1): 225-228. DOI:10.7506/spkx1002-6630-201501043.
[13] 徐晓霞, 陈树俊, 李乐, 等. 苦荞、燕麦和杏鲍菇复合粉的液化糖化工艺研究[J]. 食品工业科技, 2016, 34(14): 233-237. DOI:10.13386/j.issn1002-0306.2016.14.039.
[14] 刘晓娟, 陈树俊, 庞震鹏, 等. 强化杏鲍菇多糖苦荞燕麦乳的研制[J]. 山西农业科学, 2016, 44(3): 402-409. DOI:10.3969/j.issn.1002-2481.2016.03.33.
[15] 陈树俊, 庞震鹏, 刘晓娟, 等. 小米-藜麦饮品液化糖化及稳定剂配方研究[J]. 食品工业科技, 2016, 37(15): 249-255. DOI:10.13386/j.issn1002-0306.2016.15.040.
[16] 陈树俊, 李乐, 石玥, 等. 响应面法优化酶解制备核桃多肽工艺[J]. 食品工业科技, 2017, 38(16): 142-149. DOI:10.13386/j.issn1002-0306.2017.16.027.
[17] 王春娜, 龚院生. 方便面糊化度测定方法的研究[J]. 郑州粮食学院学报, 1999, 20(2): 31-34. DOI:10.16433/j.cnki.issn1673-2383.1999.02.008.
[18] 许安邦, 林维宣. 食品分析[M]. 北京: 中国轻工业出版社, 1994:173-174.
[19] 康俊杰, 陈树俊, 田津瑞, 等. 优质复配蛋白酶解工艺研究[J]. 山西农业科学, 2015, 43(7): 892-896. DOI:10.3969/j.issn.1002-2481.2015.07.33.
[20] 董晶, 张焱, 曹赵茹, 等. 藜麦总黄酮的超声波法提取及抗氧化活性[J]. 江苏农业科学, 2015, 43(4): 267-269. DOI:10.15889/j.issn.1002-1302.2015.04.097.
[21] HIROSE Y, FUJITA T, ISHII T, et al. Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J]. Food Chemistry, 2010, 119(4): 1300-1306. DOI:10.1016/j.foodchem.2009.09.008.
[22] 朱圣陶, 吴坤. 蛋白质营养价值评价-氨基酸比值系数法[J]. 营养学报, 1988, 10(2): 187-190. DOI:10.13325/j.cnki.acta.nutr.sin.1988.02.015.
[23] 尚晓娅, 高群玉, 王捷, 等. 抗性淀粉体外消化模拟的研究[J].食品工业科技, 2007, 28(5): 218-220. DOI:10.13386/j.issn1002-0306.2007.05.063.
[24] 李亚, 陈卫, 庄晶晶, 等. 体外消化对蓝莓活性成分及防护氧化损伤的影响[J]. 中国食品学报, 2015, 15(8): 10-16. DOI:10.16429/j.1009-7848.2015.08.002.
[25] ENGLYST H, KINGMAN S, CUMMINGS J. Classification and measurement of nutritionally imprtant starch fractions[J]. European Journal of Clinical Nutrition, 1992, 46(S2): S33-S50.
[26] 李乐, 陈树俊, 康俊杰, 等. 沙棘油复合蛋白多肽液抗氧化性研究[J]. 山西农业科学, 2016, 44(4): 474-479; 486. DOI:10.3969/j.issn.1002-2481.2016.04.13.
[27] SAKANAKA S, TACHIBANA Y, NORIYUKI I, et al. Antioxidant properties of casein calcium peptides and their effects on lipid oxidation in beef homogenates[J]. Jounal of Agricultural and Food Chemistry, 2005, 53(2): 464-468.
[28] LI L, WANG J S, ZHAO M M, et al. Artif i cial neural network for production of antioxidant peptides derived from bighead carp muscles with alcalase[J]. Food Technology and Biotechnology, 2006, 44(3): 441-448.
[29] RAGAEE S, ABDEL A E S M, NOAMAN M. Antioxidant activity and nutrient composition of selected cereals for food use[J]. Food Chemistry, 2006, 98(1): 32-38. DOI:10.1016/j.foodchem.2005.04.039.

