基于线扫描拉曼高光谱系统的奶粉中硫氰酸钠无损检测
刘 宸,杨桂燕,王庆艳,黄文倩,王超鹏,王晓彬,陈立平,*
(1.西北农林科技大学机械与电子工程学院,陕西 杨凌 712100;2.国家农业智能装备工程技术研究中心,北京 100097;3.农业部农业信息技术重点实验室,北京 100097;4.农业智能装备技术北京市重点实验室,北京 100097)
硫氰酸钠(NaSCN)是一种白色斜方结晶或粉末,属于化工原料,不法商贩将其加入液态奶或奶粉中起到保鲜抑菌的作用。由于食入硫氰酸钠会在人体内释放有毒的氰根离子,硫氰酸钠目前已被国家明确定为乳制品中的违法添加物质[1]。目前,乳制品中的硫氰酸钠检测大多采用色谱法或分光光度法,这两种方法检测准确度高,但耗时较长,需要复杂的样本前处理过程和专业人员操作[2-3]。由于硫氰酸钠中C≡N的伸缩运动可以引起在2 068.48 cm-1位移处的拉曼特征峰,拉曼光谱技术也可以用于检测硫氰酸钠含量,但检测过程仍需标准溶液配制、超声波萃取、净化奶粉基质干扰等多个步骤。在样本前处理过程中,这几种方法都需将粉末状样本溶解在相应液体中方能进行下一步操作,这样会对奶粉样本有一定的破坏[4-5]。另一方面,这几种方法对于大量样本只能采取局部抽样的检测方式。奶粉样本与液体奶样本不同,其硫氰酸钠颗粒的分布可能并不均匀,因此局部取样的检测结果并不十分准确。高光谱图像不仅包括目标对象完整的图像信息,每个像素点内还包含了一条光谱数据,该技术能够实现对目标对象某一成分的空间分布展示[6-9]。因此,应用拉曼光谱技术结合高光谱成像技术有望实现奶粉颗粒样本的大面积检测[10-13]。目前,在国外,已有研究结合拉曼高光谱技术对奶粉中几种含氮添加剂进行检测[14-17]。在国内,应用表面增强拉曼技术实现了奶粉中硫氰酸根的检测,而拉曼光谱与高光谱成像技术的联合应用尚处于起步阶段[18-21]。因此,本研究搭建了一套线扫描拉曼高光谱成像系统,重点探索拉曼高光谱图像与硫氰酸钠颗粒之间的关系,用以实现大面积奶粉混合样本的快速无损检测。
1 材料与方法
1.1 材料与试剂
伊利牌高蛋白脱脂高钙奶粉(以下简称脱脂奶粉)北京超市发超市。
硫氰酸钠(分析纯,99%) 上海晶纯生化科技股份有限公司。
1.2 线扫描拉曼高光谱成像系统
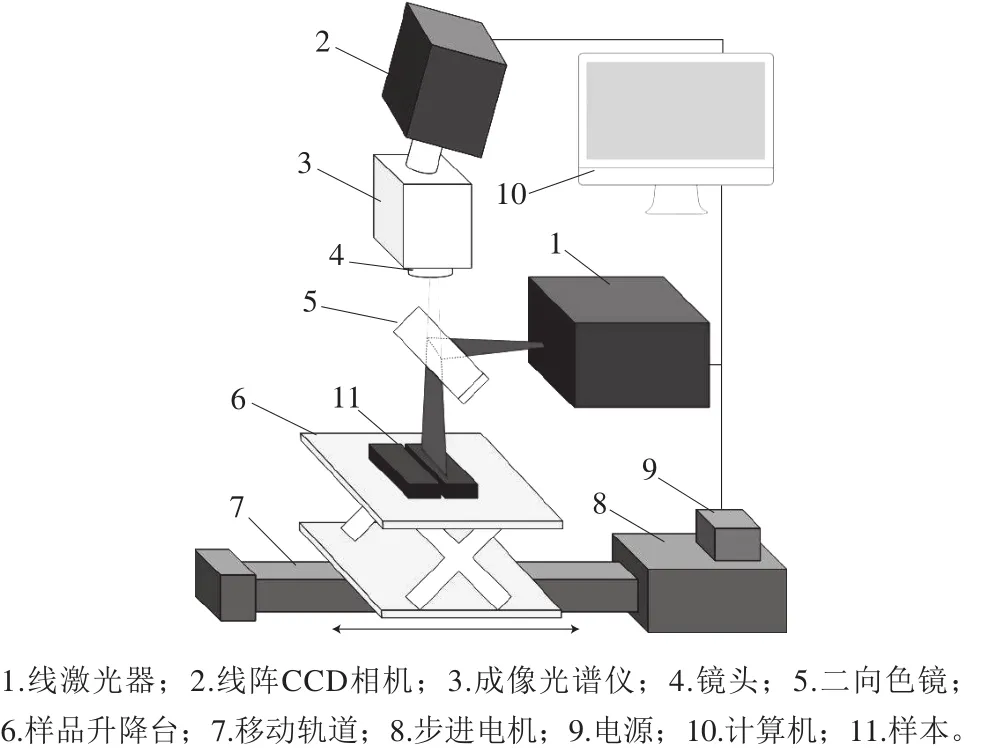
图1 拉曼高光谱成像系统原理图Fig.1 Schematic diagram of the Raman hyperspectral imaging system
如图1所示,线扫描拉曼高光谱成像系统主要由拉曼成像光谱仪(ImSpector R10E,Specim,Finland)、线阵CCD相机(iKon-M 934,AndorTechnology plc.,N. Ireland)、一字线激光器(Innovative Photonic Solutions,USA)、成像镜头、二向色镜及滤光片、样品升降台、移动轨道、步进电机、电源以及计算机组成。其中,一字线激光器的波长是785 nm,在距离镜头20 cm位置时激光线宽1 mm,线长为14 cm;对应的拉曼成像光谱仪的采集范围是-261~2 539 cm-1,光谱分辨率为10 cm-1;线阵CCD相机的分辨率是512×1 024,采集图像的分辨率是0.25 mm/pix.。采集高光谱图像时,线激光经二向色镜反射到样本表面,线阵CCD相机和光谱仪采集对应线宽范围内的样本数据,随着升降台沿移动导轨水平移动最终系统完成整个样本的扫描。本实验中的参数为激光功率2 W,曝光时间2 s,此时完成一种质量分数样本的采集时间约为20 min。
1.3 方法
1.3.1 样本制备
样本制备过程分穿透深度检测和硫氰酸钠含量检测两部分。穿透深度检测中样本制备如图2a所示,图中待测样本上半部为1~5 个铝环厚度的奶粉层,高度从0.8~4.0 mm可调,铝环尺寸为外径40 mm,内径25 mm;下半部为装满硫氰酸钠的培养皿,高度固定为5.0 mm,培养皿直径35 mm。穿透深度检测时首先放置5 个铝环厚度的奶粉层进行高光谱采集,然后依次去除1 个铝环厚度的奶粉层重复进行采集,最终直至铝环全部移除完成实验。根据穿透深度检测结果,实验定制了一种铝合金容器用于硫氰酸钠含量检测,如图2b所示。该容器的体积为100 mm×55 mm×10 mm,内有凹陷部分盛装样本,对应尺寸为90 mm×45 mm×2 mm。实验共制备不同硫氰酸钠质量分数的奶粉混合样本共10 份,每份样本质量10 g,质量分数范围为0.01%~2.00%。制备样本时先用研钵分别将奶粉和硫氰酸钠颗粒研磨,然后在电子天平上称量取样,随即倒入50 mL离心管中,将离心管放置于旋涡振荡器上运行20 min至二者充分混合完成样本制备。高光谱图像采集时,同种质量分数的奶粉混合样本(共10 g)分两个铝合金容器盛装,检测部分均超过样本总量的80%,将样本表面刮平后,放置于样品台上依次进行采集。此外,脱脂奶粉和硫氰酸钠纯物质样本也经相同方法制备并完成采集。1.3.2 高光谱图像预处理

图2 样本制备示意图Fig.2 Schematic diagram of sample preparation
为减小高光谱数据的运算量,研究选取感兴趣区域并从1 024 个波段中提取513 个有效波段(402.62~2 201.37 cm-1)进行下一步预处理。感兴趣区域和有效波段选取过程在软件ENVI 5.2(Exelis Visual Informa tion Solutions, Boulder, Co., USA)中完成。针对感兴趣区域内每一个像素点的拉曼光谱,研究首先应用高斯窗平滑方法消除光谱中的噪声信号,然后采用自适应迭代惩罚最小二乘(adaptive iteratively reweighted penalized least squares,airPLS)基线校正方法消除荧光干扰[22]。对于预处理后的高光谱数据,研究挑选2 068.48 cm-1位移处的单波段图像进行二值化阈值处理,根据二值图像结果直观地展示了硫氰酸钠颗粒的含量和空间分布。拉曼光谱校正和高光谱图像分析过程在软件MATLAB(R2014a,Math Works, Natick, MA, USA)中完成。
2 结果与分析
2.1 硫氰酸钠的拉曼光谱分析
脱脂奶粉和硫氰酸钠纯物质的原始拉曼光谱如图3所示,光谱取自感兴趣区域内各像素点的平均值。硫氰酸钠在474.88、752.73、953.00 cm-1和2 068.48 cm-1位移处各有一个拉曼特征峰。其中在474.88 cm-1和953.00 cm-1处的拉曼特征峰较弱,主要由硫氰酸根(SCN-)的弯曲振动产生;在752.73 cm-1处的特征峰较强,由C—S的伸缩振动引起;2 068.48 cm-1位移处的是最强峰,形成原因是C≡N的伸缩振动[23-26]。另一方面,脱脂奶粉在光谱中没有出现明显的拉曼特征峰。因此,实验选取2 068.48 cm-1处的拉曼特征峰作为样本是否含有硫氰酸钠颗粒的判断依据。
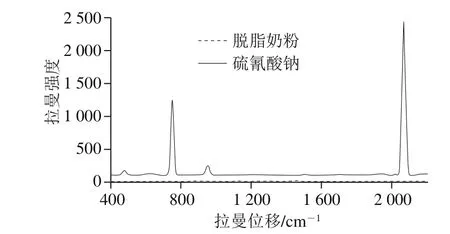
图3 脱脂奶粉和硫氰酸钠纯物质的拉曼光谱Fig.3 Raman spectra of skim milk powder and pure sodium thiocyanate
2.2 硫氰酸钠拉曼信号在奶粉层的穿透深度分析
在穿透深度检测实验中,研究选取样本中心区域80 pix.×80 pix.范围共6 400个像素点作为感兴趣区域。从图4可以看出,奶粉层厚度为0 mm时硫氰酸钠拉曼信号最强,随着奶粉层厚度增加,硫氰酸钠的几个特征峰强度值逐渐减小。当奶粉层厚度达到2.4 mm时,474.88 cm-1和953.00 cm-1处的弱峰已无法检测到;当奶粉层厚度增加到4.0 mm时,硫氰酸钠的几个特征峰均已消失。若以2 068.48 cm-1处最强峰为判断依据,本实验参数下硫氰酸钠纯物质产生的拉曼信号能够穿透3.2 mm厚的脱脂奶粉层。但是在硫氰酸钠含量检测时,样本中的硫氰酸钠颗粒较少且平均分布在奶粉层中,颗粒产生的拉曼信号要弱于穿透深度检测时所获的拉曼信号。因此,为了保证最底部硫氰酸钠颗粒产生的拉曼信号能被系统采集到,同时尽量增加单次检测样本的体积,研究定制铝合金容器使检测样本的厚度维持在2 mm[27-28]。
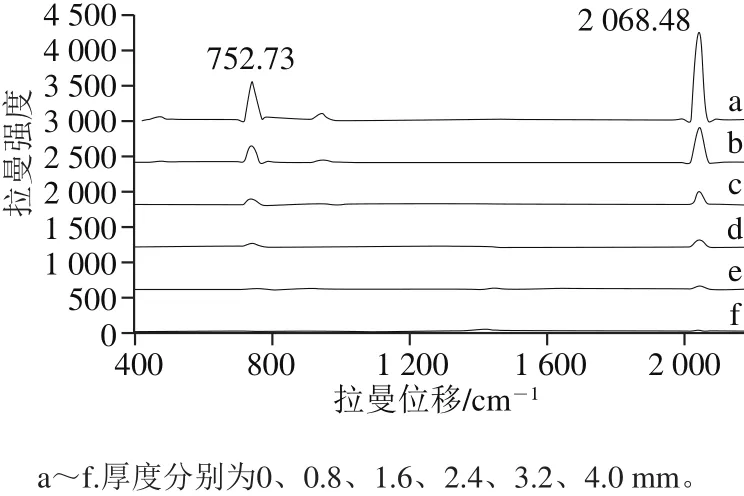
图4 不同厚度奶粉层样本的平均拉曼光谱图Fig.4 Mean Raman spectra of varied thicknesses of milk powder placed on sodium thiocyanate
2.3 硫氰酸钠的拉曼高光谱图像分析
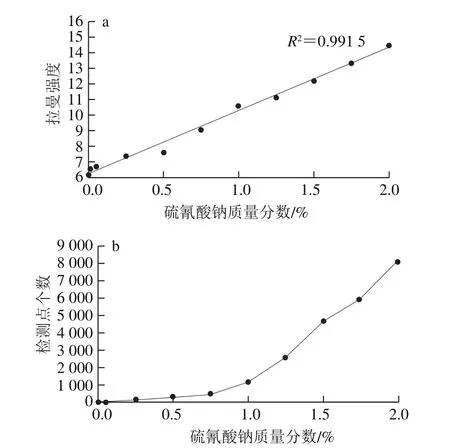
图5 单波段图像中所有像素点的拉曼强度平均值(a)、二值图像中所有检测点之和(b)与硫氰酸钠质量分数的关系Fig.5 Relationships between sodium thiocyanate concentration in sample and average Raman intensity in single-band corrected image and between sodium thiocyanate concentration in sample and total number of sodium thiocyanate pixels detected in binary image
在经过预处理后,研究从每种质量分数样本中提取4 个感兴趣区域作为代表,每个感兴趣区域的面积为40 mm×40 mm,包含160 pix.×160 pix.共25 600 个像素点。随后单独提取感兴趣区域在2 068.48 cm-1位移处的单波段图像进行分析,计算出了同一质量分数4 个感兴趣区域内所有像素点的拉曼强度平均值,它们与硫氰酸钠含量的关系如图5a所示。从图5a可以看出,在单波段图像中,感兴趣区域内所有像素点的拉曼强度平均值随着硫氰酸钠含量的增加呈线性增长趋势,其决定系数R2达到0.991 5。结果表明在实验参数相同时,拉曼信号的强度与样本分子的质量分数呈正比,因此可以根据采集的信号强度对硫氰酸钠含量进行定量预测。进一步,研究对2 068.48 cm-1位移处单波段图像进行二值化分析。首先选取脱脂奶粉样本在感兴趣区域中的拉曼强度最大值作为二值化的阈值。在10 种质量分数的单波段图像中,当某一像素点的拉曼强度值大于阈值时,说明该像素点含有硫氰酸钠颗粒,称之为检测点,显示为蓝色;反之,当像素点的拉曼强度值小于阈值时,说明该像素点只含有脱脂奶粉颗粒,称之为背景点,显示为灰色。本实验中所有样本均采用同一阈值进行二值化处理,处理后的结果如图6所示。

图6 10 种硫氰酸钠质量分数样本的二值化图像Fig.6 Binary images of mixed samples containing sodium thiocyanate at ten different concentrations
由图6可知,随着硫氰酸钠质量分数变大,检测点的个数也明显增加。在质量分数为0.01%时4 个感兴趣区域内均存在检测点,其个数分别为3、3、2、2,这说明在本实验参数下,硫氰酸钠颗粒在脱脂奶粉中的检测限可达0.01%。进一步,研究统计了同种质量分数条件下4 张二值图像中硫氰酸钠检测点的总数,它们与硫氰酸钠含量的关系如图5b所示。图5b显示,感兴趣区域内所有硫氰酸钠检测点之和随着硫氰酸钠含量的增加呈现出指数增长趋势。这一结果表明本实验中采集的高光谱图像信息包含了样本的表层和多个亚表层。在样本均匀的情况下,当硫氰酸钠含量较低时,系统只能采集到表层硫氰酸钠颗粒产生的拉曼信号,亚表层颗粒的拉曼信号强度太弱而无法采集。随着硫氰酸钠含量增加,表层和亚表层中的硫氰酸钠颗粒逐渐变多,当亚表层的颗粒产生的拉曼信号强度超过了阈值时,颗粒所在像素点会被识别为检测点,这导致多层样本二值图像中的检测点个数会多于同一含量单层样本的检测点个数(图7)。因此,随着硫氰酸钠含量线性增加,二值图像中硫氰酸钠检测点之和会呈指数增长趋势。

图7 多层样本的二值图像示意图Fig.7 Binary images of surface layer and sub-surface layer in sample
3 结 论
本研究搭建了一套线扫描拉曼高光谱检测系统,针对大面积奶粉硫氰酸钠混合样本进行了快速无损检测研究。研究首先应用高斯窗平滑和airPLS方法消除了拉曼光谱中出现的噪声信号和荧光干扰;接下来提取感兴趣区域内2 068.48 cm-1拉曼位移处的单波段图像,通过二值化方法成功对像素点是否含有硫氰酸钠颗粒进行判别。实验结果显示,在2 068.48 cm-1单波段图像中,感兴趣区域内所有像素点的拉曼强度平均值随着硫氰酸钠含量的增加呈线性增长,其决定系数R2达到了0.991 5。在二值图像结果中,感兴趣区域内所有硫氰酸钠检测点之和随着硫氰酸钠含量的增加呈指数增长趋势。在本实验方法中,单次检测奶粉样本的总面积达到80 mm×80 mm,检测时不接触、不破坏样本,混合样本中硫氰酸钠含量的检测限可达0.01%。本研究探索的硫氰酸钠添加方式是固体颗粒直接混合,研究所用系统和方法可以为奶粉中硫氰酸钠颗粒的大面积快速检测提供理论基础和技术参考,进一步若与多光谱技术结合可大大缩短检测所耗时间[29-30]。与传统的检测方法相比,拉曼高光谱成像系统能够快速、无损且大面积地检测出奶粉中的硫氰酸钠,并且可以直观地展示硫氰酸钠颗粒的具体分布,在实际检测应用中该方法具有巨大潜力。
[1] 张福娟, 孙成行, 王延平, 等. 乳及乳制品中硫氰酸钠检测的研究与进展[J]. 中国食品添加剂, 2013(5): 173-177. DOI:10.3969/j.issn.1006-2513.2013.05.021.
[2] 张丽宏, 黄晓林, 鄂来明, 等. 分光光度法测定乳及乳粉中的硫氰酸钠[J]. 中国乳品工业, 2016, 44(7): 41-43. DOI:10.3969/j.issn.1001-2230.2016.07.010.
[3] 邵丽, 王晓, 滕振勇, 等. 高效液相色谱法测定牛奶中硫氰酸钠含量[J].食品安全质量检测学报, 2016, 7(4): 1444-1447.
[4] 吴剑平, 顾欣, 李丹妮, 等. 高效液相色谱法检测牛奶中硫氰酸钠质量浓度[J]. 中国乳品工业, 2011, 39(7): 44-46. DOI:10.3969/j.issn.1001-2230.2011.07.012.
[5] 冯蕾, 鄢爱平, 郭岚, 等. 高效阴离子交换色谱-积分脉冲安培检测法测定原料乳中的硫氰酸钠[J]. 分析科学学报, 2014, 30(3): 361-364.DOI:10.13526/j.issn.1006-6144.2014.03.014.
[6] VAJNA B, PATYI G, NAGY Z, et al. Comparison of chemometric methods in the analysis of pharmaceuticals with hyperspectral Raman imaging[J]. Journal of Raman Spectroscopy, 2011, 42(11): 1977-1986.DOI:10.1002/jrs.2943.
[7] PIQUERAS S, DUPONCHEL L, TAULER R, et al. Monitoring polymorphic transformations by using in situ Raman hyperspectral imaging and image multiset analysis[J]. Analytica Chimica Acta,2014, 819: 15-25. DOI:10.1016/j.aca.2014.02.027.
[8] MA J, SUN D W, PU H. Spectral absorption index in hyperspectral image analysis for predicting moisture contents in pork Longissimus dorsi muscles[J]. Food Chemistry, 2016, 197(Pt A): 848. DOI:10.1016/j.foodchem.2015.11.023.
[9] MASIA F, KARUNA A, BORRI P, et al. Hyperspectral image analysis for CARS, SRS, and Raman data[J]. Journal of Raman Spectroscopy,2015, 46(8): 727-734. DOI:10.1002/jrs.4729.
[10] YANG D T, YING Y B. Applications of raman spectroscopy in agricultural products and food analysis: a review[J]. Applied Spectroscopy Reviews, 2011, 46(7): 539-560. DOI:10.1080/05704928.2011.593216.
[11] 刘燕德, 靳昙昙. 拉曼光谱技术在农产品质量安全检测中的应用[J]. 光谱学与光谱分析, 2015(9): 2567-2572. DOI:10.3964/j.is sn.1000-0593(2015)09-2567-06.
[12] 张保华, 李江波, 樊书祥, 等. 高光谱成像技术在果蔬品质与安全无损检测中的原理及应用[J]. 光谱学与光谱分析, 2014(10): 2743-2751. DOI:10.3964/j.issn.1000-0593(2014)10-2743-09.
[13] 刘宸, 黄文倩, 王庆艳, 等. 拉曼光谱在食品无损检测中的应用[J].食品安全质量检测学报, 2015(8): 2981-2987.
[14] QIN J, CHAO K, KIM M S. Simultaneous detection of multiple adulterants in dry milk using macro-scale Raman chemical imaging[J]. Food Chemistry, 2013, 138(2/3): 998-1007. DOI:10.1016/j.foodchem.2012.10.115.
[15] QIN J, CHAO K, KIM M S, et al. Line-scan macro-scale Raman chemical imaging for authentication of powdered foods and ingredients[J]. Food and Bioprocess Technology, 2016, 9(1): 1-11.DOI:10.1007/s11947-015-1605-x.
[16] DHAKAL S, CHAO K, QIN J, et al. Raman spectral imaging for quantitative contaminant evaluation in skim milk powder[J]. Journal of Food Measurement and Characterization, 2016, 10(2): 374-386.DOI:10.1007/s11694-016-9316-1.
[17] QIN J, CHAO K, KIM M S. A line-scan hyperspectral system for high-throughput Raman chemical imaging[J]. Applied Spectroscopy,2014, 68(6): 692-695. DOI:10.1366/13-07411.
[18] 陈小曼, 张凯歌, 胡玉玲, 等. 表面增强拉曼光谱法测定市售奶粉中的硫氰酸根[J]. 分析科学学报, 2016, 32(3): 325-329. DOI:10.13526/j.issn.1006-6144.2016.03.006.
[19] 王晓彬, 黄文倩, 王庆艳, 等. 苯甲酸添加剂的拉曼高光谱分析[J].食品科学, 2017, 38(4): 290-295. DOI:10.7506/spkx1002-6630-201704047.
[20] 李江波, 饶秀勤, 应义斌. 农产品外部品质无损检测中高光谱成像技术的应用研究进展[J]. 光谱学与光谱分析, 2011, 31(8): 2021-2026. DOI:10.3964/j/issn/1000-0593(2011)08-2021-06.
[21] 傅霞萍, 应义斌. 基于NIR和Raman光谱的果蔬质量检测研究进展与展望[J]. 农业机械学报, 2013, 44(8): 148-164. DOI:10.6041/j.issn.1000-1298.2013.08.026.
[22] ZHANG Z M, CHEN S, LIANG Y Z. Baseline correction using adaptive iteratively reweighted penalized least squares[J]. Analyst,2010, 135(5): 1138-1146. DOI:10.1039/b922045c.
[23] 周宇. 基于表面增强拉曼光谱技术对三聚氰胺和硫氰酸钠的检测研究[D]. 哈尔滨: 哈尔滨工业大学, 2012.
[24] 刘伟良, 夏海瑞, 王新强, 等. 硫氰酸镉锌晶体的振动光谱和结构[J]. 光散射学报, 2004, 16(1): 21-26. DOI:10.3969/j.issn.1004-5929.2004.01.005.
[25] 王丹慧, 高娃, 李梅. 原料乳中硫氰酸钠掺假定性检测方法[J].中国乳品工业, 2 0 0 8, 3 6(7): 5 7-5 8. D O I:1 0.3 9 6 9/j.issn.1001-2230.2008.07.015.
[26] 杨青青. 表面增强拉曼光谱法在硫氰酸盐、三聚氰胺和亚硝酸盐测定中的应用[D]. 长春: 吉林大学, 2016.
[27] HUANG M, KIM M S, CHAO K, et al. Penetration depth measurement of near-infrared hyperspectral imaging light for milk powder[J]. Sensors, 2016, 16(4): 441-451. DOI:10.3390/s16040441.
[28] 刘宸, 王庆艳, 黄文倩, 等. 拉曼高光谱成像系统中光在奶粉层的穿透深度研究[J]. 光谱学与光谱分析, 2017, 37(10): 3103-3107.DOI:10.3964/j.issn.1000-0593(2017)10-3103-05
[29] 刘轲, 周清波, 吴文斌, 等. 基于多光谱与高光谱遥感数据的冬小麦叶面积指数反演比较[J]. 农业工程学报, 2016, 32(3): 155-162.DOI:10.11975/j.issn.1002-6819.2016.03.022.
[30] 梁美, 孙博君, 孙晓刚, 等. 多光谱高温计有效波长标定方法研究[J].光谱学与光谱分析, 2017, 37(8): 2352-2355. DOI:10.3964/j.is sn.1000-0593(2017)08-2352-04.

