高效液相色谱法评价海洋生物中半胱氨酸双加氧酶活性
范子瑞,胡佳妃,江瑞妮,杨星玲,金火喜*
(浙江海洋大学食品与医药学院,浙江 舟山 316022)
牛磺酸又称牛胆酸,是一种含硫的非蛋白氨基酸,在体内以游离状态存在,具有广泛的生理功能,如促进婴幼儿脑组织和智力发育、增强人体免疫、增强细胞抗氧化能力等[1-8],在临床上已被广泛应用于心血管疾病、糖尿病、眼部疾病等一系列疾病的治疗[9-11]。牛磺酸的分布十分广泛,哺乳动物的主要脏器,如:心脏、脑、肝脏中含量较高[12-14];海洋生物,特别是海鱼、贝类,如墨鱼、牡蛎、海螺、蛤蜊等牛磺酸含量最为丰富[15-18]。
生物体内牛磺酸的生物合成途径较为复杂,其中通过半胱氨酸双加氧酶催化半胱氨酸形成半胱亚磺酸,再经半胱亚磺酸脱羧酶催化脱羧生成亚牛磺酸,最后氧化成牛磺酸是最主要的途径[19-23]。相比于哺乳动物,虽然海洋生物体内牛磺酸含量非常丰富,但对其合成途径中的关键酶(半胱氨酸双加氧酶和半胱亚磺酸脱羧酶)的研究则鲜有文献报道。据此,本研究以牛磺酸主要途径中的半胱氨酸双加氧酶为对象,通过建立快速灵敏的分析方法来评价不同种类海洋生物体内半胱氨酸双加氧酶的活性。目前,对海洋生物体内半胱氨酸双加氧酶活性进行广泛的检测和筛选等相关工作在国内尚属空白。本研究的结果可为后续进一步明确海洋生物体内牛磺酸的合成途径提供参考依据。
向从海洋生物组织样品中提取的初酶液中加入底物半胱氨酸,适宜条件下反应,通过检测反应液中产物半胱亚磺酸的含量可定量分析样品中半胱氨酸双加氧酶的活性。高效液相色谱法检测氨基酸的含量,常常采用柱前衍生法,主要有异硫氰酸苯酯衍生法、单磺酰氯衍生法[24]、邻苯二甲醛(o-phthalaldehyde,OPA)衍生法[25-28]等。异硫氰酸苯酯衍生氨基酸需要专门的衍生装置和无水环境,有毒且易于降低柱寿,单磺酰氯试剂价格又相对昂贵,OPA衍生法则安全简便。本实验采用OPA为衍生剂,甲醇-乙酸钠为流动相,拟建立峰形良好、快速准确的半胱亚磺酸含量检测方法,利用该方法分析不同海洋生物中半胱氨酸双加氧酶的活性。
1 材料与方法
1.1 材料与试剂
白瓜子、贻贝和白蛤等海洋生物购于舟山市乐购超市。
半胱氨酸、半胱亚磺酸、OPA、甲醇、硼酸、氢氧化钠、乙酸钠、乙硫醇、磷酸氢二钠、磷酸二氢钠、硫化钠 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
1200高效液相色谱仪 美国Agilent公司;Agilent Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm)、SHZ-88A水浴恒温振荡器 苏州市培英实验设备有限公司;FS-1高速匀浆机 江苏金坛市环宇科学仪器厂。
1.3 方法
1.3.1 溶液的配制
0.4 mol/L硼酸钠缓冲液配制:称取2.48 g硼酸和1.41 g氢氧化钠,用蒸馏水定容至100 mL。衍生试剂配制:用1 mL甲醇溶解0.01 g的OPA,再加入0.01 mL乙硫醇,用0.4 mol/L的硼酸钠缓冲液定容至10 mL,在冰箱中密封避光保存。pH 7.4磷酸缓冲溶液配制:准确称取磷酸氢二钠0.081 mol,磷酸二氢钠0.019 mol,定容至500 mL。半胱亚磺酸标准液(1 mg/mL)配制:准确称取0.05 g半胱亚磺酸,用pH 7.4磷酸缓冲液定容至50 mL。
1.3.2 半胱亚磺酸分析方法建立
吸取半胱亚磺酸标样250 μL于1.5 mL离心管中,加入一定量的衍生剂,摇匀,在37 ℃恒温水浴锅内反应,经0.45 μm微孔滤膜过滤,立刻进样20 μL,通过高效液相色谱进行分析,记录其峰面积及其保留时间。根据峰形、保留时间等指标对检测波长、衍生剂量、衍生时间、流动相比例、流速等条件进行优化。初始条件:色谱柱XDB-C18,甲醇-乙酸钠(65∶35,V/V),半胱亚磺酸与衍生剂物质的量比1∶2,流速1 mL/min,衍生时间2 min,波长315 nm。
1.3.3 半胱亚磺酸标准曲线制作
将半胱亚磺酸标准液(1 mg/mL)用超纯水依次稀释成0.4、0.2、0.1、0.05、0.02、0.01 mg/mL 6 个质量浓度梯度。各取250 μL于1.5 mL离心管中,按照1.3.2节所述步骤,在最优条件下对半胱亚磺酸质量浓度进行测定。以半胱亚磺酸质量浓度为横坐标,峰面积为纵坐标,制作标准曲线。
1.3.4 精密度实验
分别取0.01、0.1 mg/mL和0.4 mg/mL的半胱亚磺酸标准溶液,按照1.3.2节所述步骤,在最优条件下对半胱亚磺酸质量浓度进行测定。每种质量浓度平行测定5 次,记录峰面积,并计算相对标准偏差。
1.3.5 样品中半胱氨酸双加氧酶活性检测
取20 g洗净的海洋生物组织(肉、内脏、鳃等),加入2.5 倍体积磷酸盐缓冲液(0.02 mol/L,pH 7.4),在冷水循环控温下,匀浆30 min后4 ℃、8 000 r/min离心20 min,去沉淀。上清液采用硫酸铵盐析(饱和度70%,温度4 ℃)4 h,10 000 r/min离心15 min,弃上清液。沉淀中加入50 mL磷酸盐缓冲液(0.02 mol/L,pH 7.4),并置于同种缓冲液中透析12 h,中途更换一次缓冲液。实验组取透析后的初酶液1 mL,加入0.05 mol/L半胱氨酸溶液1 mL,再加入0.05 mol/L硫化钠溶液0.2 mL。另取初酶液1 mL,加入1 mL磷酸盐缓冲液和0.2 mL 0.05 mol/L硫化钠溶液,作为对照组。将实验组和对照组均于37 ℃、120 r/min条件下反应2 h。取250 μL反应液于0.5 mL离心管内,按照1.3.2节方法检测产物半胱亚磺酸的含量。在上述反应条件下,每分钟催化生成1 µg半胱亚磺酸所需的酶量定义为一个酶活单位(U)。
2 结果与分析
2.1 波长选择
以甲醇-乙酸钠为流动相,在不同波长下对半胱亚磺酸衍生物进行检测,结果如图1所示。当波长为280 nm时,半胱亚磺酸与相邻峰未达到基线分离,分离效果差;当波长为315 nm时,半胱亚磺酸衍生物有最大吸收峰,且与相邻峰的分离得到改善,达到基线分离,保留时间为1.46 min;当波长增加到360 nm时,又出现新的相邻峰,难以与半胱亚磺酸峰完全分离;当波长继续提高到430 nm时,出现倒型峰,峰形极差。故选择315 nm为后续半胱亚磺酸的检测波长。
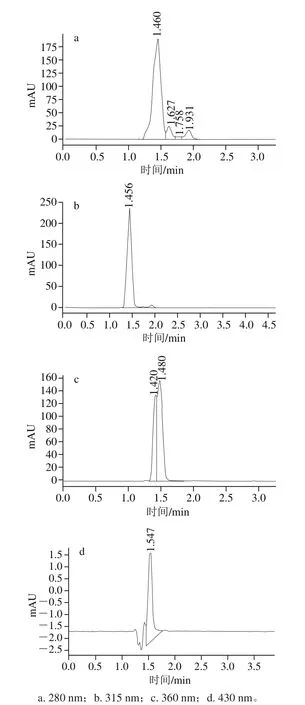
图1 不同波长下半胱亚磺酸色谱图Fig.1 Chromatograms of cysteine sulf i nate at different wavelengths
2.2 流动相比例选择
选用甲醇与0.05 mol/L的乙酸钠作为流动相,分别选择体积比30∶70、40∶60、50∶50、65∶35和80∶20进行实验。如表1所示,在不同的体积比下,半胱亚磺酸与相邻峰均能达到基线分离,但保留时间随着甲醇比例的增加而缩短,吸收峰面积则先减小后增大。在半胱亚磺酸质量浓度为0.1 mg/mL下,当甲醇-乙酸钠(30∶70,V/V)时,半胱亚磺酸保留时间为2.18 min,峰面积为1 284;当甲醇-乙酸钠(50∶50,V/V)时,半胱亚磺酸保留时间为1.47 min,峰面积为993;当甲醇和乙酸钠体积比提高到80∶20时,半胱亚磺酸保留时间为1.46 min,峰面积为1 361。以吸收峰面积(峰面积最大)及保留时间长短(保留时间最短)为评价指标,确定流动相:甲醇-乙酸钠(80∶20,V/V)。
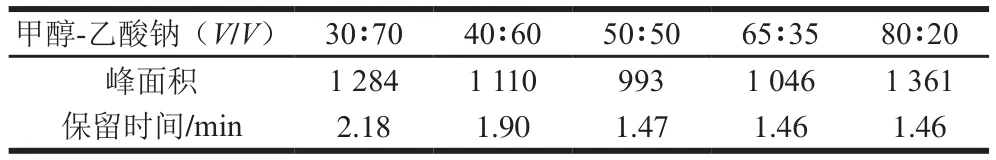
表1 流动相比例对半胱亚磺酸检测的影响Table1 Effect of mobile phase composition on detection of cysteine sulf i nate
2.3 流动相流速选择
流动相流速太慢,目标物质保留时间延长,峰形变宽;流速太快则会导致目标物质尚未完全检测,峰面积变小。本实验选择波长315 nm,甲醇-乙酸钠(80∶20,V/V)为流动相,考察不同流速(0.8、1.0、1.5、1.8、2.0 mL/min)对半胱亚磺酸(0.1 mg/mL)检测的影响。结果发现,不同流速下半胱亚磺酸均有良好的分离效果,但保留时间和峰面积均随流速的增大而减小(表2)。综合考虑峰面积和保留时间,选择1.0 mL/min为最终流动相的流速。
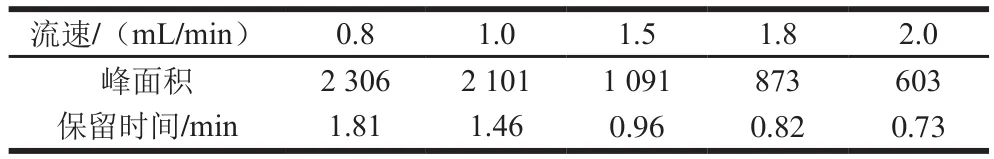
表2 流动相流速对半胱亚磺酸检测的影响Table2 Effect of mobile phase fl ow rate on detection of cysteine sulf i nate
2.4 衍生剂用量的选择
衍生剂用量对半胱亚磺酸的检测有一定影响,衍生剂太少,反应不完全,峰面积较小;衍生剂太多则不仅会导致药品的浪费,而且会影响峰形。本实验分别选择不同量的衍生剂(半胱亚磺酸和衍生剂物质的量比为2∶1、1∶1、1∶2、1∶3),以峰面积和峰形为评价指标,确定衍生剂的最适用量。如图2所示,随着衍生剂用量的增加,半胱亚磺酸峰面积也逐渐增加,但当衍生剂与底物物质的量比超过2∶1时,继续增加衍生剂用量峰面积不再增加,这说明衍生剂已经过量。此外,衍生剂与底物物质的量比达到3∶1时,半胱亚磺酸峰形较宽,且出现裂缝现象。所以,最终选择底物半胱亚磺酸与衍生剂物质的量比为1∶2。

图2 衍生剂用量对半胱亚磺酸峰面积的影响Fig.2 Effect of derivatizing agent on peak area of cysteine sulf i nate
2.5 衍生时间的选择
半胱亚磺酸与衍生试剂反应迅速,灵敏度高,但衍生产物并不稳定,衍生时间过长,产物分解,峰面积减小。如图3所示,随着衍生时间的延长,峰面积从1 min时的1 305增加到3 min时的2 031。继续延长衍生时间至5 min,峰面积下降至1 340,这说明衍生物已经部分分解。所以,本实验采用衍生时间为3 min。

图3 衍生时间对峰面积的影响Fig.3 Effect of derivatization time on peak area of cysteine sulf i nate
2.6 半胱亚磺酸测定标准曲线
在上述最优条件下,以半胱亚磺酸质量浓度为横坐标,峰面积为纵坐标,制得半胱亚磺酸标准曲线。当半胱亚磺酸在10~400 µg/mL范围时,半胱亚磺酸质量浓度与峰面积呈良好的线性关系,回归方程y=17.92x-129.3,R2= 0.998。
2.7 精密度实验结果

表3 精密度测试结果Table3 Results of precision test
选择3 个不同质量浓度的半胱亚磺酸标样,分别为低质量浓度(10 µg/mL)、中质量浓度(100 µg/mL)和高质量浓度(400 µg/mL),同一样品重复测定5 次,峰面积见表3。此3 种质量浓度的半胱亚磺酸标样相对标准偏差分别为6.4%、3.3%和0.9%,说明该方法精密度较高,具有良好的重复性。
2.8 样品中半胱氨酸双加氧酶的活性检测结果
本实验选择了几种有代表性海洋生物,对其不同组织中胱氨酸双加氧酶的活性进行了检测。取一定量海产品组织,经洗净、匀浆、盐析和透析后得粗酶液。取粗酶液加入一定量的底物半胱氨酸,一定条件下反应后检测反应液中半胱亚磺酸的含量(具体过程见1.3.5节),从而评价样品中半胱氨酸双加氧酶的活性。由图4可知,样品反应液中半胱亚磺酸的检测受到其他组分一定程度上的干扰,但总体上分离度尚可,后续实验有待进一步改进。
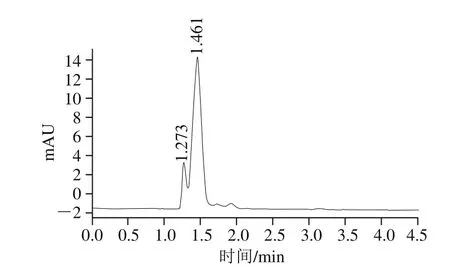
图4 样品反应液色谱图Fig.4 Chromatogram of cysteine sulfonate produced by crude cysteine dioxygenase
通过对各组织样品反应液中半胱亚磺酸进行检测,并根据其质量浓度计算半胱氨酸双加氧酶活性,结果如表4所示。贝类、虾类、蟹类和海洋鱼类体内均检测到半胱氨酸双加氧酶的活性,其中南美白对虾体内半胱氨酸双加氧酶活性高达28.9 U。白蛤、蛤蜊和梭子蟹中半胱氨酸双加氧酶活性也较高。对大黄鱼、海鲈鱼和美国红鱼不同组织中半胱氨酸双加氧酶的活性进行检测,结果发现,不同组织中半胱氨酸双加氧酶的活性有显著差异。一般来说,鱼体内脏,特别是肝脏中半胱氨酸双加氧酶的活性明显高于其他组织,而鳃中半胱氨酸双加氧酶的活性则最低。此外,肠和肌肉组织中半胱氨酸双加氧酶的活性也较高。
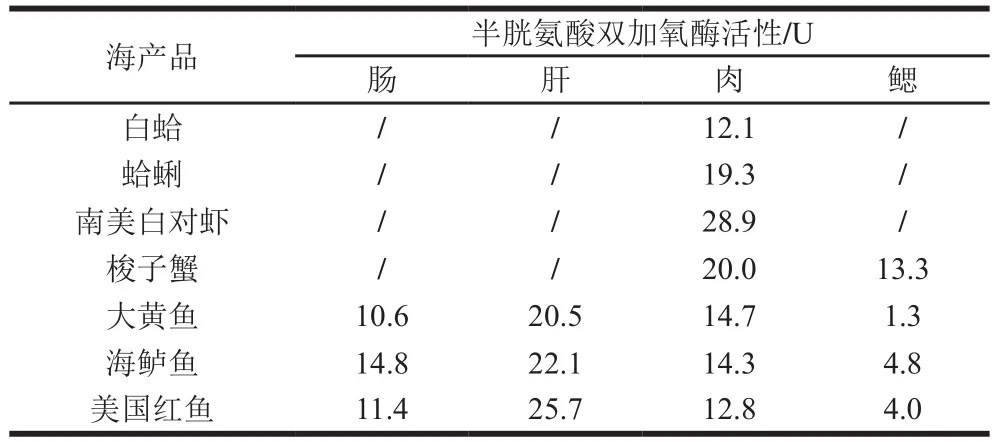
表4 不同海洋生物组织中半胱氨酸双加氧酶活性的测定Table4 Determination of cysteine dioxygenase activity in different marine organisms
海洋生物是牛磺酸的天然宝库,尤其是海洋贝类、甲壳类、鱼类等,其体内含有十分丰富的牛磺酸[29]。据文献[30]报道,牛磺酸在不同组织中的含量差异较大。一般来说,鱼体内脏,尤其是肝脏中牛磺酸含量较高,而鳃中则含量较少。本实验结果显示,在海洋生物的不同组织中,半胱氨酸双加氧酶活性的大小与文献报道的牛磺酸含量的分布相关联,表明半胱氨酸双加氧酶是牛磺酸生物合成途径中的关键酶,其活性的大小间接决定了牛磺酸含量的高低。所以,检测海洋生物不同组织中半胱双加氧酶的活性,可一定程度上评估其牛磺酸的合成能力。若再结合其他相关酶活性的检测,可定性分析不同海洋生物体内牛磺酸的合成途径,为揭示牛磺酸的合成机制提供一定的参考基础。
3 结 论
本实验建立了半胱亚磺酸的高效液相色谱分析方法。采用OPA柱前衍生法,检测波长315 nm,以甲醇-乙酸钠(8∶2,V/V)为流动相,流速为1 mL/min,半胱亚磺酸与衍生试剂物质的量比为1∶2,衍生时间3 min,半胱亚磺酸出峰时间为1.46 min。该方法在10~400 μg/mL质量浓度范围内具有良好的线性关系(R2>0.99),相对标准偏差为0.9%~6.4%。利用该方法检测不同海产品组织中半胱氨酸双加氧酶的活性。检测结果表明,不同的海洋生物中半胱氨酸双加氧酶活性差异较大,其中南美白对虾中活性最高,而不同组织中则以肝脏中活性最高,鳃中活性最低。该研究表明,海洋生物体内牛磺酸的合成极有可能是通过半胱氨酸双加氧酶途径,其活性的大小一定程度上决定了海洋生物体内牛磺酸的水平。
[1] RAK K, VOLKER J, JURGENS L, et al. Neurotrophic effects of taurine on spiral ganglion neurons in vitro[J]. Neuroreport, 2014,25(16)∶ 1250-1254. DOI∶10.1097/WNR.0000000000000254.
[2] ABD-RABOU A A, ZOHEIR K M, AHMED H H. Potential impact of curcumin and taurine on human hepatoma cells using Huh-7 cell line[J]. Clinical Biochemistry, 2012, 45(16/17)∶ 1519-1521.DOI∶10.1016/j.clinbiochem.2012.06.032.
[3] 曾德寿, 高振华, 赵京辉, 等. 牛磺酸对肉仔鸡生产性能免疫器官发育及抗氧化能力的影响[J]. 中兽医学报, 2009, 29(6)∶ 774-778.
[4] 王洁, 陆克义, 李险峰, 等. 牛磺酸预处理对大鼠心肌梗死的保护作用[J]. 中国药理学通报, 2012, 28(5)∶ 647-650.
[5] KHIMSUKSRI S, WYSS J M, THAEOMOR A, et al. Perinatal taurine exposure programs patterns of autonomic nerve activity responses to tooth pulp stimulation in adult male rats[J]. Advances in Experimental Medicine and Biology, 2013, 775∶ 121-134. DOI∶10.1007/978-1-4614-6130-2_10.
[6] FUNKE S, AZIMI D, WOLTERS D, et al. Longitudinal analysis of taurine induced effects on the tear proteome of contact lens wearers and dry eye patients using a RP-RP-Capillary-HPLC-MALDI TOF/TOF MS approach[J]. Journal of Proteomics, 2012, 75(11)∶ 3177-3190. DOI∶10.1016/j.jprot.2012.03.018.
[7] SCHAFFER S W, SHIMADA K, JONG C J, et al. Effect of taurine and potential interactions with caffeine on cardiovascular function[J].Amino Acids, 2014, 46(5)∶ 1147-1157. DOI∶10.1007/s00726-014-1708-0.
[8] KIM C, CHA Y N. Taurine chloramine produced from taurine under inf l ammation provides anti-inf l ammatory and cytoprotective effects[J].Amino Acids, 2014, 46(1)∶ 89-100. DOI∶10.1007/s00726-013-1545-6.
[9] BESSHO M, MURASE M Y, IMAGAWA A, et a1. Possible contribution of taurine to distorted glucagon secretion in intra-islet insulin def i ciency∶ a metabolome analysis using a novel α-cell model of insulin-deficient diabetes[J]. PLoS ONE, 2014, 9(11)∶ e113254.DOI∶10.1371/journal.pone.0113254.
[10] SEIDL R, PEVRL A, NICHAM R, et a1. A taurine and caffeinecontaining drink stimulates cognitive performance and well-being[J].Amino Acids, 2000, 19(3/4)∶ 635-642. DOI∶10.1007/s007260070013.
[11] WINIARSKA K, SZYMANSKI K, GORNIAK P, et al.Hypoglycaemic, antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits[J]. Biochimie, 2009, 91(2): 261-270.DOI:10.1016/j.biochi.2008.09.006.
[12] YUN K U, RYU C S, OH J M, et al. Plasma homocysteine level and hepatic sulfur amino acid metabolism in mice fed a high-fat diet[J]. European Journal of Nutrition, 2013, 52(1): 127-134. DOI:10.1007/s00394-011-0294-0.
[13] LI J H, LING Y Q, FAN J J, et al. Expression of cysteine sulfinate decarboxylase (CSD) in male reproductive organs of mice[J].Histochemistry and Cell Biology, 2006, 125(6)∶ 607-613.DOI∶10.1007/s00418-005-0095-8.
[14] MIYAZAKI T, MATSUZAKI Y. Taurine and liver diseases∶ a focus on the heterogeneous protective properties of taurine[J]. Amino Acids,2014, 46(1)∶ 101-110. DOI∶10.1007/s00726-012-1381-0.
[15] GORMLEY T R, NEUMANN T, FAGAN J D, et al. Taurine content of raw and processed fi sh fi llets/portions[J]. European Food Research and Technology, 2007, 225(5/6)∶ 837-842. DOI∶10.1007/s00217-006-0489-4.
[16] PINTO W, RONNESTAD I, JORDAL A E, et al. Cloning, tissue and ontogenetic expression of the taurine transporter in the flatfish Senegalese sole (Solea senegalensis)[J]. Amino Acids, 2012, 42(4)∶1317-1327. DOI∶10.1007/s00726-010-0826-6.
[17] HIGUCHI M, CELINO F T, TAMAI A, et al. The synthesis and role of taurine in the Japanese eel testis[J]. Amino Acids, 2012, 43(2)∶ 773-781. DOI∶10.1007/s00726-011-1128-3.
[18] MATSUNARI H, HASHIMOTO H, IWASAKI T, et al. Effect of feeding rotifers enriched with taurine on the growth and survival of larval amberjack Seriola dumerili[J]. Fisheries Science, 2013, 79(5)∶815-821. DOI∶10.1007/s12562-013-0657-y.
[19] GOTO T, MATSUMOTO T, TAKAGI S. Distribution of the hepatic cysteamine dioxygenase activites in fi sh[J]. Fisheries Science, 2001,67∶ 1187-1189. DOI∶10.1046/j.1444-2906.2001.00381.x.
[20] UEKI I, STIPANUK M H. Enzymes of the taurine biosynthetic pathway are expressed in Rat Mammary Gland[J]. The Journal of Nutrition, 2007, 137(8)∶ 1887-1894.
[21] STIPANUK M H, LONDONO M, LEE J I, et al. Enzymes and metabolites of cysteine metabolism in nonhepatic tissues of rats show little response to changes in dietary protein or sulfur amino acid levels[J]. The Journal of Nutrition, 2002, 132∶ 3369-3378.
[22] DOMINY J E, HIRSCHBERGER L L, COLOSO R M, et al.Regulation of cysteine dioxygenase degradation is mediated by intracellular cysteine levels and the ubiquitin-26S proteasome system in the living rat[J]. Biochemical Journal, 2006, 394∶ 267-273.DOI∶10.1042/BJ20051510.
[23] STIPANUK M H, DOMINY J E, LEE J I, et al. Mammalian cysteine metabolism∶ new insights into regulation of cysteine metabolism[J].The Journal of Nutrition, 2006, 136∶ 1652S-1659S.
[24] UBUKA T, OKADA A, NAKAMURA H. Production of hypotaurine from L-cysteinesulfinate by rat liver mitochondria[J]. Amino Acids,2008, 35(1)∶ 53-58. DOI∶10.1007/s00726-007-0633-x.
[25] 叶思平, 陈悦娇, 陈海光, 等. 高效液相色谱测定益智仁中的牛磺酸含量[J]. 食品科学, 2013, 34(10)∶ 204-206. DOI∶10.7506/spkx1002-6630-201310044.
[26] 陈申如, 胡阳, 倪辉, 等. 高效液相色谱法测定牡蛎中牛磺酸含量[J].中国食品学报, 2013, 13(2)∶ 193-198. DOI∶10.16429/j.1009-7848.2013.02.011.
[27] 王芬, 张婷, 顾振新, 等. 高效液相色谱法测定紫菜中牛磺酸含量[J].食品科学, 2012, 33(18)∶ 162-164.
[28] 高加龙, 章超桦, 刘书成, 等. 邻苯二甲醛柱前衍生高效液相色谱法测定马氏珠母贝中牛磺酸含量[J]. 广东海洋大学学报, 2007(1)∶ 55-58.
[29] 谭乐义, 薛长湖, 林洪, 等. 海洋生物中牛磺酸的生物活性及其含量测定[J]. 海洋科学, 2001, 25(1)∶ 26-27.
[30] 谭乐义, 章超桦, 薛长湖, 等. 牛磺酸的生物活性及其在海洋生物中的分布[J]. 湛江海洋大学学报, 2000, 20(3)∶ 75-79.

