1α,25(OH)2D3对大鼠关节软骨细胞蛋白聚糖和蛋白聚糖酶代谢的调节作用
官剑,谭启钊,赵振达,刘忠军,宋纯理,冷慧杰
(北京大学第三医院骨科,北京 100191)
骨性关节炎是一种慢性发展的炎症性疾病,虽然在过去十几年里,人们对骨性关节炎的了解越来越深,但其精确的病理机制仍然不是很清楚。蛋白聚糖损耗引起的关节软骨侵蚀是导致骨性关节炎的重要病理机制之一[1]。蛋白聚糖广泛分布于所有结缔组织中,其通过形成糖胺聚糖与核心蛋白共价结合。聚蛋白聚糖(aggrecan)是一种主要的蛋白聚糖,其核心蛋白包含三个球形结构域和一个大扩展区组成。经硫酸软骨素和硫酸角质素修饰后的蛋白聚糖通过与软骨组织水合,为软骨提供抗压缩和弹性性能[2]。蛋白聚糖酶和基质金属蛋白酶能降解关节软骨基质中的蛋白聚糖及二型胶原。ADAMTS-4/5分别为aggrecan的两种水解酶aggrecanase-1/2,aggrecanase-1/2在蛋白聚糖的降解中发挥至关重要的作用[3]。骨性关节炎关节软骨一旦磨损,几乎不可修复。但有文献表明,在骨关节炎早期,蛋白聚糖水解是可逆的,而且保持蛋白聚糖的完整性可以防止胶原纤维被水解,选择性的蛋白聚糖酶抑制剂将发挥全面的保护软骨作用通过抑制蛋白聚糖和胶原破坏[4]。因此,蛋白聚糖的保护对于抑制甚至修复骨性关节炎至关重要。此外,蛋白聚糖的代谢与炎症因子密切相关。据研究显示,将TNF-α、IL-1α和IL-1β注射至小鼠关节处能抑制软骨细胞蛋白聚糖的合成[5]。在大鼠颞下颌关节滑膜成纤维细胞中,TNF-α刺激能抑制蛋白聚糖的合成[6]。在培养的软骨移植组织中,IL-1β刺激能抑制蛋白聚糖的水解[7]。
维生素D(VD)是一种类固醇激素,在许多靶组织中发挥多种生物学功能,VD最终活性形式是1α,25(OH)2D3。VD的基础功能是调节钙磷稳态和骨代谢[8]。此外,VD能影响软骨、软骨下骨、以及关节周围的肌肉的成分与结构状态[9]。可能由于流行病学对人群的筛选困难很大,目前流行病学尚没有确切的证据证实VD对关节炎的治疗作用。但有一系列研究证据表明VD对关节的保护作用。VD对骨关节炎软骨中的软骨细胞具有直接影响,而血清VD水平与骨关节炎软骨的损失有重要相互关系[10]。VD缺乏可能促进膝骨关节炎的发展[11]。VD通过与其受体结合诱导一系列下游信号级联反应,VD缺乏加大骨关节炎的诱发风险,可能导致软骨厚度的降低[12]。最近证据表明VD在介导炎症降低的过程中,发挥关键的免疫调节作用,其在T淋巴细胞、B淋巴细胞、巨噬细胞及树突状细胞中均有表达[13]。我们的前期实验研究表明,1α,25(OH)2D3可以影响软骨细胞基质金属蛋白酶和润滑素的分泌[14],并可以通过作用于TGF-β1,调节关节软骨Ⅱ型胶原的表达和降解[15]。因此,本研究旨在探讨1α,25(OH)2D3是否能够调节蛋白聚糖的代谢平衡来保护软骨细胞抵抗炎症损伤。
1 材料与方法
1.1 材料
1.1.1实验动物
实验所用软骨细胞取自2~3周的SPF级Sprague-Dawley雄性大鼠(n=10,45~50 g),由北京大学医学部实验动物科学部提供【SCXK(京)2016-0041】。
1.1.2试剂和设备
1α,25(OH)2D3(Selleck,美国);胎牛血清(Gibco,美国);DMEM/F12培养基(Procell,中国)双抗(Gibco,美国)。甲苯胺蓝试剂(中国医药集团,中国);CCK-8试剂盒(Biosharp,中国);II型胶原抗体(Abcam,英国);Trizol(Aidlab,中国);HiScript Reverse Transcriptase (RNase H)(Vazyme,中国);ADAMTS4抗体(Abcam,英国);ADAMTS5抗体(Abcam,英国);Aggrecan抗体(武汉三鹰生物技术有限公司,中国);GAPDH抗体(杭州贤至生物有限公司,中国);流式细胞仪(BD Biosciences,美国);倒置显微镜(Thermo,美国);实时荧光定量PCR仪(Thermo,美国);酶标仪(Thermo,美国)。
1.1.3实验分组
将软骨细胞分为12组,进行组间比较。分组具体包括(表1):无任何处理的对照组,正常低VD(10 nmol/L)组,正常高VD(100 nmol/L)组,IL-1α诱导组,IL-1α诱导+VD(10 nmol/L)组,IL-1α诱导+VD(100 nmol/L)组,IL-1β诱导组,IL-1β诱导+VD(10 nmol/L)组,IL-1β诱导+VD(100 nmol/L)组,TNF-α诱导组,TNF-α诱导+VD(10 nmol/L)组,TNF-α诱导+VD(100 nmol/L)组。实验进行前,先用无血清培养基饥饿处理12 h(过夜),再进行药物干预24 h,所有实验至少重复3次。
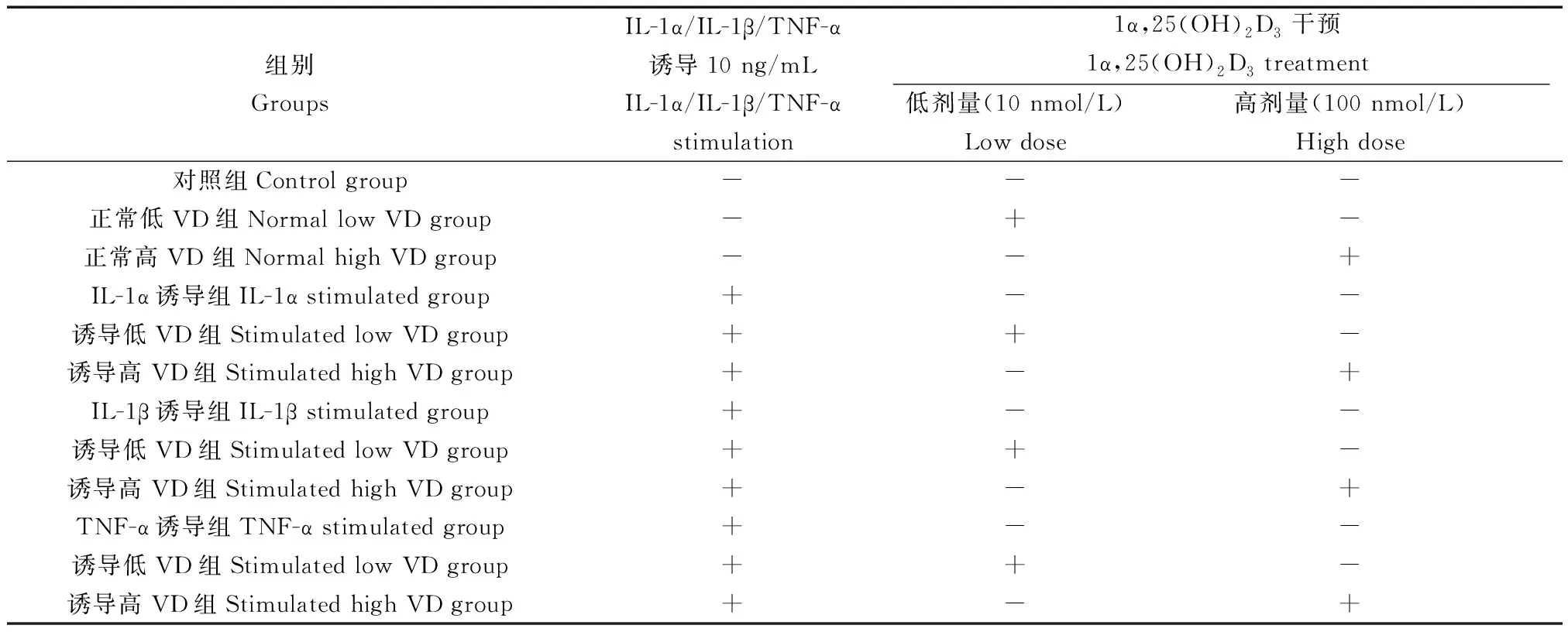
表1 软骨细胞实验分组Tab.1 Groups of chondrocytes in the study
1.2 方法
1.2.1软骨细胞分离、培养与鉴定
取SD大鼠安乐死,用75%乙醇浸泡5 min,移至超净工作台内。仰卧固定大鼠,剪开腿部皮肤,打开膝盖,无菌切取双侧膝关节软骨,放入含双抗的PBS缓冲液中,将组织切成1 mm3小块。PBS清洗组织2遍,加入0.2% II型胶原酶,37℃水浴摇床消化4~6 h。随后加入大鼠关节软骨细胞完全培养基稀释消化液,吸管轻轻吹打至液体中无大块组织;300 g离心5 min后弃上清,保留细胞与组织沉淀。用大鼠关节软骨细胞完全培养基重悬细胞与组织,接种于多聚赖氨酸预先包被的培养皿中,于37℃,5% CO2恒温培养箱中静置培养,3天后首次换液,以后每3 d换液一次。利用甲苯胺蓝染色及Ⅱ型胶原免疫荧光实验进行软骨细胞鉴定。具体方法细节请参考我们已发表的研究[16]。原代软骨细胞会随着代数增加发生去分化现象,失去正常表型,本实验所用细胞为前3代软骨细胞。
1.2.2软骨细胞增殖活性测定
取处于对数生长期、生长状态良好的大鼠软骨细胞,用DMEM/F12培养基调整细胞密度至6.0×104/mL接种于96孔板,每孔加入100 μL细胞悬液,37℃培养过夜(在细胞孔周围孔内加入100 μL无菌PBS)。用无血清的DMEM/F12培养基进行饥饿处理12 h。每组3个复孔,37℃恒温培养24 h。每孔加入10 μL CCK-8溶液,37℃恒温培养4 h。在450 nm波长处使用酶标仪测定各组软骨细胞的吸光度值,来反映软骨细胞的增殖活性。
1.2.3软骨细胞凋亡水平的测定
使用annexinV-FITC/PI细胞凋亡检测试剂盒检测软骨细胞凋亡水平。收集细胞,0.5 mL binding buffer重悬细胞,再用5 μL annexinV-FITC混匀后加入5 μL PI染色液混匀。室温避光反应5~10 min(同时设阴性对照,即正常细胞不加annexin和PI;阳性对照1,只加5 μL Annexin V;阳性对照2,只加5 μL PI,以凋亡效果最明显的溶剂组作为阳性对照,)。使用流式细胞仪上机检测,激发波长为488 nm,由630 nm的带通滤光片接收,通过FSC/SSC散点图收集细胞,分析PI荧光直方图上凋亡细胞百分率。
1.2.4软骨细胞中aggrecan、ADAMTS-4、ADAMTS-5 mRNA表达水平的检测
取1 mL Trizol裂解液加入到细胞沉淀中,反复轻柔吹打,裂解细胞。再将细胞裂解液移至新的无RNase的1.5 mL EP管中,室温放置5 min。加入0.2 mL氯仿,摇匀15 s,4℃、12 000 r/min离心15 min,将上层水相(约400 μL)转移入另一EP管中,加入等体积异丙醇,混匀,室温静置10 min。4℃、12 000 r/min离心10 min,弃上清。加入1 mL预冷的75%乙醇洗涤沉淀,4℃、12 000 r/min离心10 min,弃上清。重复此步骤一次。空气中干燥RNA沉淀5~10 min,将沉淀溶于20 μL DEPC水中。取2 μL RNA溶液,使用核酸微量测定仪检测A260、A280以及A260/A280值,计算RNA的纯度和浓度。根据A260/A280比值,估测RNA质量,比值在1.8~2.0之间满足实验要求。根据吸光光度值按下列公式计算样品RNA的浓度:总RNA浓度(μg/μL)=A260×40×10-3。按照逆转录试剂盒和实时荧光定量PCR试剂盒说明书进行操作,对aggrecan、ADAMTS-4、ADAMTS-5的mRNA水平进行检测。aggrecan、ADAMTS-4、ADAMTS-5的引物由天一辉远生物科技有限公司(武汉,中国)合成,GAPDH为内参,2-ΔΔCT用于计算相对表达量。反应体系为20 μL,每组实验设置3个复孔。引物序列如表2。

表2 引物序列Tab.2 Primer sequences
1.2.5软骨细胞中aggrecan、ADAMTS-4、ADAMTS-5蛋白表达水平的检测
使用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白样品浓度用于western blot分析。分别制备10%的分离胶和5%的浓缩胶,测完蛋白含量后,根据计算好的上样量上样。以80 V恒压进行电泳,待样品进入分离胶后,增加电压至120 V恒压电泳,大约2 h,电泳至溴酚蓝抵达分离胶底部,断开电源。以240 mA电流,4℃进行电转膜120 min。洗净的硝酸纤维素膜在5%的BSA/TBST封闭液中室温封闭1 h。分别添加一抗aggrecan、ADAMTS-4、ADAMTS-5和GAPDH,摇床上4℃过夜。室温TBST洗膜3次,每次10 min。添加相应二抗,摇床上室温孵育60 min。室温TBST洗膜3次,每次10 min。双红外激光扫描成像系统进行荧光显色,分析。
1.3 统计学分析
使用Graphpad 6.0软件进行数据处理,所有数据以平均数±标准差进行表述。组与组之间的比较采用单因素方差分析(One-way ANOVA followed by the LSD post hoc test),以P<0.05表示差异有显著性。
2 结果
2.1 关节软骨细胞鉴定
通过甲苯胺蓝染色和免疫荧光染色,分别观察到蛋白聚糖(图1A)和二型胶原表达(图1B)。如图1A所示,软骨细胞核呈现蓝色。如图1B所示,二型胶原阳性细胞呈现绿色荧光。
2.2 1α,25(OH)2D3对关节软骨细胞增殖活性的影响
如图2所示,IL-1α、IL-1β及TNF-α刺激均能降低软骨细胞活性(P< 0.001),与对照组软骨细胞相比,1α,25(OH)2D3干预不影响正常软骨细胞的活性水平。在IL-1α、IL-1β及TNF-α诱导的软骨细胞中,不同浓度的1α,25(OH)2D3(10 nmol/L和100 nmol/L)干预均能一定程度提高促炎症因子诱导后的软骨细胞活性(P< 0.01),其中100 nmol/L 1α,25(OH)2D3效果更显著(P< 0.001)。
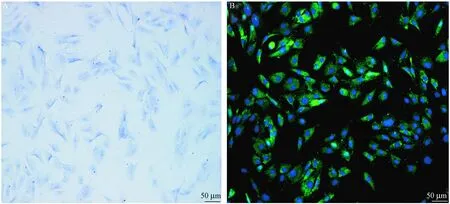
注: A. 软骨细胞甲苯胺蓝染色;B. 软骨细胞II型胶原免疫荧光染色。图1 软骨细胞染色(×200)Note. A. Chondrocytes stained with toluidine blue; B. Chondrocytes with immunofluorescence staining of type II collagen.Fig.1 Microscopic appearance of the chondrocytes (×200)
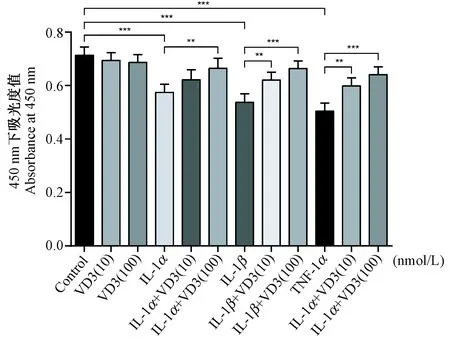
注:**P < 0.01, ***P < 0.001。图2 1α,25(OH)2D3对IL-1α、IL-1β及TNF-α诱导后软骨细胞活性的影响Note. **P < 0.01, ***P < 0. 001.Fig.2 Effects of 1α,25(OH)2D3 on viability of chondrocytes after IL-1α, IL-1β and TNF-α treatment
2.3 1α,25(OH)2D3对关节软骨细胞凋亡水平的影响
如图3所示,IL-1α、IL-1β及TNF-α诱导均能增加软骨细胞凋亡水平(P< 0.001),且TNF-α的作用强于IL-1β,IL-1β的作用强于IL-1α。与对照组软骨细胞相比,1α,25(OH)2D3干预不影响正常软骨细胞的凋亡水平。在IL-1α、IL-1β及TNF-α诱导的软骨细胞中,不同浓度的1α,25(OH)2D3(10 nmol/L和100 nmol/L)干预均能一定程度降低促炎症因子诱导后的软骨细胞凋亡水平(P< 0.001),其中100 nmol/L 1α,25(OH)2D3效果更显著,且在不同的炎症刺激强度下均具有较好效果。
2.4 1α,25(OH)2D3对关节软骨细胞中aggrecan、ADAMTS-4、ADAMTS-5 mRNA表达水平的影响
如图4 A所示,1α,25(OH)2D3不影响正常软骨细胞aggrecan的mRNA表达水平。IL-1α、IL-1β及TNF-α诱导均能下调软骨细胞中aggrecan的mRNA表达水平(P< 0.001),且TNF-α的作用强于IL-1β,IL-1β的作用强于IL-1α。不同浓度的1α,25(OH)2D3(10 nmol/L和100 nmol/L)干预均能增加促炎症因子诱导后的软骨细胞中aggrecan的mRNA水平(P< 0.001)。ADAMTS-4和ADAMTS-5是最主要蛋白聚糖酶。如图4B-C所示,IL-1α、IL-1β及TNF-α诱导均能上调软骨细胞中ADAMTS-4(图4B)和ADAMTS-5(图4C)的mRNA表达水平。在IL-1α、IL-1β、及TNF-α诱导的软骨细胞中,不同浓度的1α,25(OH)2D3(10 nmol/L和100 nmol/L)干预均能下调促炎症因子诱导后的软骨细胞中ADAMTS-4(图4B)和ADAMTS-5(图4C)的mRNA表达水平(P< 0.001),其中100 nmol/L 1α,25(OH)2D3效果更显著,且在不同炎症刺激强度下,其作用效果相似。
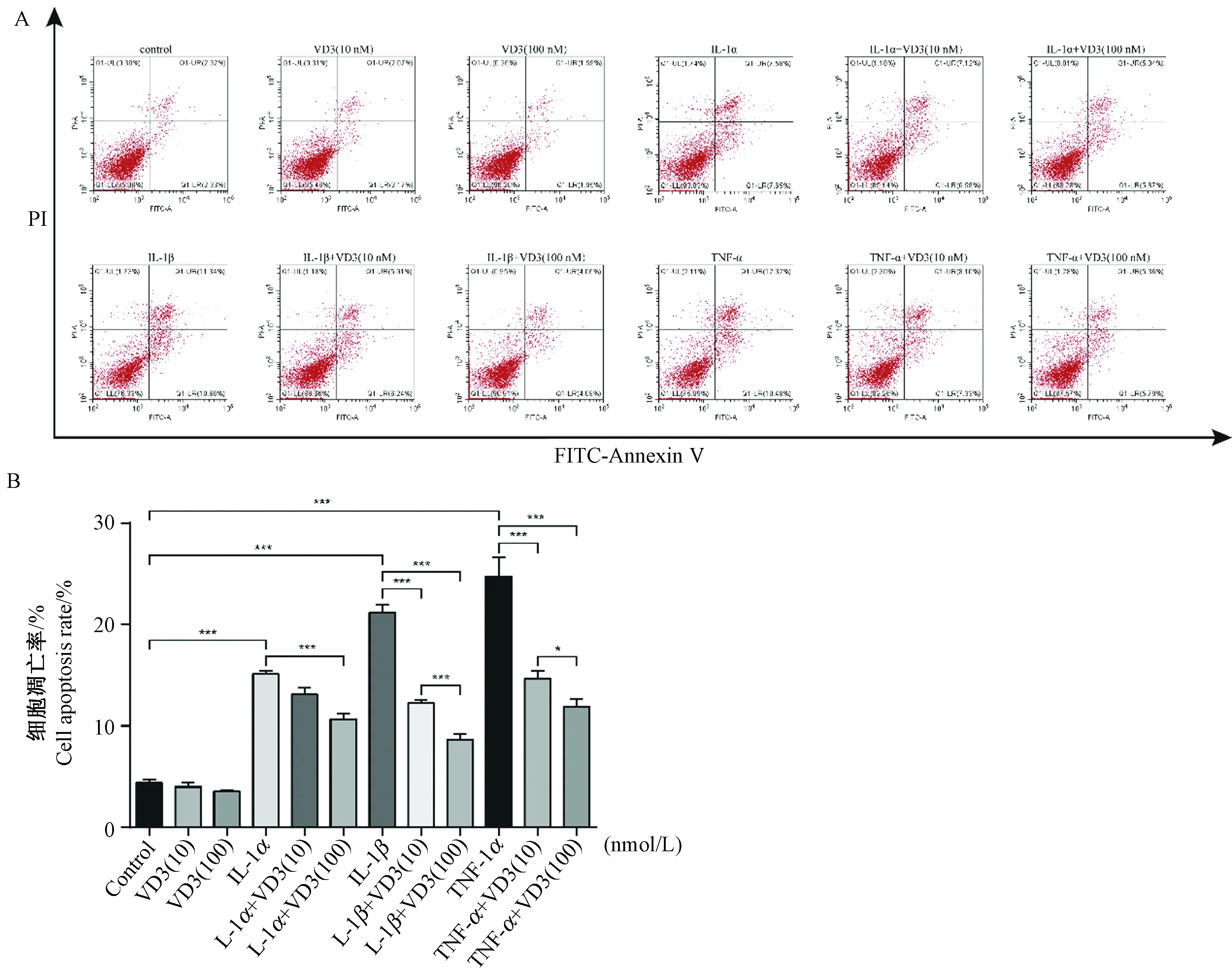
注:A. 流式细胞术测量。B.软骨细胞凋亡水平的量化分析。*P< 0.05, ***P< 0.001。图3 1α,25(OH)2D3对IL-1α、IL-1β、及TNF-α诱导后软骨细胞凋亡水平的影响Note. A. results from low cytometry. B. Quantification analysis. *P< 0.05, ***P < 0.001.Fig.3 Effects of 1α,25(OH)2D3 on apoptosis rate of chondrocytes after IL-1α, IL-1β, and TNF-α treatment
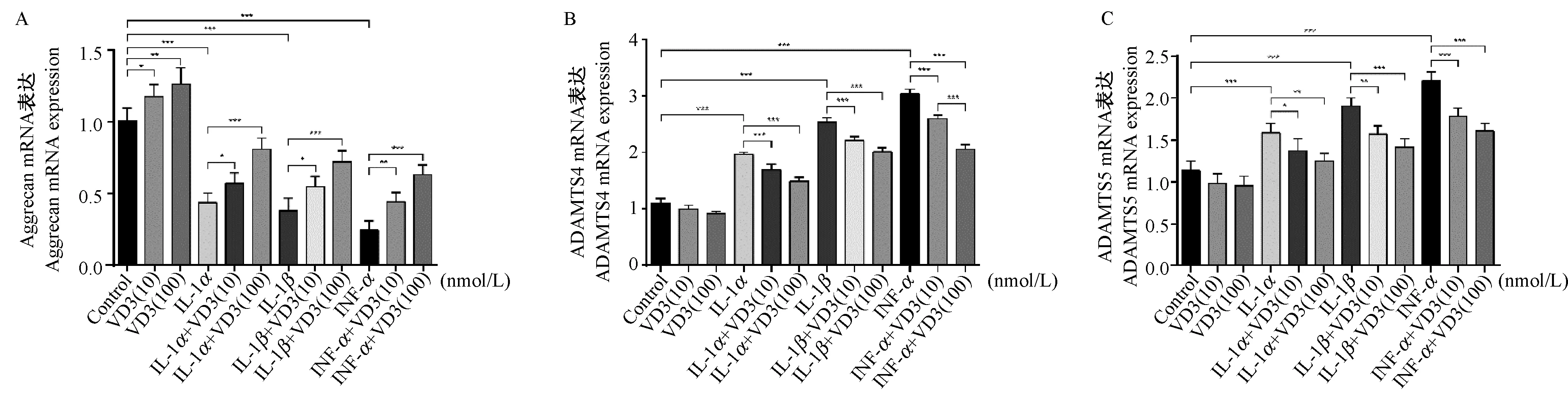
注:(A)aggrecan,(B)ADAMTS-4,(C)ADAMTS-5。 *P< 0.05, **P< 0.01,***P<0.001。图4 1α,25(OH)2D3对IL-1α、IL-1β、及TNF-α诱导后软骨细胞中mRNA表达水平的影响。Note.(A)aggrecan,(B)ADAMTS-4,(C)ADAMTS-5. *P< 0.05, **P < 0.01, ***P < 0.001.Fig.4 Effects of 1α,25(OH)2D3 on the mRNA levels after IL-1α, IL-1β, and TNF-α treatment
2.5 1α,25(OH)2D3对关节软骨细胞中aggrecan、ADAMTS-4、ADAMTS-5蛋白表达的影响
如图5 A所示,1α,25(OH)2D3不影响正常软骨细胞aggrecan、ADAMTS-4和ADAMTS-5的蛋白表达。IL-1α、IL-1β及TNF-α诱导均能下调软骨细胞中aggrecan的蛋白表达(P< 0.001),在此过程中,TNF-α的作用强于IL-1β,IL-1β的作用强于IL-1α。1α,25(OH)2D3(100 nmol/L)干预能增加IL-1β和TNF-α诱导后的软骨细胞中aggrecan的蛋白合成(P< 0.001),而对IL-1α诱导组差异无显著性。IL-1α、IL-1β及TNF-α诱导均能上调软骨细胞中ADAMTS-4(图5C)和ADAMTS-5(图5D)的蛋白表达水平。在IL-1α、IL-1β及TNF-α刺激的软骨细胞中,1α,25(OH)2D3(10 nmol/L和100 nmol/L)干预均能下调促炎症因子诱导后的软骨细胞中ADAMTS-4(图5C)和ADAMTS-5(图5D)的蛋白表达水平(P< 0.001),呈剂量依赖性,且在不同炎症刺激强度下,其作用效果相似。
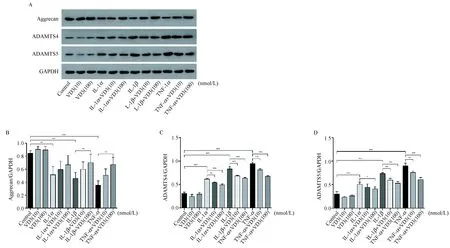
注:(A)1α,25(OH)2D3对IL-1α、IL-1β及TNF-α诱导后软骨细胞中aggrecan、ADAMTS-4和ADAMTS-5蛋白表达的影响。(B-D)Aggrecan、ADAMTS-4和ADAMTS-5蛋白表达的量化图。*P< 0.05, **P< 0.01, ***P<0.001。图5 1α,25(OH)2D3对关节软骨细胞中aggrecan、ADAMTS-4、ADAMTS-5蛋白表达的影响Note. (A) Effects of 1α,25(OH)2D3 on the expressions of aggrecan, ADAMTS-4 and ADAMTS-5 after IL-1α, IL-1β and TNF-α treatment at protein level. (B-D) Quantification of the expressions of aggrecan, ADAMTS-4 and ADAMTS-5. *P< 0.05, **P< 0.01, ***P< 0.001.Fig.5 Effects of 1α,25(OH)2D3 on the expressions of aggrecan, ADAMTS-4 and ADAMTS-5 in the chondrocytes
3 讨论
在骨性关节炎发展的早期阶段,通常会特征性地出现蛋白聚糖和胶原水平的降低等软骨特性的改变,同时也会出现一些酶的活化及蛋白聚糖容量的减少[17]。生物化学,形态学和结构上的改变最终导致软骨被侵蚀至软骨下骨的水平[18]。蛋白聚糖是关节软骨细胞外基质中的一种主要的大分子,与II型胶原类似,能引起胶原诱导的DBA/1小鼠关节炎,在遗传易感的BALB/c小鼠中,与蛋白聚糖发生免疫反应能诱导慢性关节炎[19]。因此蛋白聚糖在关节炎的发生发展中发挥不可忽视的关键作用。同时,在骨性关节炎发生期间,软骨细胞暴露于促炎症细胞因子如IL-1β和TNF-α下,也是促进关节炎发展的重要原因,IL-1β和TNF-α会刺激软骨细胞,从而促进蛋白聚糖和II型胶原的分解代谢,进而破坏软骨细胞外基质完整性和组织稳态[20]。
促炎症细胞因子白细胞介素-1(interleukin-1, IL-1)和肿瘤坏死因子α(tumor necrosis factor, TNF-α)都能促进关节软骨的破坏[21],但软骨对这两类促炎症因子的应答机制却不同,如一氧化氮能增强TNF-α诱导的软骨蛋白聚糖的降解,而不影响IL-1β诱导的软骨aggrecan的降解[22]。因此,当前实验分别使用了促炎症因子IL-1α、IL-1β和TNF-α对大鼠软骨细胞进行刺激,诱导关节软骨细胞炎症反应,模拟体内骨性关节炎发生时软骨细胞的改变。之前的研究显示,IL-1β能通过增加降低细胞活力及增加细胞凋亡水平诱导软骨细胞损伤[23],TNF-α能通过增加凋亡水平诱导软骨细胞损伤[24]。当前研究结果显示,与对照组软骨细胞相比,IL-1α、IL-1β和TNF-α诱导显著降低了大鼠软骨细胞的活性水平,同时显著诱导了软骨细胞的凋亡。表明IL-1α、IL-1β和TNF-α刺激成功诱导了软骨细胞的炎性损伤。VD作为一种类固醇激素,其主要通过作用于VD受体来改变肾脏重吸收,从而调节钙循环和磷酸盐平衡[25]。VD在骨形成,体内矿物质平衡及免疫稳态的调节中也发挥重要作用[26]。据调查显示,VD缺乏与骨性关节炎发生风险相关[27],单一的VD缺乏可能增加膝骨关节炎的发生风险[28]。但也有研究提示,VD缺乏与关节炎发生之间的关系仍存在争议[12]。因此,VD在关节炎的发生发展中的作用尚不清楚。当前研究结果显示,在IL-1α、IL-1β和TNF-α刺激的软骨细胞中,1α,25(OH)2D3干预显著增强了软骨细胞的活性,同时降低了软骨细胞的凋亡水平,表明体外补充1α,25(OH)2D3具有保护软骨细胞抵抗炎性损伤的作用,其效果与1α,25(OH)2D3的浓度呈正相关性。然而,其作用的分子机制尚不清楚。
当前研究进一步从mRNA和蛋白表达水平调查了蛋白聚糖的代谢情况。结果显示,IL-1α,IL-1β和TNF-α刺激显著下调了软骨细胞蛋白聚糖的表达水平,且TNF-α的作用强于IL-1α和IL-1β。然而,在IL-1α、IL-1β和TNF-α诱导的软骨细胞中,1α,25(OH)2D3干预显著上调了软骨细胞蛋白聚糖的表达水平,且在不同炎症强度条件下对蛋白聚糖的合成促进作用无显著差异。表明1α,25(OH)2D3可能在不同炎症强度条件下均能促进蛋白聚糖的合成,但其促进作用不随炎症强度变化而变化。此外,单独的1α,25(OH)2D3干预能显著上调软骨细胞aggrecan的表达。而有实验表明,1α,25(OH)2D3能通过一种转录后机制下调IRC细胞系aggrecan的表达[29],并能抑制成骨细胞蛋白聚糖的合成,增强成骨细胞蛋白聚糖的分解[30]。表明1α,25(OH)2D3对蛋白聚糖的代谢调节作用可能与细胞种类和培养条件有关。
体内和体外的软骨移植实验揭示,在关节软骨破坏期间,蛋白聚糖酶是蛋白聚糖降解最主要的蛋白水解酶[31]。ADAMTS-4和ADAMTS-5作为蛋白聚糖的2类水解酶,其在骨关节炎发生期间,对软骨损伤的作用尚未调查清楚[3]。因此,我们进一步从mRNA和蛋白表达水平调查了软骨细胞ADAMTS-4和ADAMTS-5的表达情况。研究结果显示,IL-1α、IL-1β和TNF-α刺激显著增加了软骨细胞ADAMTS-4和ADAMTS-5的表达。然而,在IL-1α、IL-1β和TNF-α诱导的软骨细胞中,1α,25(OH)2D3干预显著降低了软骨细胞ADAMTS-4和ADAMTS-5的表达水平,并呈一定剂量依赖性。1α,25(OH)2D3单独干预则不影响ADAMTS-4和ADAMTS-5的表达水平,无显著差异。以上结果表明IL-1α、IL-1β和TNF-α诱导不仅降低了软骨细胞蛋白聚糖的表达,同时也增加了蛋白聚糖酶的表达,提示IL-1α、IL-1β和TNF-α刺激抑制软骨细胞蛋白聚糖的合成代谢,促进其分解代谢。相反,1α,25(OH)2D3干预则抑制了促炎症因子所致的蛋白聚糖下调和蛋白聚糖酶上调,进而发挥软骨保护作用。
虽然已经有诸多研究关于VD对骨性关节炎的作用,但较少有研究VD在关节软骨的退变和再生中的具体作用。在我们的研究中,初步证明了1α,25(OH)2D3干预对不同促炎症因子刺激的大鼠关节软骨细胞具有保护作用,并提出这一作用可能是通过增加软骨细胞蛋白聚糖的合成并抑制蛋白聚糖酶活性所介导的,因此,维持血清正常1α,25(OH)2D3水平有益于保护软骨细胞抵抗炎症刺激。这将为骨关节炎的预防和治疗提供新的思路。

