高效液相色谱法测定人血清万古霉素浓度
李 容
(重庆市涪陵中心医院药学部,重庆 408000)
万古霉素是有抗生素后效应的时间依耐性抗菌药物,抗感染治疗成败与其血药谷浓度密切相关,血药谷浓度应控制在10~20 mg/L,至少要保持在10 mg/L以上,以避免发生耐药[1]。万古霉素的用药人群包括新生儿、婴幼儿、老年人、肾功能不全及长期应用万古霉素的患者等特殊人群,应用时必须严格调整剂量,并进行血药浓度监测。本研究中用高效液相色谱(HPLC)法测定人血清中万古霉素浓度,不仅可以为临床万古霉素的血药浓度监测提供试验手段,为临床合理用药提供理论依据,还可为患者制订个体化给药方案,减少用药后的不良反应。目前,国内外对人血清中万古霉素的浓度监测方法有6类,即微生物检测法[2]、酶放大免疫法(EMIT)[3]、荧光偏振免疫法(FPIA)[4]、液相色谱 -质谱联用法(LC-MS/MS)[5]、离子对色谱法[6]、高效液相色谱法。由于微生物检测法耗时较长且精密度低,EMIT和FPIA的专属性较差,LC-MS/MS法仪器价格昂贵致前期投入较大,而高效液相色谱法具有提取率高、重复性好、稳定性好、灵敏度高、操作简便等特点,因此,我院亦采用HPLC法测定万古霉素的血药浓度。
1 仪器与试药
1.1 仪器
LC-20A型高效液相色谱仪(日本岛津公司);UV-2401PC型紫外分光光度计(日本岛津公司);高精度电子天平(上海光正医疗仪器股份有限公司);pH计(上海仪电科学仪器股份有限公司);TG16W型医用高速离心机(长沙平凡仪器仪表股份有限公司);TD4B型医用离心机(长沙平凡仪器仪表股份有限公司)。
1.2 试药
万古霉素标准品(中国食品药品检定研究院,纯度为 99%,批号为 130360-201302);甲醇(批号为20160601),乙腈(批号为 20151111),均为色谱纯,由美国Burdick&Jackson公司提供;磷酸二氢钾(批号为2016042801),三氯乙酸(批号为 2016073101),均为分析纯,由成都市科龙化工试剂厂提供;磷酸(分析纯,重庆川东化工集团有限公司,批号为20160509);试验用水为本院自制重蒸馏水,空白血清为本院检验科采集。
2 方法与结果
2.1 色谱条件
色谱柱:VP-ODSC18柱(150mm×4.6mm,4.6μm);流动相:0.05 mol/L 磷酸二氢钾缓冲溶液(pH=3.2)-甲醇(83∶17);流速:1mL/min;紫外检测波长:205nm;柱温:25℃;进样量:20μL。
2.2 溶液配制
流动相配制:取磷酸二氢钾6.805 g,精密称定,置1000mL烧杯中,用1000mL蒸馏水溶解,搅拌均匀,用磷酸调节溶液的pH,缓慢滴加,边滴加边用玻璃棒搅匀,直至溶液的pH达3.2,即配制成0.05mol/L的磷酸二氢钾缓冲溶液(pH=3.2),置阴凉处保存,备用。
标准贮备液:取0.045 0 g万古霉素标准品,精密称定,置50 mL容量瓶中,用蒸馏水溶解并定容,摇匀,即配制成质量浓度为980 μg/mL的标准贮备液,于冰箱中4℃冷藏,备用,使用时稀释为所需质量浓度。
蛋白沉淀剂:称取三氯乙酸10 g,用纯化水溶解至100 mL,摇匀,即得10%三氯乙酸溶液,用微量移液器分别移取1 200 μL 10%三氯乙酸溶液和300 μL乙腈置EP管中,震荡摇匀,置阴凉处保存,备用。
2.3 血清样品预处理
抽取使用过万古霉素患者的静脉血约3 mL,置普通抽血管中,以2 500 r/min的速率离心5 min,取上层血清样品 200 μL,置 2.0 mL EP 管中,再加入 150 mL蛋白沉淀剂[10% 三氯乙酸 -乙腈(1 200 μL ∶300 μL)],以12 000 r/min的速率离心15 min,取上清液 20 μL进样。
2.4 方法学考察
专属性试验:在选定的样品处理方法和色谱分离条件下,测定空白血清、空白血清加标准品及血清样品的色谱峰。按拟订色谱条件进样测定,血清中干扰物质峰主要出现在12.5 min前,故把万古霉素的保留时间(tR)控制在14 min左右,万古霉素与血清中的干扰物质能得到良好分离,同时分离时间也不太长,保证了实验时间的合理性和可控制性。色谱图见图1。
线性关系考察:用微量移液管分别取10,20,40,60,80,100,120 μL 万古霉素标准贮备液,置 2.0 mL EP管中,分别加入纯化水 190,180,160,140,120,100,80 μL,振荡 3 min,摇匀;取上述溶液各 20 μL 置另一系列EP管中,各加入180 μL空白血清,振荡3 min摇匀,配置成质量浓度分别为 4.90,9.80,19.60,29.40,39.20,49.00,58.80 μg/mL 的溶液;再各加入 150 μL蛋白沉淀剂,振荡3 min,摇匀;最后置离心机中,以12 000 r/min的速率离心15 min,取出;按拟订色谱条件进样测定,以质量浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程 Y=26 385X-19 207,r=0.999 6(n=7)。结果表明,血清质量浓度在 4.90 ~58.80 μg/mL范围内与峰面积线性关系良好;最低检测限为 1.96 μg/mL(n=7)。
精密度试验:取适量万古霉素标准溶液加至180 μL空白血清中,分别配制成质量浓度为 9.80,19.60,29.40,39.20 mg/L 的血清样品溶液,按专属性试验方法处理样品,吸取上清液20 μL直接进样,1 d内重复测定5次,每次分析17 min,连续测定5 d。结果见表1。可见该方法的日内、日间 RSD均低于4%(n=5)。
绝对回收率试验:精密吸取万古霉素对照品贮备液,配制质量浓度为 9.80,19.60,29.40 mg/L 的万古霉素血清样品,按2.2项下方法处理样品,每一质量浓度平行操作5份,取20 μL进样,将仪器检测到的质量浓度与实际配制质量浓度相比得方法回收率,详见表2。
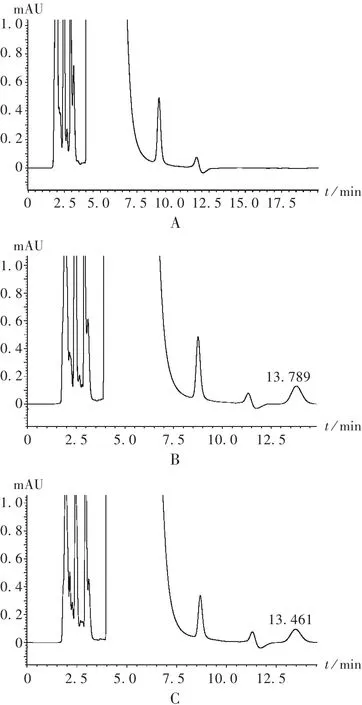
图1 高效液相色谱图

表1 日内、日间精密度试验结果(n=5)

表2 绝对回收率试验结果(n=5)
稳定性试验:制备 4.9,39.2,58.8 μg/mL 低、中、高3种质量浓度万古霉素血清样品各3份,于冰箱冷藏室(2~8℃)冷藏 1,2,4 d,考察其稳定性,结果见表 3。
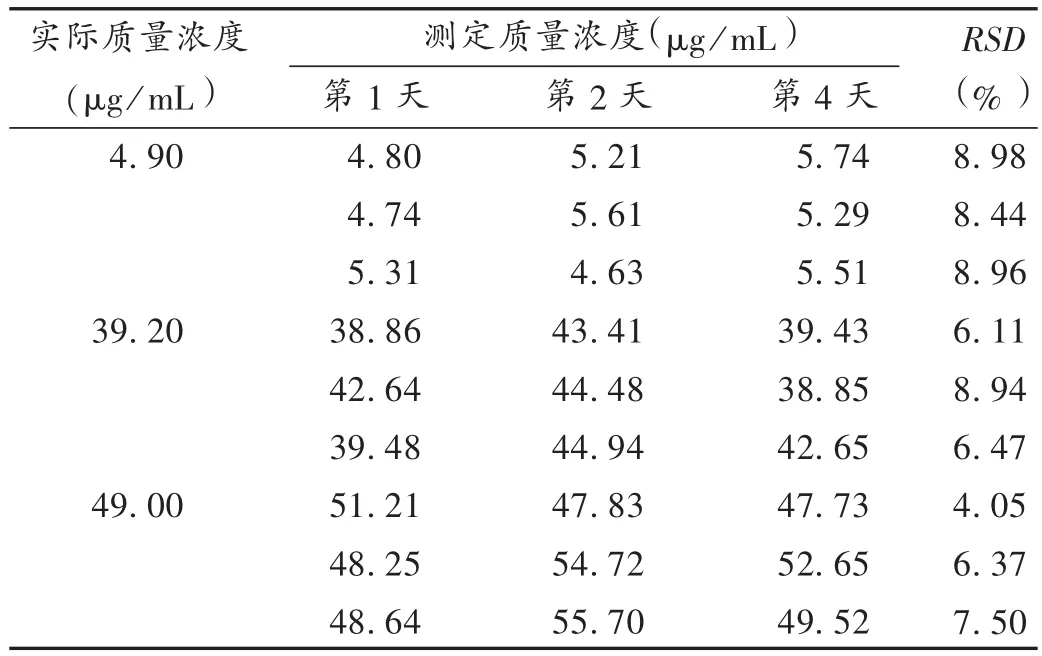
表3 稳定性试验结果(n=3)
2.5 临床应用
2.5.1 病例分析
患者,男,50岁,体质量60 kg,因糖尿病伴多种并发症及肺部感染,于2017年1月23日入住重症监护室(ICU),入院后立即给予心电监护、吸氧、保留导尿、建立静脉通道、行床旁心电图。微生物检查报告导管血及导管尖端培养均有表皮葡萄球菌感染,痰培养提示有肺炎克雷伯菌、白色念珠菌、铜绿假单胞菌感染。结合患者病情考虑为导管相关脓毒血症,给予万古霉素、氟康唑、哌拉西林他唑巴坦等抗生素进行抗感染治疗。在使用万古霉素前,患者的血清肌酐为417.7 μmol/L,肌酐清除率为 15.80 mL/min,医师给予“万古霉素 1 g,q12 h”静脉微泵输入,连用3 d后于再次给药前取患者血清,送检,用HPLC法测定万古霉素的血药浓度,测定值为48.71 μg/mL(重症患者参考值为 15 ~20 μg/mL),医师调整给药方式为“0.5 g,biw,ivgtt”,24 h 后测定患者的血肌酐为 686.1 μmol/L,肌酐清除率为 9.62 mL/min,仍持续使用万古霉素等抗生素1周后,静脉导管尖端培养未见细菌生长,患者病情好转,一般情况尚可,肾功能损害较大,转出ICU,转入肾内科病房继续治疗。
表4 FPIA法与HPLC法测定万古霉素标本的结果
2.5.2 FPIA法与HPLC法测定结果比较
标本来源为重庆医科大学附属儿童医院。利用SPSS统计软件分析,对数据进行两独立样本 t检验,分析结果认为,两总体的方差无显著差异。说明我院用HPLC法与重庆医科大学附属儿童医院FPIA法2种方法测定人血清中万古霉素的浓度的结果无显著性差异,表明我院建立的HPLC法测定万古霉素血药浓度方法可行。详见表4。
2.5.3 我院临床标本的测定
2016年11月至2017年3月,我科为ICU监测万古霉素血药浓度5次,测定结果见表5。

表5 我院临床ICU标本万古霉素测定结果
3 讨论
3.1 测定波长选择
将质量浓度为10 mg/L的万古霉素标准品溶液,以水作为空白对照在UV-2401PC型紫外分光光度计下进行扫描。结果,万古霉素在280 nm波长处有最大吸光度,有末端吸收;高效液相色谱法试验表明,280 nm处的吸收峰面积为205 nm波长处的吸收峰面积的1/7,故选择检测波长为205 nm。
3.2 流动相选择
曾考察了流动相系统中两种成分的不同比例对有效成分分离的影响,甲醇 -0.05 mol/L 磷酸二氢钾缓冲液(pH=2)的比例分别为16∶84和17∶83,等度洗脱。结果表明,两种流动相系统都能使万古霉素与杂质峰分开,但当甲醇-0.05 mol/L磷酸二氢钾缓冲液(pH=3.2)的比例为17∶83时万古霉素有较好的分离,分离度为 1.900,拖尾因子为 1.052,tR为 14 min,故最终选择后者(17∶83)为流动相。
3.3 蛋白沉淀剂优化
选择4种蛋白沉淀剂考察沉淀蛋白的效果,分别为10%硫酸锌溶液、10%三氯醋酸溶液、10%高氯酸沉淀蛋白二氯甲烷萃取、10%三氯乙酸和乙腈(4∶1)。结果显示,10%硫酸锌溶液沉淀蛋白不完全,离心后上清液浑浊无法直接进样;10%三氯乙酸沉淀蛋白二氯甲烷萃取,处理血样时操作烦琐,二氯甲烷萃取离心后水层不宜吸出;10%三氯乙酸溶液沉淀蛋白,离心后上清液澄清,但提取率只有33%,10%高氯酸和乙腈(4∶1)沉淀蛋白,离心后上清液澄清,提取率可达70%,所以最终选择10%三氯乙酸和乙腈(4∶1)作为血清蛋白沉淀剂。
3.4 研究价值
耳、肾毒性是万古霉素最严重的不良反应,其发生与血药浓度过高有关,临床应用时常通过监测血药浓度来降低耳、肾功能损害风险。HPLC法提取率高,重复性好,操作简便、灵敏,适用于临床患者使用万古霉素后的血药浓度测定。本研究使为患者进行个体化给药、优化给药方案和提高临床疗效成为可能。
[1]陈佰义,管向东,何礼贤,等.万古霉素临床应用中国专家共识(2011 版)[J].中国新药与临床杂志,2011,30(8):561-573.
[2]王 华,许 静,钱南萍,等.微生物法测定血浆中万古霉素血药浓度的研究[J].现代医药卫生,2008,24(16):2390-2391.
[3]彭斯维,陈永刚,邹吉利.酶放大免疫法测定去甲万古霉素的血药浓度[J].广东药学院学报,2014,30(5):553-558.
[4]肖 力,任 斌,陈小陆.荧光偏振法测定去甲万古霉素血药浓度[J].齐齐哈尔医学院学报,2007,28(3):315-316.
[5]张萌萌,史国兵,颜 鸣,等.LC-MS/MS法测定人血清中去甲万古霉素的血药浓度[J].中国药师,2013,16(7):990-993.
[6]鲁 军,史志华,赵永新.用离子对HPLC法测定人血清中去甲万古霉素的血药浓度[J].药学服务与研究,2007,7(1):73-75.

