沉默信息调节因子1对早期2型糖尿病大鼠脂联素的调节作用
唐正和,康怀兰,刘翠明
(山东莱芜钢铁集团有限公司医院内分泌科,莱芜 271126)
糖尿病(diabetes mellitus,DM)是一组因遗传和环境因素相互作用引起的临床综合征,而2型DM合并存在胰岛素抵抗和脂代谢障碍。DM状态下,炎症反应、自由基产生和脂质过氧化均可破坏肝细胞结构及功能,在肝病的发生发展过程中起重要的作用[1]。脂联素(adiponectin,APN)是脂肪组织中最丰富的基因产物之一,可加强胰岛素抑制糖异生作用并抑制肝糖原的生成,具有增加胰岛素敏感性、抗炎、抗动脉粥样硬化的作用,在机体脂质代谢、血糖稳态调控和血管生理作用中具有重要地位[2]。脂联素受体(adiponectin receptor,AdipoR)是介导APN生物学作用的关键蛋白,而肝脏是AdipoR2高表达器官。大量的研究证实[3],肥胖、胰岛素抵抗、2型DM患者血清APN水平显著变化,且与AdipoR2在靶器官的表达水平具有相关性。Wnt诱导分泌蛋白-1(Wnt-induced secreted protein-1,WISP-1)是Wnt信号通路活化后的下游靶基因之一[4],参与器官损伤修复,以及心、肺、肝等脏器纤维化的发生[5],而DM肝损伤是否与WISP-1有关,报道较少。沉默信息调节因子1(silent information regulator 1,SIRT1)可通过参与APN蛋白相关的多个细胞信号通路的表达调控而参与糖脂代谢[6]。本实验通过观察DM大鼠APN分泌与Wnt信号通路下游靶基因WISP-1在肝损伤组织中的表达,分析DM肝损伤发生的病理生理机制,并探讨SIRT1对APN分泌的调控作用。
1 材料与方法
1.1 实验材料
链脲菌素、SIRT1激动剂白藜芦醇(resveratrol,RES)、SIRT1抑制剂尼克酰胺(niacin amide,NIA)(上海国药试剂集团);血糖试纸(强生中国医疗器材有限公司);生物素标记山羊抗兔IgG/小鼠IgG二抗试剂盒(北京中杉金桥生物);TRIzol试剂盒(Roche,德国)。单克隆抗体:AdipoR(Cell Signaling Technology公司,美国),WISP-1(Sigma公司,美国),SIRT1(LifeSpan,美国),β-actin(Ambobio,美国)。7300型实时聚合酶链式反应仪(Applied Biosystems,德国)。
健康雄性Sprague-Dawley大鼠,SPF级,体质量150~180 g,50只[由山东省医学科学院动物中心提供,合格证号:SCXK(鲁)2016-0121]。适应性喂养1周后,随机分为2组:对照组10只和DM造模组40只。DM造模组采用高脂饮食(猪油30.0%,胆固醇2.5%,脱氧胆酸钠1.0%,常规饲料66.5%)灌胃,并于5周末禁食12 h后,一次性腹腔注射1%链脲菌素(30 mg/kg,pH=4.5的柠檬酸-柠檬酸三钠缓冲液);正常对照组饲以普通饮食,注射同体积柠檬酸-柠檬酸三钠缓冲液。造模后72 h尾静脉采血,血糖试纸检测空腹血糖(fasting blood glucose,FBG)。以FBG≥11.1 mmol/L,并出现多饮、多食、多尿和体质量下降者为DM大鼠模型成功。DM造模成功大鼠随机分为3组:DM组、DM+RES组和DM+NIA组,各组继续以高脂饮食灌胃4周,4周后DM+RES组和DM+NIA组分别每日再给予RES和NIA,持续4周。对照组继续以普通饲料喂养8周。
1.2 方法
1.2.1胰岛素敏感指数及肝损伤指标检测DM造模组大鼠分别于8周末禁食12 h,颈静脉窦取血,离心分离血清,检测FBG及空腹胰岛素(fasting insulin,FINS)水平,计算胰岛素敏感指数(insulin sensitivity index,ISI),公式为:ISI=ln[1/(FINS×FBG)];同时检测天门冬氨酸氨基转移酶(aspartate amino transferase,AST)、丙氨酸氨基转移酶(alanine amino transferase,ALT)和碱性磷酸酶(alkaline phosphatase,ALP)等肝血清酶学指标。
1.2.2标本收集造模结束后,麻醉大鼠,仰位固定,开胸,腹主动脉取血,5 ml/只,3000转/ min离心10 min,取上清,分装,-20℃保存待测。生化仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C);酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒检测APN水平。迅速取出肝脏,用预冷生理盐水洗净,取肝右叶分为两部分:一部分用4%多聚甲醛固定,制成肝脏组织石蜡块;另一部分置于液氮中保存待用。
1.2.3HE染色取石蜡切片常规脱蜡,苏木素染色10 min,流水稍洗,1%的盐酸乙醇分化,流水冲洗数分钟,伊红染色5 min,流水稍洗,梯度乙醇常规脱水,中性树胶封片。Eclipse TE 2000-S免疫荧光显微镜拍照(Nikon,日本),观察肝脏组织病理结构的改变。
在听觉上,民族唱法的音色亮多暗少,而美声的音色则相对较暗。在声音位置上,两种唱法也有不同之处,民族唱法高音转为脑后音,不竖上头顶,而美声唱法要求高音必须竖在头顶。
1.2.4Western bloting实验每20 mg组织加入100~200 μl含1 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fuoride,PMSF)的裂解液,研磨充分后,4℃下 14 000g离心10 min,取匀浆上清,并测定总蛋白浓度。总蛋白(40~70 μg上样量)于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)进行分离。湿法转膜2 h,5%脱脂奶粉封闭1 h后,与相应一抗4℃共孵育过夜。次日与辣根过氧化物标记的二抗共孵育,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析。
1.2.5逆转录-聚合酶链式反应将肝组织均匀粉碎后按TRIzol提取程序(说明书)提取组织总RNA;按鸟类成髓细胞白血病病毒(avian myeloblastic leukemia virus,AMV)逆转录试剂盒操作说明进行逆转录后,4℃保存。各目的基因的扩增引物序列,如表1所示。扩增条件:94℃预变性3 min,然后94℃变性30 s,55℃退火30 s,72℃延伸60 s,共 35个循环,最后72℃延伸5 min,快速冷却至4℃保存。2%琼脂糖凝胶电泳后,凝胶成像仪观察,用Band Scan 5.0软件测定条带灰度值。
1.3 统计学处理
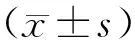
2 结 果
2.1 大鼠DM模型建立情况
DM造模组有5只大鼠造模后血糖检测值未达到标准,3只大鼠死亡,均剔除。DM组造模成功大鼠共32只,成功率为80%。随机分到DM组、DM+RES组及DM+NIA组分别10、11和11只。
实验期间,正常对照组大鼠状态良好、健壮、自主活动正常。而DM造模组大鼠逐渐出现精神萎靡、腥臊臭味加重,以及多饮、多食、多尿、体质量降低等DM症状。与正常对照组相比,DM造模组大鼠进食量[(33.41±4.29)vs(42.71±6.16)g/d]、饮水量[(54.01±8.77)vs(89.30±11.11)ml/d]和尿量[(7.88±3.17)vs(75.81±8.79)ml/d]均显著增高(P<0.05)。检测血糖相关指标,结果表明,与对照组比较,DM造模组大鼠血清FBG[(5.00±0.17)vs(32.30±3.11)mmol/L]和FINS[(21.27±0.62)vs(28.76±0.95)mU/L]显著升高(P<0.05),而ISI[(-4.67±0.45)vs(-6.83±0.70)]显著下降(P<0.01),表明2型DM大鼠造模成功。
2.2 4组大鼠血生化指标检测
与正常对照组比较,DM组大鼠血清FBG、TG、TC和LDL-C水平显著增高,而HDL-C水平显著降低,差异均具有统计学意义(P<0.05)。与DM组相比较,FBG在DM+RES组显著降低(P<0.05),在DM+NIA组略有升高,但差异无统计学意义(P>0.05);TC和LDL-C在DM+RES组显著降低(P<0.01),在DM+NIA组显著升高(P<0.05);TG在DM+RES组显著降低(P<0.05);HDL-C在DM+RES组显著升高(P<0.01;表2)。
2.3 4组大鼠肝损伤指标及血清APN水平检测
血清肝功能指标检测发现,DM组大鼠在造模8周后并发肝脏损伤,血清肝功能指标 ALT、AST、ALP及AST/ALT值均显著高于对照组(P<0.01)。与DM组相比较,DM+RES组的AST、ALP及AST/ALT值均显著下降(P<0.05),ALT也有所下降,但差异不具有统计学意义(P>0.05),显示肝损伤得到一定程度的改善;DM+NIA组的ALT、ALP及AST/ALT值继续显著升高(P<0.05;表3),显示肝损伤严重程度可能进一步加大。与对照组相比,血清APN在DM组显著降低(P<0.01);与DM组相比较,DM+RES组的APN水平略有升高,但差异无统计学意义(P>0.05),DM+NIA组血清APN水平显著降低(P<0.05;表3)。

表1 定量逆转录-聚合酶链反应引物序列
WISP-1: Wnt-induced secreted protein-1; AdipoR: adiponectin receptor; SIRT1: silent information regulator 1
2.4 光镜检查结果
与正常对照组大鼠相比较,DM组大鼠肝脏肝小叶结构紊乱,出现脂肪变性,肝细胞出现肿胀,胞浆出现空泡化;DM+RES组大鼠肝脏脂肪变性减轻,炎细胞浸润及点状坏死亦减轻,细胞质疏松化较轻;DM+NIA组大鼠肝脏细胞核被挤向细胞边缘,肝细胞散在小泡性脂滴,肝窦不清晰,肝索排列紊乱,肝细胞肿胀程度更高(图1)。
2.5 4组大鼠AdipoR2、WISP-1和SIRT1表达变化
Western blotting实验结果表明,相对于正常对照组,DM组大鼠肝脏AdipoR2和SIRT1蛋白表达显著降低(P<0.05),WISP-1蛋白表达显著升高(P<0.05);与DM组相比较,DM+RES组AdipoR2和SIRT1蛋白表达显著增加(P<0.05),WISP-1蛋白表达显著降低(P<0.05),而DM+NIA组AdipoR2和SIRT1蛋白表达显著降低(P<0.05),WISP-1蛋白表达具有降低趋势,但差异无统计学意义(P>0.05;图2)。
DM大鼠各组与正常对照组大鼠肝脏组织AdipoR2、WISP-1及SIRT1 mRNA的表达均表现出差异,表达趋势与蛋白表达基本一致。与对照组比较,AdipoR2和SIRT1 mRNA在DM组大鼠中表达显著降低(P<0.01),WISP-1蛋白表达显著升高(P<0.01);与DM组比较,AdipoR2和SIRT1 mRNA在DM+RES组表达显著增加(P<0.01),WISP-1 mRNA表达显著降低(P<0.01);而DM+NIA组AdipoR2表达显著降低(P<0.05),WISP-1 mRNA表达具有降低趋势,但差异无统计学意义(P>0.05),SIRT1 mRNA表达有升高趋势,差异无统计学意义(P>0.05;图3)。
3 讨 论
APN是脂肪组织表达最丰富的基因产物之一,具有改善胰岛素敏感性的作用,在机体脂质代谢和血糖稳态调控中具有重要作用[7]。APN作为体内最重要的脂源性激素之一,在肝脏组织糖和脂肪代谢中起关键性作用[8,9]。AdipoR作为APN的特异性受体,在多种组织中广泛分布,直接决定了APN效应的发挥。AdipoR1和AdipoR2在肝脏组织中均有表达,但存在差异性。AdipoR2在肝细胞的高表达,确保了APN可以准确有效地通过不同的受体形式发挥其反馈调节或改善糖脂代谢的作用[10]。研究表明[11],有DM家族史而糖耐量正常的个体其肝组织AdipoR2的表达水平与DM病情具有相关性。WISP-1是Wnt通路的下游因子,当其在细胞质或细胞核内异常积聚就会启动相应的基因转录,最终抑制细胞凋亡,促进细胞增殖。研究显示[12],作为Wnt通路下游的因子,WISP-1的表达受Wnt/β-catenin的调控。SIRT1参与DM多种并发症的发生发展,可能是重要的调控因子。Wang等[4]研究显示,SIRT1能够通过调控WISP-1的表达来参与DM心肌病的发生发展过程,但在DM肝损伤中的研究却未见报道。

表2 4组大鼠血生化指标比较
FBG: fasting blood glucose; TC: total cholesterol; TG: triglycerides; HDL-C: high-density lipoprotein cholesterol; LDL-C: low-density lipoprotein cholesterol. Compared with control group,*P<0.05,**P<0.01; compared with DM group,#P<0.05,##P<0.01

表3 4组大鼠肝损伤指标及血清APN水平比较
AST: aspartate amino transferase; ALT: alanine amino transferase; ALP: alkaline phosphatase; APN: adiponectin. Compared with control group,**P<0.01; compared with DM group,#P<0.05,##P<0.01
本实验研究DM状态下,大鼠模型肝组织的病理生理变化与APN和WISP-1蛋白表达之间关系。研究显示,在经过验证的DM大鼠模型中,可见肝组织大量炎细胞浸润、变性及坏死,模型组APN水平降低,AdipoR2表达降低,WISP-1蛋白表达显著升高;而当给予SIRT1特异性激动剂RES处理后,SIRT1蛋白表达显著增加,APN水平升高,伴随着AdipoR2表达也升高,WISP-1蛋白表达则降低。分析原因可能是由于SIRT1表达被激动后,Wnt/β-catenin信号通路受到抑制,导致下游WISP-1蛋白表达增加,WISP-1水平增高抑制了APN抵抗,而不断缓解胰岛素抵抗和所谓的“APN抵抗”相互影响,使APN促胰岛素敏感性的作用不断增强,形成肝损伤不断缓解的良性循环。本实验的肝组织病理学检查结果表明,DM+RES组表现出炎细胞浸润及坏死程度的减轻,也印证了这一点推断。而在DM+NIA组,WISP-1表达升高,APN水平和AdipoR2表达降低,也反向印证了我们的推断。

图3 AdipoR2、WISP-1及SIRT1 mRNA在各组中的表达
AdipoR: adiponectin receptor; WISP-1: Wnt-induced secreted protein-1;SIRT1: silent information regulator 1. Compared with control group,**P<0.01; compared with DM group,#P<0.05,##P<0.01
DM肝损伤是DM的严重并发症,内分泌改变在该病的发生发展过程中起重要作用。本研究证实了在早期DM肝损伤的发生发展过程中,SIRT1信号分子可能通过调节AdipoR的表达来调控APN的水平,参与DM内分泌系统的病理生理演变,进一步明确APN在DM肝损伤发生发展过程中可能的机制及SIRT1因子在该机制中可能的调节作用,为进一步阐明DM肝损伤的发生机制和寻找治疗靶点提供了参考。
【参考文献】

