Correlation of neurocognitive impairment and metabolic changes of thalamus in patients with chronic liver cirrhosis
, , , , , ,
(1.Postdoctoral Workstation, Guangzhou University of Chinese Medicine, Department of Medical Imaging, Longgang Central Hospital of Shenzhen, Shenzhen 518116, China; 2.Department of Medical Imaging, Guangdong Second Provincial General Hospital,Guangzhou 510317, China; 3.Center for Imaging and Invasive Intervention,Sun Yat-sen University Cancer Center, Guangzhou 510060, China)
肝性脑病(hepatic encephalopathy, HE)是慢性乙型肝炎(以下简称乙肝)、肝硬化较常见的并发症之一。轻微肝性脑病(minimal hepatic encephalopathy, MHE)患者仅表现为神经心理学测试改变,临床早期易漏诊;而从慢性肝硬化到MHE、再到HE,是一个连续发展的过程[1]。肝硬化患者中,MHE的发病率高达30%~84%,且合并MHE的肝硬化患者中,约50%将进展为HE[2]。既往研究[3]表明,MHE患者的神经认知功能损害与脑组织尤其是神经核团的代谢模式改变有关。作为间脑的最大结构,背侧丘脑是皮质下的重要结构,其内部大部分核团与大脑皮质间均有往返的纤维联系,在人体正常神经认知行为中发挥着重要作用。本研究回顾性观察慢性乙肝肝硬化患者神经认知功能改变,并分析其与背侧丘脑MRS改变的关系。
1 资料与方法
1.1 一般资料 收集于广东省第二人民医院就诊的慢性乙型肝炎肝硬化患者28例(肝硬化组),男24例,女4例,年龄27~61岁,平均(43.2±9.5)岁;慢性乙型肝炎病史9个月~31年,均经影像学和临床综合诊断或肝脏穿刺病理诊断为肝硬化;肝功能Child-Pugh分级A级11例、B级11例、C级6例。以同期28名受教育程度、性别及年龄相匹配的健康体检者作为对照组,男24名,女4名,年龄29~61岁,平均(43.1±7.7)岁;排除高血压,继发性神经心理功能异常如颅内占位性病变、硬膜下血肿、脑梗死、明显脑白质变性等,以及其他神经系统综合征如Wernicke病等,代谢性异常如电解质紊乱、糖尿病、酒精及药物中毒等。MR扫描前,所有受试者均接受数字连接试验A(number connection test-A, NCT-A)和数字符号试验(digit symbol test, DST)。
1.2 仪器与方法 采用Philips Achieva Nova-Dual 1.5T超导型MR扫描仪,常规序列扫描采用头部16通道线圈,以除外脑肿瘤、脑出血、大面积脑梗死等,尤其是背侧丘脑梗死。1H MRS扫描采用波谱成像专用单通道正交线圈,成像参数:TR 2 000 ms,TE 35 ms,层厚10 mm,NEX 2,FOV 18 cm×18 cm。于轴位T1WI上背侧丘脑面积最大层面进行波谱定位,感兴趣区视野(view of interest, VOI)为50 mm×30 mm,体素厚度10 mm,体素大小5 mm×5 mm×10 mm(图1A),周围设定4条饱和带以减少周围组织的部分容积效应影响。扫描前先进行自动预扫描,达到水的半高带宽<10,水抑制>98%后开始正式扫描,扫描时间为13 min。
1.3 图像处理 采用Philips SpectrView工作站分析并拟合出波谱图,于双侧丘脑各选择3个SNR高、波谱曲线基线平直且有明显窄峰的体素作为ROI进行测量,以其平均值作为一侧丘脑波谱数据。以肌酸(creatine, Cr)的波峰下面积为参照,计算各代谢物N-乙酰天门冬氨酸(N-acetylaminosuccinic acid, NAA)、胆碱(choline, Cho)、谷氨酰胺复合物(glutamine and glutamate, Glx)和肌醇(myoinosital, mI)峰下面积与肌酸峰下面积的比值:NAA/Cr、Cho/Cr、Glx/Cr及mI/Cr(图1)。
1.4 统计学分析 采用SPSS 13.0 统计分析软件。计量资料用±s表示,以配对样本t检验分别比较肝硬化组、对照组左右侧丘脑代谢物比值的差异,对双侧差异无统计学意义者取平均值,有统计学意义者则分别比较。采用两独立样本t检验比较肝硬化组与对照组间神经心理学测试结果及各代谢物比值。以年龄、性别及教育程度为协变量,采用偏相关分析观察肝硬化组患者背侧丘脑MRS代谢物比值与神经心理学测试结果间的相关性。P<0.05为差异有统计学意义。
2 结果
肝硬化组与对照组左右侧背侧丘脑NAA/Cr、Cho/Cr、mI/Cr和Glx/Cr值差异均无统计学意义(P均>0.05),因此取双侧平均值。与对照组比较,肝硬化组Cho/Cr、mI/Cr减小,Glx/Cr升高,NCT-A完成时间延长、DST得分减少,差异均有统计学意义 (P均<0.001);两组间NAA/Cr差异无统计学意义(P=0.071);见表1。
表1 肝硬化组与对照组间神经心理测试及MRS参数比较(±s,n=28)
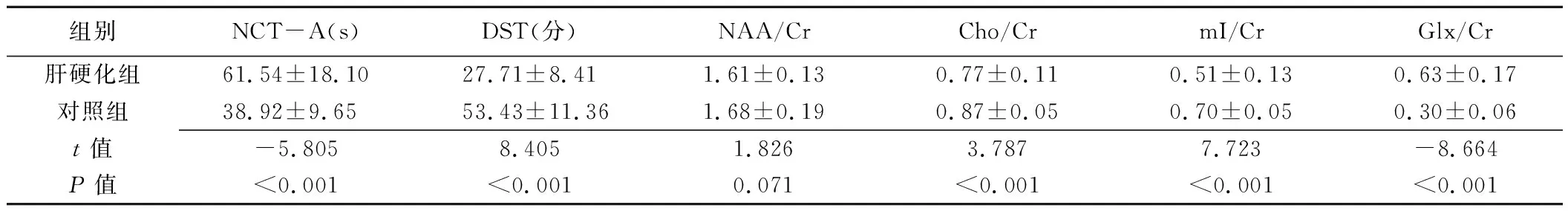
表1 肝硬化组与对照组间神经心理测试及MRS参数比较(±s,n=28)
组别NCT-A(s)DST(分)NAA/CrCho/CrmI/CrGlx/Cr肝硬化组61.54±18.1027.71±8.411.61±0.130.77±0.110.51±0.130.63±0.17对照组38.92±9.6553.43±11.361.68±0.190.87±0.050.70±0.050.30±0.06t值-5.8058.4051.8263.7877.723-8.664P值<0.001<0.0010.071<0.001<0.001<0.001

图1 MRS图像 A.波谱VOI示意图,大方框为VOI范围,红色填充格为选择分析的体素; B.所选体素对应MRS谱线
相关性分析结果显示,肝硬化组患者NCT-A时间与Cho/Cr、mI/Cr呈负相关(r=-0.477,P=0.001;r=-0.695,P<0.001),与Glx/Cr呈正相关(r=0.665,P<0.001);DST得分与Cho/Cr、mI/Cr呈正相关(r=0.478,P=0.001;r=0.632,P<0.001),与Glx/Cr呈负相关(r=-0.572,P<0.001)。
3 讨论
对肝病患者进行神经认知功能评估的主要目的为进行HE尤其是MHE的诊断和疗效评估[4]。本研究中肝硬化组较对照组NCT-A完成时间延长,DST完成个数减少,表明慢性肝硬化患者空间知觉、眼手协调能力减低(NCT-A异常),精细运动速度、视觉-精细动作准确性、注意力下降(DST异常)等,与MHE神经测试结果类似。这些结果提示慢性肝病患者早期即可出现神经功能损伤,而这种神经认知介导障碍、心理反应速度、注意力障碍与基底核—丘脑—皮质环路损伤密切相关[5-6]。基于体素的形态学研究[7]提示慢性肝硬化患者脑灰、白质密度减低,伴有HE病史者程度更重,肝移植后这种异常持续存在。史勇跃等[5]通过结构和静息态MR功能成像技术发现单纯肝硬化患者双侧丘脑局部一致性显著降低;随着病情进展,MHE患者脑灰质结构改变的区域及强度显著增加,特别是丘脑体积显著增大主要表现在MHE组。以上研究均提示背侧丘脑作为脑功能网络连接的重要中转站,其结构和功能的改变在MHE的发生、发展中起着重要作用。
作为最大的间脑结构,背侧丘脑是皮质下的重要结构,内部核团通过丘脑皮质投射和皮质丘脑投射与大脑皮层联系[8],在维持皮层状态及调节皮层对刺激的反应能力方面起着重要作用,因此,导致丘脑结构及功能异常的因素均可能导致患者神经认知及运动功能障碍。本研究肝硬化组患者较对照组背侧丘脑mI/Cr、Cho/Cr减低、Glx/Cr升高,与既往MRS研究[3,9-10]结果类似。对此结果目前较为认可的解释为近年来提出的NH3—谷氨酰胺—低度脑水肿假说[11-12]:血氨增高引起胶质细胞合成谷氨酰胺增加(Glx/Cr增高),细胞渗透压增高和肿胀;为维持内环境稳定,大量水分子进入引起细胞内,mI及Cho作为渗透压调节剂进入细胞外间隙,导致胞内的mI及Cho浓度降低(mI/Cr及Cho/Cr减低)。有学者认为[10]mI/Cr改变更为敏感,mI/Cr减低是检测MHE的敏感指标;而Cho降低出现较晚,且程度存在较明显的个体差异[13-14]。以上可解释本研究中mI/Cr与NCT-A以及DST的相关性较高(r=-0.695、0.632),而Cho/Cr相关性最弱。值得注意的是,张龙江等[15]发现,尽管扣带回MRS改变轻于基底核区(主要为苍白球),但在MRS变化与神经心理学测试结果间相关性更强;而本研究结果提示背侧丘脑MRS改变与NCT-A、DST结果同样具有较好的相关性。
总之,慢性肝炎肝硬化患者背侧丘脑代谢改变引起的结构、功能变化可能在其神经认知障碍中起到重要作用。
[参考文献]
[1] Ferenci P, Lockwood A, Mullen K, et al. Hepatic encephalopathy—definition, nomenclature, diagnosis, and quantification: Final report of the working party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology, 2002,35(3):716-721.
[2] Dhiman RK, Chawla YK. Minimal hepatic encephalopathy. Indian J Gastroenterol, 2009,28(1):5-16.
[3] 李梅,吴利忠,丁小龙,等.轻微肝性脑病的氢质子MR波谱研究.中华放射学杂志,2009,43(11):1125-1130.
[4] 贾林,李兆申.肝性脑病.北京:人民军医出版社,2007:121-151.
[5] 史勇跃,陶冉,游忠岚,等.轻微肝性脑病大脑结构与功能异常MRI表现.中国医学影像技术,2015,31(3):340-346.
[6] 周治明,赵建农.轻微型肝性脑病BOLD-fMRI研究进展.国际医学放射学杂志,2013,36(2):114-117.
[7] Qi R, Zhang LJ, Zhong J, et al. Grey and white matter abnormalities in minimal hepatic encephalopathy: A study combining voxel-based morphometry and tract-based spatial statistics. Eur Radiol, 2013,23(12):3370-3378.
[8] Spahr L, Burkhard PR, Grotzsch H, et al. Clinical significance of basal ganglia alterations at brain MRI and1H MRS in cirrhosis and role in the pathogenesis of hepatic encephalopathy. Metab Brain Dis, 2002,17(4):399-413.
[9] 张金华,孟宪平,冯东侠,等.慢性肝性脑病的磁共振成像及其波谱表现.中国医学影像学杂志,2009,17(3):211-213.
[10] 倪玲,戚荣丰,张龙江,等.轻微型肝性脑病患者脑的3T1H-MRS研究.医学影像学杂志,2012,22(3):330-335.
[11] Zhang LJ, Zhong J, Lu GM. Multimodality MR imaging findings of low-grade brain edema in hepatic encephalopathy. AJNR Am J Neuroradiol, 2013,34(4):707-715.
[12] McPhail MJ, Taylor-Robinson SD. The role of magnetic resonance imaging and spectroscopy in hepatic encephalopathy. Metab Brain Dis, 2010,25(1):65-72.
[13] Singhal A, Nagarajan R, Hinkin CH, et al. Two-dimensional MR spectroscopy of minimal hepatic encephalopathy and neuropsychological correlates in vivo. J Magn Reson Imaging, 2010,32(1):35-43.
[14] 张龙江,尹建忠,祁吉.肝硬化患者脑代谢的磁共振波谱成像研究.临床放射学杂志,2008,27(3):297-302.
[15] 张龙江,尹建忠,祁吉.轻微型肝性脑病的1H-MRS与临床及神经心理学测定的相关性研究.中国医学影像技术,2007,23(5):666-670.
- 中国医学影像技术的其它文章
- Correlation of intraoperative ultrasonography and immunohistochemical markers expression in glioma
- 《中国医学影像技术》杂志2018年征订启事
- Intraoperative ultrasonographic features of craniopharyngioma:Case report
- Portal venous velocity ratios in different degrees of portal vein stenosis following 70% partial hepatectomy of rats
- CT morphological characteristics of plantar nerves and their significances in diabetic foot
- 3.0T MR three-dimensional time-of-flight and fast imaging employing steady state acquisition sequences in pre-operative evaluation on spatial relationship among trigeminal nerve, facial nerve and peripheral vessels

