丁苯酞对慢性脑缺血大鼠海马iNOS及MG表达的影响
冯 涛 杨霄鹏
1)南阳医学高等专科学校第一附属医院神经内科,河南 南阳 473058 2)郑州大学第二附属医院神经内科,河南 郑州 450014
随着老龄社会的到来,慢性脑缺血(chronic cerebral ischemia,CCI)伴发的Alzheimer’s病(Alzheimer’s disease,AD)、血管性痴呆(vascular dementia,VD)等多种脑血管疾病受到社会的广泛关注,已成为社会问题。近些年来对慢性脑缺血导致的脑损伤机制及防治研究较少。在慢性脑缺血的病理过程中诱导型一氧化氮合酶(iNOS)表达增多,加速钠离子内流,是脑损伤的重要机制[1]。小胶质细胞(MG)是颅内重要的免疫炎症细胞,参与慢性脑缺血病理损伤过程。本研究采用双侧大鼠颈总动脉永久结扎的方法制作大鼠慢性脑缺血模型,观察慢性脑缺血对大鼠学习记忆能力、海马区iNOS、OX42表达及神经元数目及给予丁苯酞干预后对上述指标的影响,探讨丁苯酞的脑保护机制。
1 材料
1.1动物及分组挑选雄性健康SD大鼠48只,清洁级,体质量(210±20)g,郑州大学医学院实验动物中心供。实验SD大鼠在造慢性脑缺血模型前3d带回实验室。避免刺激,实验室温度保持21~26 ℃,湿度适宜。自由进食水。随机将60只SD大鼠均分4组:正常大鼠组为A组、假模型组为B组、模型组为C组、丁苯酞干预组为D组,每组12只,造慢性脑缺血模型前12 h禁食水。
1.2药物与试剂iNOS抗体、Ox42(MG的标志)抗体、SP9001试剂盒、DAB试剂盒购于北京中杉生物工程公司。多聚甲醛由天津市科密欧化学试剂有限公司提供。磷酸二氢钠由汕头市光华化学厂提供。Y型电迷宫(张家港市生物医学仪器厂)。采用德国Lecia显微照像系统采集图像,应用日本奥林巴斯光学显微镜。丁苯酞软胶囊(恩必普,石药集团恩必普药业有限公司),规格:0.1 g/丸,生产批号:H20050299。
2 方法
2.1制备模型采用永久性结扎双侧颈总动脉建立慢性脑缺血大鼠模型[2]。采用10%水合氯醛(3 mL·kg-1)腹腔注射麻醉。造模前常规局部备皮、消毒,颈部正中切口,切开皮肤,切口约1.6 cm,分离皮下组织,可见双侧颈总动脉伴行迷走神经,暴露双侧颈总动脉,将其与迷走神经钝性分离,将双侧颈总动脉近心端及远心端分别结扎后在结扎之间断离双侧颈总动脉,局部止血,缝合皮肤,如大鼠自然醒来说明慢性脑缺血模型成功,模型失败的大鼠等量补齐。假模型组大鼠除不结扎断离双侧颈总动脉外,同模型组。
2.2动物处理正常大鼠组、假手术及模型组大鼠给予生理盐水2 mL灌胃,1次/d。丁苯酞干预组在造模型成功后给予丁苯酞软胶囊0.2 g·kg-1治疗12周。各组大鼠实验结束用10%水合氯醛350 mg/kg腹腔注射深度麻醉,从左心室加压300 mL生理盐水快速灌洗、灌注,4%多聚甲醛溶液心内灌注固定60 min后取脑,4%多聚甲醛液固定24 h,脱水,浸蜡,石蜡包埋,制石蜡冠状切片(厚度4 μm)。
2.3指标检测
2.3.1 Y电迷宫测试:学习记忆能力测试方法采用Y电迷宫方法,将大鼠置入安静暗室内进行主动逃离学习记忆能力测试。Y电迷宫内有无电流刺激的安全区和有50~70 V交流电的刺激区,无规则反复变换安全区和电刺激区,观察大鼠逃离电刺激区进入安全区的能力。以大鼠顺利到达安全区的电击次数为学习成绩,电击次数越少表明学习记忆能力强。
2.3.2 免疫组织化学染色(SP法)步骤:采用二甲苯对石蜡冠状切片进行脱蜡2次,酒精脱蜡2次,蒸馏水清洗2次,柠檬酸修复液高温修复,低温维持,室温冷却。采用3% H2O2去离子水孵育,PBS液冲洗后滴加山羊血清封闭液,采用内源性生物素进行封闭。滴加一抗OX42抗体(1∶100稀释)4 ℃过夜。室温复温,PBS液冲洗,滴生物素二抗工作液,PBS液冲洗后滴辣根酶液,孵育,PBS液冲洗后神经元呈蓝色剂,苏木素复染,水冲洗后混合液脱色,采用低到高浓度酒精脱水、封片。高倍镜(400×)下对大鼠海马区iNOS、MG进行观测,阳性细胞呈现棕黄色染色改变,采集图像,分析阳性区平均积分光密度值。
2.3.3 尼氏染色方法:石蜡冠状切片先脱蜡,采用1%甲苯胺蓝在室温10 min后90%乙醇脱色30 s,无水乙醇脱水,二甲苯透明,最后中性树胶封片,神经元呈蓝色为尼氏染色阳性细胞,高倍镜(400×)下观测计数海马区神经元阳性细胞。
3 结果
3.1大鼠Y电迷宫测试A、B组大鼠精神正常,反应灵敏,电迷宫训练达标次数正常。C、D组大鼠表现为精神差,萎靡不振,反应迟钝,电迷宫训练达标次数明显多于A、B组(P<0.01)。D组大鼠电迷宫训练达标次数明显少于C组(P<0.01)。见表1。
3.2大鼠海马区iNOS、OX42的表达A、B组大鼠海马区iNOS有表达不明显,C、D组大鼠海马区iNOS表达明显增多,多于A、B组(P<0.01)。D组大鼠海马区iNOS表达较C组明显下降(P<0.01)。A、B组大鼠海马区OX42有表达不明显,C、D组大鼠海马区OX42表达增多,明显高于A、B组(P<0.01)。D组大鼠海马区OX42表达较C组明显下降(P<0.01)。见表2。
表1 4组大鼠Y电迷宫测试±s,n=12)
注:与A、B相比,1)P<0.01;与C组相比,2)P<0.01
表2 4组大鼠海马区iNOS、OX42表达±s,n=12)
注:与A、B相比,1)P<0.01;与C组相比,2)P<0.01
3.3大鼠海马区神经元计数A、B组大鼠海马区经尼氏染色呈阳性神经元计数(70.89±4.28个),如图1、2所示。C组大鼠海马区经尼氏染色呈阳性神经元计数(19.17±3.04个),如图3所示。D组大鼠海马区经尼氏染色呈阳性神经元计数(38.12±4.11个),如图4所示。C、D组大鼠海马区神经元计数明显低于A、B组(P<0.01),D组大鼠海马区神经元计数较C组明显增多(P<0.01)。见表4。
表3 4组大鼠海马区神经元尼氏染色±s,n=12,个/400倍视野)
注:与A、B相比,1)P<0.01;与C组相比,2)P<0.01
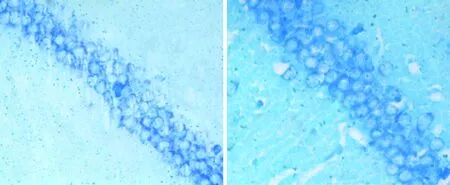
图1 A组大鼠海马区神经元尼氏染色(×400) 图2 B组大鼠海马区神经元尼氏染色(×400)
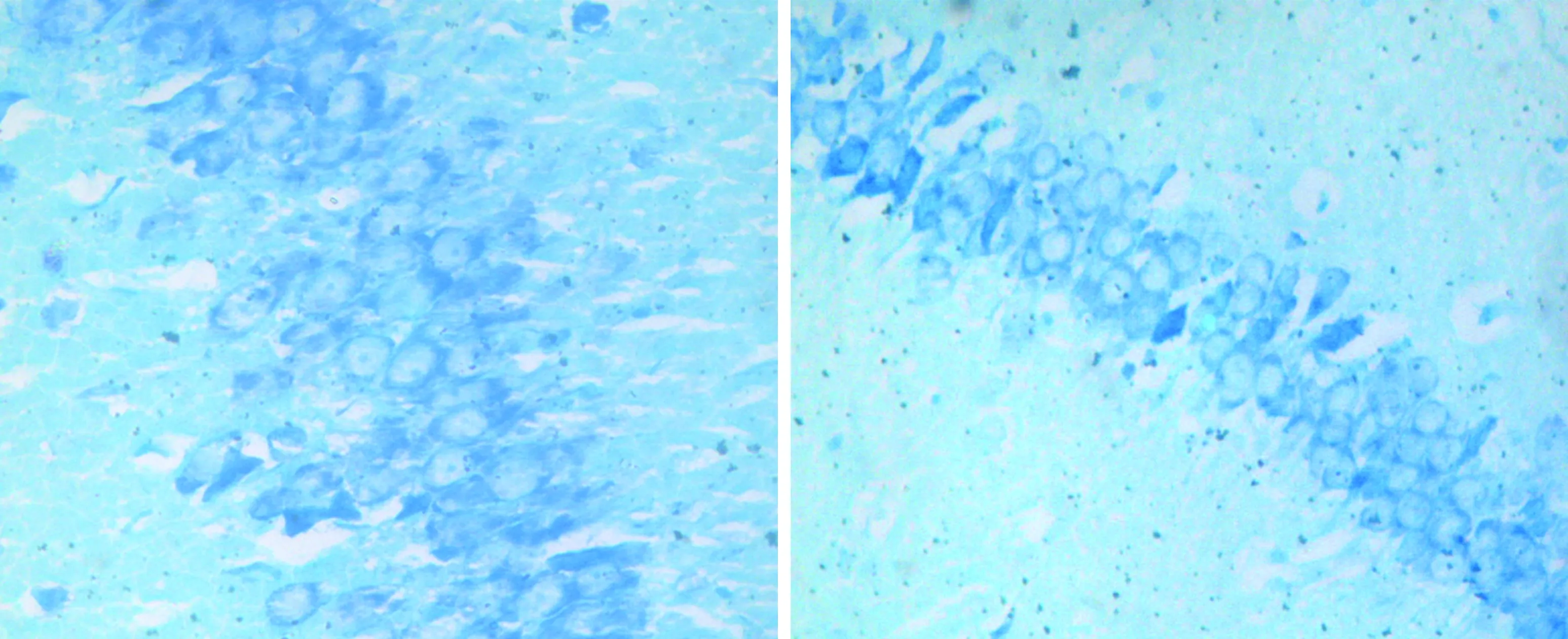
图3 C组大鼠海马区神经元尼氏染色(×400) 图4 D组大鼠海马区神经元尼氏染色(×400)
4 讨论
慢性脑缺血是慢性脑白质变性和老年性痴呆的重要病理生理因素[3],抑郁是慢性脑缺血后常见并发症,国内报道发生率20%~40%[4],国外报道发生率40%~60%[5]。长期慢性脑缺血抑制神经元胞浆在细胞内定向流动,降低新陈代谢,导致颅内血液和淋巴循环障碍,蛋白合成率下降,抑制神经再生等[6],慢性脑缺血导致过度炎症免疫反应加剧氧自由基生成,兴奋性氨基酸毒性作用及细胞内钙离子超载等病理损伤等过程[7-8]。
iNOS是存在人体巨噬细胞内一种重要的合酶[9],为非钙离子依赖性,一般生理状态不表达,在慢性脑缺血损伤时,iNOS逐渐表达,主要分布在神经细胞、炎性细胞、神经胶质细胞,颅内海马部位表达最明显[10]。一旦诱导合成,就持续大量产生一氧化氮(NO)。NO具有扩张脑血管、调节血压及脑血流等作用,大量产生的NO与阴离子结合形成过氧化亚硝酸盐(ONOO-)和羟自由基(OH-),导致大量钠离子和氯离子转移至细胞内,发生神经细胞水肿,抑制线粒体呼吸,损伤细胞膜,诱导缺血区神经元凋亡[10-11]。iNOS是慢性脑缺血产生过量NO的基础,是脑慢性缺血损伤的一个重要原因。文献[12]报道,激活的MG是iNOS的主要来源。
MG广泛分布在颅内,兼有神经保护和神经毒性免疫细胞,是炎症免疫的标志[13-18]。慢性脑缺血时MG大量激活,引起血管内皮细胞通透性增高,加重缺血区缺血缺氧,导致更多的氧自由基、缩血管物质生成等,使缺血坏死区范围扩大[19-22]。所以,抑制慢性脑缺血过程中炎症反应,抑制MG过度激活,可以减少iNOS过度表达,保护神经元,减轻慢性脑缺血损伤程度,成为临床上治疗慢性脑缺血新的治疗方法[23-28]。颅内海马区血流丰富,对缺血缺氧耐受力差,是慢性脑缺血最敏感区,为MG主要分布区,为临床观察慢性脑缺血的最佳部位[29-35]。同型半胱氨酸已成为慢性脑缺血的独立危险因素,在慢性脑缺血早期血清同型半胱氨酸水平会明显升高,与MG水平呈负相关性,补充叶酸、维生素B6和维生素B12可安全降低同型半胱氨酸水平[17],可以抑制MG的过度激活。
丁苯酞是在我国第一个拥有自主知识产权治疗缺血性脑血管病的药物,已广泛应用到缺血性脑卒中的治疗中,取得良好疗效。丁苯酞具有明显的抗缺血、减少脑缺血梗死面积、减轻脑水肿程度,同时具有开放脑缺血区域的微循环,加速侧支循环形成、保护线粒体及抗血小板聚集等作用[18-22,36-40]。同时,丁苯酞可以降低血清Cys C水平,减轻血管内皮损伤程度[23-24,41-45],抑制兴奋性氨基酸的大量生成,减少钙离子超载及凋亡基因的大量产生等相关[25-29,46-51]。
本研究显示,丁苯酞能明显提高大鼠的学习记忆能力,抑制海马区iNOS、MG的过度表达,减少神经毒性因子分泌,抑制慢性脑缺氧大鼠海马区神经细胞的过度凋亡,具有明显的脑保护作用,为临床上应用丁苯酞提供理论依据。本研究还存在对动脉模型观察时间短,样本量偏少,不能完全反映慢性脑缺血过程中各项指标的演变过程;另外,海马区比较弥散,故取材定位缺血区与实际缺血可能有差距等不足之处。
[1] 冯慧,程秋凤,贺燕,等.脑缺血耐受过程中NO作用机制的研究进展[J].中国实用神经疾病杂志,2012,15(17):85-86.
[2] 王耀,赵香玉,李新娅,等.Militarine改善慢性脑缺血大鼠认知功能障碍及白质损伤的研究[J].药学学报,2016,51(5):738-742.
[3] SHETH S A,SANOSSIAN N,HAO Q,et al.Collateral flow as causative of good outcomes in endovascular stroke therapy[J].J NeuroInterv Surg,2016,8(1):2-7.
[4] 张志珺.专题综述:卒中后抑郁[J].中国卒中杂志,2014,9(1):37.
[5] 白素民,李永浩.脑卒中急性期患者发生卒中后抑郁及焦虑的相关因素研究[J].中国实用神经疾病杂志,2016,19(17):85-86.
[6] 李张霞,谈跃.颈动脉盗血综合征的发病机制及临床特点研究[J].国际神经病学神经外科学杂志,2017,44(2):203-206.
[7] 吴琼,刘剑刚,刘美霞,等.血管性痴呆患者红细胞流变性变化特点和中药防治的研究[J].中国实用神经疾病杂志,2017,20(18):114-116.
[8] 彭晓燕,万婷,张丽丹,等.血管性痴呆大鼠模型的研究概述[J].中华中医药学刊,2018,36(2):311-314.
[9] 赵松峰,张亚玲,张晓,等.原花青素对D-半乳糖致衰老大鼠小脑的保护作用[J].中国实用神经疾病杂志,2016,19(19):77-79.
[10] ROY CHOUDHURY G,RYOU M G,POTEET E,et al.Involvement of p38 MAPK in reactive astrogliosis induced by ischemic stroke[J].Brain Res,2014,1 551:45-58.
[11] 闫云峰,杨劲松.盐酸多奈哌齐对血管性痴呆模型大鼠大脑NO及iNOS的影响[J].中国实用神经疾病杂志,2015,18(5):70-71.
[12] 李欣,赵振寰,王晨静,等.神经型一氧化氮合酶羧基末端结合配体CAPON的研究进展[J].神经解剖学杂志,2016,32(4):545-548.
[13] 宋艳芳,林青,周子鑫,等.趋化因子CX3CL1对Β-淀粉样蛋白1-42激活的小胶质细胞IL-1Β、TNF-α和NO表达的影响[J].免疫学杂志,2016,32(12):1 101-1 104.
[14] LIU Y,ZENG X N,HUI Y J,et al.Activation of α7 nicotinic acetylcholine receptors protects astrocytes against oxidative stress-induced apoptosis:Implications for Parkinson's disease[J].Neuropharmacology,2015,91:87-96.
[15] 曹翔,金岳心子,李飞,等.LX007减少脂多糖介导的小胶质细胞内活性氧生成的机制研究[J].中风与神经疾病杂志,2018,35(1):10-13.
[16] 尉杰忠,谷青芳,闫玉清,等.法舒地尔通过抑制脑内小胶质细胞活化并促进其M2极化而改善APP/PS1双转基因小鼠认知功能[J].细胞与分子免疫学杂志,2017,33(12):1 585-1 593.
[17] 李军,娄季宇,杨霄鹏.雌激素对大鼠脑缺血再灌注损伤脑组织NF-κBi、NOS表达和细胞凋亡的影响[J].中国实用神经疾病杂志,2009,12(18):15-16.
[18] 陈轩,王永红,周永俪,等.早期营养不良上调成年期SD大鼠海马小胶质细胞活化水平[J].重庆医科大学学报,2017,42(5):504-509.
[19] MADORE C,NADJAR A,DELPECH J C.Nutritional n-3 PUFAs deficiency during perinatal periods alters brain innate immune system and neuronal plasticity-associated genes[J].Brain Behav Immun,2014,41:22-31.
[20] BhaskarK,MaphisN,Xu G X,et al.Microglial derived tumor necrosis factor-α drives Alzheimer's disease-related neuronal cell cycle events[J].Neurobiol Dis,2014,62:273-285.
[21] 李茜,周云涛,田卫,等.同型半胱氨酸的代谢与缺血性卒中的相互关系[J].中国卒中杂志,2014,9(9):797-802.
[22] 瞿国英,陈一可.老年高血压患者血清同型半胱氨酸水平的变化及叶酸治疗的作用[J].中国医院药学杂志,2018,38(5):520-522.
[23] MITCHELL A B,COLE J W,MCARDLE P F.Obesity Increases Risk of Ischemic Stroke in Young Adults[J].Stroke,2015,46(6):1 690-1 692.
[24] 肖林婷,周辉,陈聪.丁苯酞注射液治疗进展性脑梗死的临床研究[J].中国临床药理学杂志,2018,34(5):514-517.
[25] 谷晓林,刘琳,亓晓丽.补肾益智汤联合丁基苯酞对老年血管性痴呆血液流变学及自由基损伤的影响[J].中华中医药学刊,2017,35(12):3 217-3 220.
[26] 尹刘杰,李玉生,许予明.降粘抗栓片联合依达拉奉治疗脑梗死临床观察[J].中国实用神经疾病杂志,2017,20(17):17-20.
[27] YITSHAK SADE M,NOVACK V,IFERGANE G,et al.Air Pollution and Ischemic Stroke Among Young Adults[J].Stroke,2015,46(12):3 348-3 353.
[28] KIM J H,HONG K W,BAE S S,et al.Probucol plus cilostazol attenuate hypercholesterolemiainduced exacerbationinischemic brain injury via anti-inflammatory effects[J].Int J Mol Med,2014,34(3):687-694.
[29] 王慧敏,李建设,李静静.丁苯酞氯化钠注射液治疗前循环进展性脑梗死的疗效观察[J].中国实用神经疾病杂志,2016,19(16):133.
[30] WANG C Y,XU Y,WANG X,et al.Dl-3-n-Butylphthalide Inhibits NLRP3 Inflammasome and Mitigates Alzheimer's-Like Pathology via Nrf2-TXNIP-TrX Axis[J].Antioxid Redox Signal,2018 Apr 25.doi:10.1089/ars.2017.7440.
[31] ZHAO W,LUO C,WANG J,et al.3-N-butylphthalide improves neuronal morphology after chronic cerebral ischemia[J].Neural Regen Res,2014,9(7):719-726.doi:10.4103/1673-5374.131576.
[32] ZHAO W,XU S,PENG Y,et al.Potassium 2-(1-hydroxypentyl)-benzoate improves learning and memory deficits in chronic cerebral hypoperfused rats[J].Neurosci Lett,2013,541:155-160.doi:10.1016/j.neulet.2013.01.053.
[33] WEI W,ZHANG W,HUANG Y,et al.The therapeutic effect of (DL)-3-n-butylphthalide in rats with chronic cerebral hypoperfusion through downregulation of amyloid precursor protein and matrix metalloproteinase-2[J].J Int Med Res,2012,40(3):967-975.
[34] XU J,WANG Y,LI N,et al.L-3-n-butylphthalide improves cognitive deficits in rats with chronic cerebral ischemia[J].Neuropharmacology,2012,62(7):2 424-2 429.doi:10.1016/j.neuropharm.2012.02.014.
[35] ZHANG L,LÜ L,CHAN W M,et al.Effects of DL-3-n-butylphthalide on vascular dementia and angiogenesis[J].Neurochem Res,2012,37(5):911-919.doi:10.1007/s11064-011-0663-3.
[36] PENG Y,XING C,LEMERE C A,et al.l-3-n-Butylphthalide ameliorates beta-amyloid-induced neuronal toxicity in cultured neuronal cells[J].Neurosci Lett,2008,434(2):224-229.doi:10.1016/j.neulet.2008.01.080.
[37] PENG Y,XU S,CHEN G,et al.l-3-n-Butylphthalide improves cognitive impairment induced by chronic cerebral hypoperfusion in rats[J].J Pharmacol Exp Ther,2007,321(3):902-910.
[38] WON J S,ANNAMALAI B,CHOI S,et al.S-nitrosoglutathione reduces tau hyper-phosphorylation and provides neuroprotection in rat model of chronic cerebral hypoperfusion[J].Brain Res,2015,1624:359-369.doi:10.1016/j.brainres.2015.07.057.
[39] ZHAO B,QUAN H,MA T,et al.4,4'-Diisothiocyanostilbene-2,2'-disulfonic Acid (DIDS) Ameliorates Ischemia-Hypoxia-Induced White Matter Damage in Neonatal Rats through Inhibition of the Voltage-Gated Chloride Channel ClC-2[J].Int J Mol Sci,2015,16(5):10 457-10 469.doi:10.3390/ijms160510457.
[40] LEE K F,CHEN J H,TENG C C,et al.Protective effects of Hericium erinaceus mycelium and its isolated erinacine A against ischemia-injury-induced neuronal cell death via the inhibition of iNOS/p38 MAPK and nitrotyrosine[J].Int J Mol Sci,2014,15(9):15 073-15 089.doi:10.3390/ijms150915073.
[41] PARMENTIER-BATTEUR S,BOHME G A,LEROUET D,et al.Antisense oligodeoxynucleotide to inducible nitric oxide synthase protects against transient focal cerebral ischemia-induced brain injury[J].J Cereb Blood Flow Metab,2001,21(1):15-21.
[42] HAYNES R L,FOLKERTH R D,TRACHTENBERG F L,et al.Nitrosative stress and inducible nitric oxide synthase expression in periventricular leukomalacia[J].Acta Neuropathol,2009,118(3):391-399.doi:10.1007/s00401-009-0540-1.
[43] WIDENKA D C,MEDELE R J,STUMMER W,et al.Inducible nitric oxide synthase:a possible key factor in the pathogenesis of chronic vasospasm after experi-mental subarachnoid hemorrhage[J].J Neurosurg,1999,90(6):1 098-1 104.
[44] CHABRIER P E,DEMERLÉ-PALLARDY C,AUGUET M.Nitric oxide synthases:targets for therapeutic strategies in neurological diseases[J].Cell Mol Life Sci,1999,55(8/9):1 029-1 035.
[45] CHIEN C H,HWU C M,LIOU T L,et al.Inducible nitric oxide synthase expression and plasma bilirubin changes in rats under intermittent hypoxia treatment[J].Chin J Physiol,2006,49(5):275-280.
[46] AMIN-HANJANI S,STAGLIANO N E,YAMADA M,et al.Mevastatin,an HMG-CoA reductase inhibitor,reduces stroke damage and upregulates endothelial nitric oxide synthase in mice[J].Stroke,2001,32(4):980-986.
[47] CHEN H I,CHANG H R,WU C Y,et al.Nitric oxide in the cardiovascular and pulmonary circulation-a brief review of literatures and historical landmarks[J].Chin J Physiol,2007,50(2):43-50.
[48] JIN Q,CHENG J,LIU Y,et al.Improvement of functional recovery by chronic metformin treatment is associated with enhanced alternative activation of microglia/macrophages and increased angiogenesis and neurogenesis following experimental stroke[J].Brain Behav Immun,2014,40:131-142.doi:10.1016/j.bbi.2014.03.003.
[49] SU W,HOPKINS S,NESSER N K,et al.The p53 transcription factor modulates microglia behavior through microRNA-dependent regulation of c-Maf[J].J Immunol,2014,192(1):358-366.doi:10.4049/jimmunol.1301397.
[50] QU J,ZHOU Q,DU Y,et al.Rutin protects against cognitive deficits and brain damage in rats with chronic cerebral hypoperfusion[J].Br J Pharmacol,2014,171(15):3 702-3 715.doi:10.1111/bph.12725.
[51] NARANTUYA D,NAGAI A,SHEIKH A M,et al.Microglia transplantation attenuates white matter injury in rat chronic ischemia model via matrix metalloproteinase-2 inhibition[J].Brain Res,2010,1316:145-152.doi:10.1016/j.brainres.2009.12.043.

