不同树叶凋落物对人参土壤理化性质及微生物群落结构的影响
孙 海,王秋霞,张春阁,李 乐,刘政波,刘 宁,邵 财,张亚玉,*,严 珺,李跃雄
1 中国农业科学院特产研究所, 长春 130112 2 上海上药神象健康药业有限公司, 上海 200336
人参(PanaxginsengC.A. meyer)为五加科多年生草本植物,是大宗名贵中药材。目前主要有农田栽培和林下护育两种生产模式,而林下护育人参是一种仿野生护育的高品质人参,具有人为干扰少、生长周期长的特点使其生长若干年后具备一定的野山参外部形态和内在品质特征,2015版药典正式将林下护育人参定义为“林下山参”。研究发现林下山参存苗率、红皮病发病率、根的形态建成及品质形成与其生长的森林生态环境条件密不可分[1- 4]。
土壤特性、伴生树种、海拔高度、坡度等多个因素影响人参皂苷积累和参根形态结构建成。土壤特性直接影响人参生长发育,而伴生树种是影响土壤的重要因素,这是因为(1):树种凋落物是森林土壤有机质和养分的主要补给途径,同时也是植物——土壤间碳氮循环的重要途径[5- 6];凋落物作为土壤有机质地上部分的主要来源,其输入的数量和质量变化可能改变土壤中碳的积累或流失状况,不同生产模式下人参土壤肥力研究表明野山参土壤有机质含量是农田栽参土壤的10倍以上[7- 9],且在大多数生态系统内,由土壤供给植物所需要的养分中超过90%的氮和磷以及超过60%的其他矿质元素均来自于凋落物的分解[10]。(2)不同的树种凋落物中含有不同的碳源和氮源,驱使土壤微生物集群定向进化,进而改变土壤肥力[11]。如北方针叶林森林生态系统,土壤矿化层和凋落物重含有大量不易被微生物利用的木质素和腐殖酸,由于碳源的影响,土壤微生物集群以分解复杂结构有机碳为主[12]。另外,不同凋落物土壤pH值和C/N是影响微生物集群定向进化的重要因素[13]。许多研究已经证实树种凋落物对于增加土壤中微生物量碳氮、提高土壤养分、改变土壤微环境具有重要意义[14-15]。
大量研究表明树种凋落物影响土壤养分释放、生物地球化学过程以及微生物生态组成[16-17]。土壤微生物群落是陆地生态系统的重要生物成分,其结构和功能多样性与土壤功能关系密切,在土壤生态系统中扮演重要角色,如氮循环、有机质矿质化、土壤有机碳的保存和释放,以及对环境扰动的响应[18-20]。特定的土壤微生物群落结构对于稳定土壤结构和维持土壤生态功能至关重要[21],鉴于土壤微生物对于土壤生态系统物质循环的重要性,目前农田栽参连作障碍、林下山参土壤抗逆境胁迫能力以及林下山参根形态建成等方面研究均聚焦在土壤微生物多样性[22-23]。利用磷脂脂肪酸方法研究发现林下山参土壤中微生物生物量(670.64 nmol/g)远远大于农田栽参土壤(266.80 nmol/g),其中林下山参土壤中有益微生物菌群(放线菌)含量是农田栽参的3.86倍;同时在林下山参土壤中发现代表抗逆性微生物蓝细菌(18:2ω6),而农田栽参土壤未检出[24]。由此可见,林下山参能够健康在同一地点生长十几年甚至几十年不感病与其土壤微生物群落结构密切相关。
人参品质形成受其生长的土壤环境影响,而林下山参品质优劣往往与其护育的森林生态环境密切相关。选林是林下山参护育第一步,也是林下山参护育成败所在。为了进一步研究不同树叶凋落物对土壤性质及微生物群落结构组成的影响,本研究以添加不同树叶凋落物人参土壤为研究对象,利用16S 和ITS测序技术研究不同土壤凋落物对人参土壤养分、微生物群落结构组成的影响,旨在为林下山参护育选择林地和农田栽参土壤改良提供理论科学依据和理论指导。
1 材料与方法
1.1 盆栽土壤和树叶的收集
盆栽土壤和树叶收集地点选在林下山参主产区吉林省抚松县楞场村吴杰林下山参护育基地(127°75′78″E, 42°81′12″N),收集时间为2014年10月。盆栽土壤取至基地旁边废弃3 a的农田土,收集20 cm深土壤并过0.9 mm筛备用,供试土壤pH 5.89,有机碳为20.89 g/kg,碱解氮161.32 mg/kg,有效磷25.83 mg/kg,速效钾为220.54 mg/kg。同时在林下山参基地收集色木槭、赤松、胡桃楸、紫椴和蒙古栎的落叶,收集到的树叶在35 ℃下烘至恒重并过0.01 mm筛备用,不同树叶凋落物的各元素含量见表1。
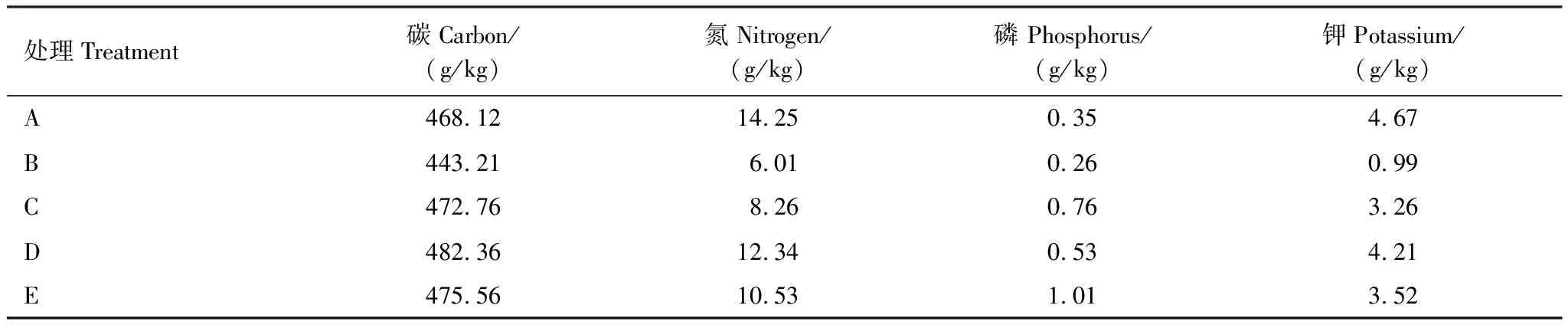
表1 供试树叶凋落物各元素含量
色木槭Acermono. Maxim. var. mono;赤松PinusdensifloraSieb. et Zucc;胡桃楸JuglansmandshuricaMaxim;紫椴TiliaamurensisRupr.; 蒙古栎QuercusmongolicaFisch. ex Ledeb
1.2 实验设计及土壤样品准备
盆栽试验按照6个处理3次重复,采用完全随机区组方法设计,实验于2013年10月布置在中国农业科学院特产研究所。树叶添加量按照张新平[25]调查方法,连续3 a调查吴杰林下山参基地单位面积落叶量,最终确定盆栽土壤树叶加入量为5.0 g/3.5 kg(树叶/干土),本试验6个处理分别为:A:色木槭Acermono. Maxim. var. mono(5.0 g)、B:赤松PinusdensifloraSieb. et Zucc.(5.0 g)、C:胡桃楸JuglansmandshuricaMaxim.(5.0 g)、D:紫椴TiliaamurensisRupr.(5.0 g)、E:蒙古栎QuercusmongolicaFisch. ex Ledeb.(5.0 g)、F:对照(不添加树叶凋落物),其中色木槭、胡桃楸、紫椴和蒙古栎为阔叶林树种,赤松为针叶林树种。不同树叶凋落物风干后,粉碎过60目筛后与土壤充分混匀作为供试土壤,挑选大小一致的3 a生人参苗5株种植在黑色的PVC营养钵里(直径为120 mm,高度为180 mm),每个营养钵作为一个重复。盆栽温度在17—28 ℃之间,相对湿度在70%—80%之间,所有的处理每周浇一次水,每次每盆1 L水。
2014年3月盆栽人参一个生育期结束,收集每株人参根区20 g土壤,并将每盆中5株人参根区土壤混合作为一个重复。所有处理土壤样品过2.0 mm筛,一部分自然风干用作土壤理化分析,另一部分转移至-80 °C冰箱中用作DNA提取。
1.3 测定指标及方法
土壤pH值按照土水比1∶2.5比例,采用梅特勒SK 220 pH计测定,土壤有机碳、全氮利用德国产元素分析Vario EL Ⅲ测定[26],碱解氮采用培养皿扩散法测定,速效磷采用碳酸氢钠浸提-钼锑抗比色测定,有效钾采用乙酸铵浸提-火焰光度法测定,具体测定方法参见土壤农化分析[27];土壤微生物碳和氮利用氯仿熏蒸-硫酸钾浸提法[28],利用总有机碳分析仪(Vario TOC,德国)测定提取液中有机碳含量,用连续流动分析仪(AA3,德国) 测定总氮含量。测定结果分别乘以校正系数KEC 0.45和KEN 0.54,即为土壤中微生物量碳氮含量。
1.4 DNA提取和扩增
DNA提取:准确称取0.1 g土样,按照MoBio强力土壤微生物DNA提取试剂盒(Power SoilTM DNA IslationKit, MoBio, USA)说明书步骤,分别提取不同树叶处理的3个重复土样总DNA。经1%琼脂糖凝胶电泳测定DNA完整性、Mini Dorp测定DNA纯度和浓度。提取的DNA于-20 ℃保存、备用。
扩增:细菌和真菌核糖体编码基因相应区段的扩增及测序服务由诺禾致源生物信息公司完成。细菌多样性的测定参考Caporaso等[29]的方法,扩增细菌16S rDNA V4区段,引物为515F(5′-GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)。真菌多样性采用ITS1区段进行测序分析。引物为ITS5- 1737F (GGAAGTAAAAGTCGTAACAAGG)。DNA扩增条件为98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸60 s,30个循环,72 ℃延伸5 min。测序采用Illumina MiSeq平台。
1.5 数据统计和分析
所测得原始序列截去Barcode序列和引物序列后,经FLASH拼接获得原始 Tags数据。原始Tags经QIIME过滤处理获得高质量Tags 数据(CleanTags),并与数据库进行比对检测嵌合体序列,最终获得有效数据(Effective Tags)。以97%相似性为依据,利用UPARSE pipeline软件(V7.0.1001)将各序列聚类成为OTUs。为获得土壤样品中微生物物种的多样性信息,使用cluster软件对所得序列进行聚类,并利用RDP classifier(V2.2)软件与数据库进行物种注释,统计每个样品在各分类水平上的构成。
相关性分析采用SAS 9.0软件处理,图片利用Excel 2013和CANOCO 5.0制作。
2 结果与分析
2.1 土壤性质
不同树叶处理的3年生人参经过一个生育期后,土壤基础理化性质如表2。添加树叶处理的土壤(处理A、B、C、D和E)pH值均高于对照(F)土壤pH值5.91(P<0.05)。不同处理下土壤容重由对照0.96 g/cm3分别降低至处理A 0.90 g/cm3、处理C 0.95 g/cm3、处理D 0.94 g/cm3及处理E 0.95 g/cm3。添加不同树叶后土壤有机碳和全氮含量变化范围分别为20.20—28.90 g/kg和2.20—4.11 g/kg。不同树叶处理C/N显著低于对照(P<0.05),而微生物量碳氮、速效氮磷含量显著增加,其中处理A、B和C土壤微生物量碳含量高于处理D、E,处理E中微生物量氮含量最高,处理A、D、C、B中微生物量氮含量依次降低,但均显著高于对照(F)(P<0.05)。
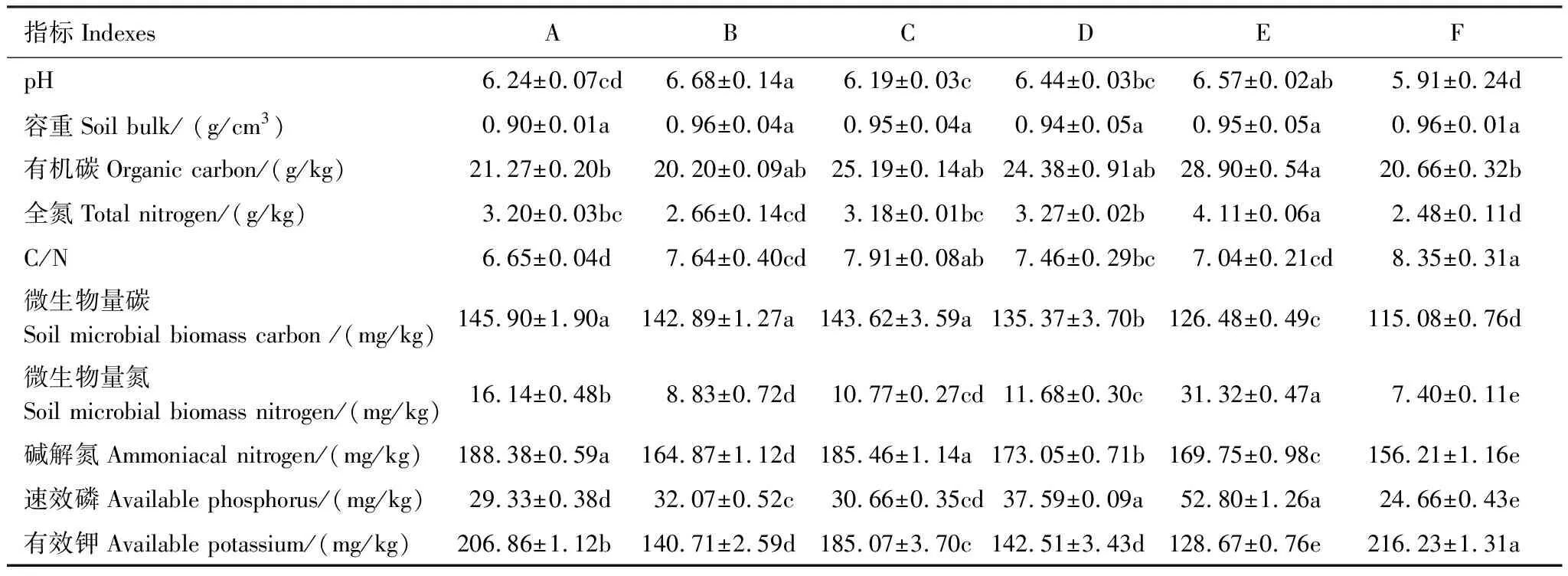
表2 土壤基础理化性质
色木槭Acermono. Maxim. var. mono;赤松PinusdensifloraSieb. et Zucc;胡桃楸JuglansmandshuricaMaxim;紫椴TiliaamurensisRupr.; 蒙古栎QuercusmongolicaFisch. ex Ledeb; F:对照; 表中数值为平均值± 标准误 (n=3),同一行不同小写字母表示不同处理在0.05水平下达到显著差异水平
2.2 测序数据的基本分析
以不同树叶处理的18个人参土壤样品为研究对象,16S rDNA测序得到1478922个reads,而ITS1测序得到1250222个reads。以97%相似性为依据,过滤处理获得高质量序列,其中16S rDNA分析共得到1367082条序列,单个土壤样品中变化范围为从29572条至236044条,而ITS1分析中共得到761544条序列,单个土壤样品变化范围从22725条至129253条,以上序列被保留用作进一步分析。所有样品16S rDNA测序一共得到6064个 OTUs,不同样品OTU数目变化范围为2890至4750,ITS1测序一共得到1990个OTUs,不同样品OTU数目变化范围为480至1370。
在16S rDNA所有序列中,其中27342条(2%)为没有分类的序列,其余的序列在门的水平上由大到小依次为Protecbacteria(41%)、Acidobacteria(18%)、Actinobacteria(14%)、Gemmatimonadetes(8%)、Chloroflexi(5%)、Crenarchaeota(3%)、Nitrospirae(3%)、Firmicutes(2%)、Verrucomicrobia(2%)及Bacteroidetes(2%)(图1a)。在纲的水平共鉴定117纲,大于1%的序列共19个,从大到小依次为Alphaproteobacteria(18.07%,13.99%—21.03%)、Acidobacteria- 6(18.07%,9.53%—12.35%)、Betaproteobacteria(9.11%,8.56%—9.49%)、Deltaproteobacteria(7.69%,7.11%—7.99)、Actinobacteria(6.72%,6.58%—7.66%)、Gammaproteobacteria(5.90%,5.38%—6.48%)、Gemmatimonadetes(4.68%,4.21%—5.51%)、Acidimicrobiia(3.23%,2.94%—3.57%)、Chloracidobacteria(2.97%,2.71%—3.36%)、Thaumarchaeota(2.88%,2.25%—3.73%)、Gemm- 1(2.79%,2.57%—3.15%)、Nitrospira(2.65%,2.33%—2.85%)、Thermoleophilia(2.31%,2.00%—2.59%)、Ellin6529(2.15%,1.97%—2.29%)、Sphingobacteriia(2.06%,1.76%—2.34%)、Solibacteres(2.01%,1.72%—2.19%)、Bacilli(1.42%,0.61%—2.13%)、[Spartobacteria] (1.26%,0.94%—1.61%)和MB-A2- 108(1.10%,0.91%—1.22%)。在目的水平上,共鉴定170目,大于1%的序列共20个。在科水平上,共鉴定213科,大于1%的序列共17个。在属水平上,共鉴定225属,大于1%的序列共5个。
而ITS1所有序列中,7615条(10%)为没有被分类的序列,其余的序列在门的水平上以Ascomycota所占比例最大为60%,依次分别为Basidiomycota(24%)、Chytridiomycota(5%)和Zygomycota(1%)(图1b)。在纲的水平共鉴定98纲,大于1%的序列共11个,从大到小依次为Sordariomycetes(30.81%,21.77%—45.86%)、Agaricomycetes(23.78%,9.58%—42.72%)、Eurotiomycetes(11.83%,6.02%—21.49%)、Dothideomycetes(3.99%,2.50%—5.23%)、Chytridiomycetes(3.08%,0.12%—16.42%)、IS-s-Chalara sp(2.63%,0.04%—10.30%)、Leotiomycetes(2.12%,0.84%—4.64%)、Un-s-Ascomycota sp(1.82%,0.75%—3.29%)、Pezizomycetes(1.60%,0.06%—5.13%)、Un-s-Chytridiomycota sp(1.47%,0.30%—4.21%)和Un-s-fungal endophyte(1.16%,0.13%—5.71%)。在目的水平上,共鉴定196目,大于1%的序列共19个。在科水平上,共鉴定330科,大于1%的序列共19个。在属水平上,共鉴定435属,大于1%的序列共22个。
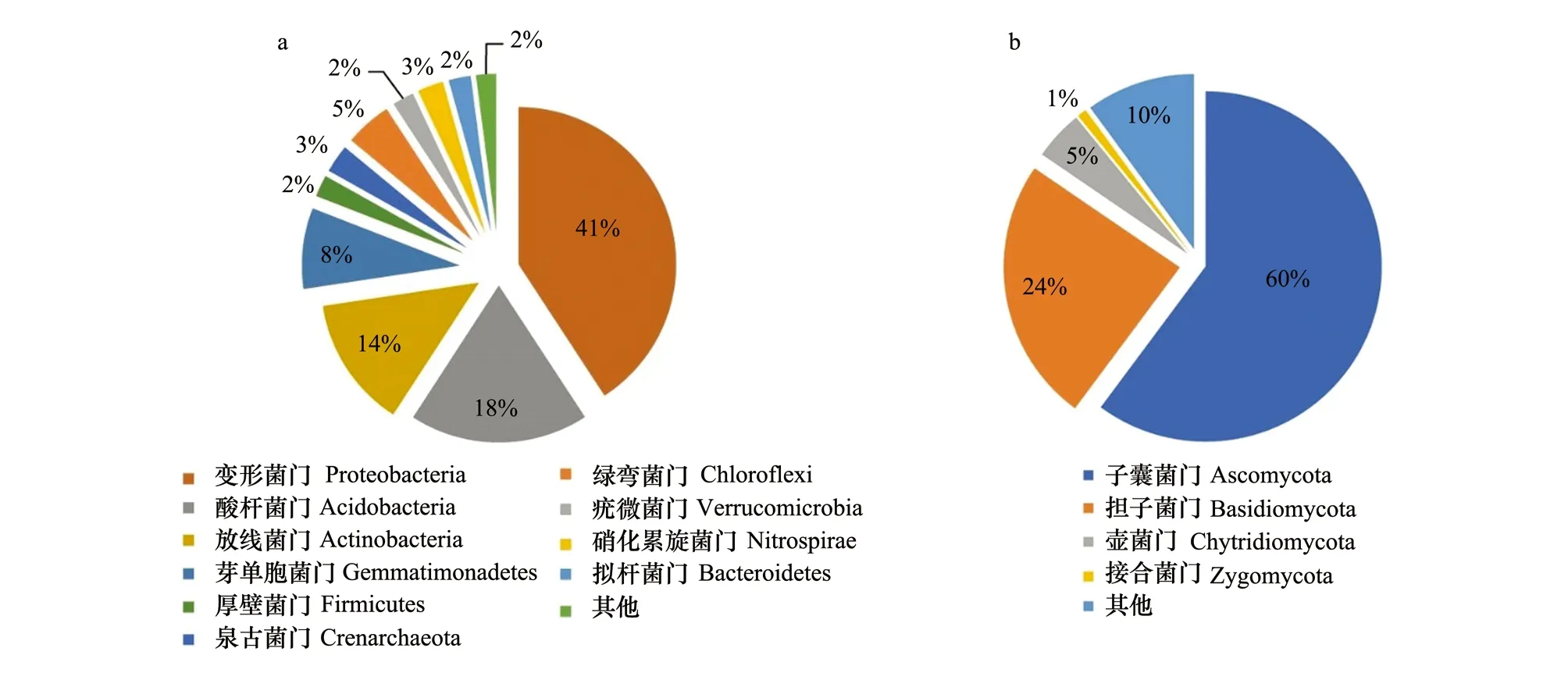
图1 16S rDNA (a)和ITS1 reads(b)总体分类统计图Fig.1 Overall taxonomic sequence analysis for all bacterial 16S reads(a) and fungal ITS1 reads(b)
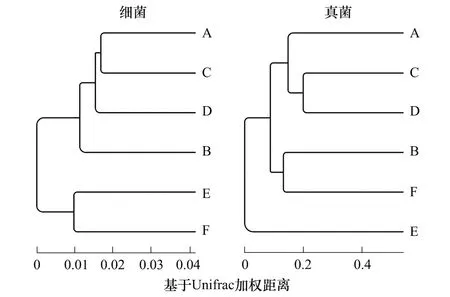
图2 不同树叶处理下人参土壤细菌、真菌的聚类分析图 Fig.2 Weighted Unifrac UPGMA cluster of bacterial and fungal communities associated with different soil samples from different leaf-added treatments. The figure was constructed on the basis of Illumina sequencing data
利用聚类分析对不同树叶处理下人参土壤细菌和真菌群落结构的相似性分析结果(图2)。如图所示人参细菌群落可以被聚成四组:第一组包括处理E和处理F,第二组包括处理A和处理C,第三组包括处理D,第四组包括处理B。真菌群落同样可以被分成四组:第一组包括处理B和处理F,第二组包括处理C和处理D,第三组包括处理A;第四组包括处理E。主坐标分析进一步揭示土壤微生物群落结构组成与添加不同树叶有关。
在门的水平上,所有树叶凋落物处理人参土壤细菌优势菌群前五位相同(图3),依次为Proteobacteria(35.38%—43.698%)、Acidobacteria(17.10%—20.34%)、Actinobacteria(12.77%—14.76%)、Gemmatimonadetes(7.85%—9.36%)、Chloroflexi(4.37%—5.02%)。但是细菌Firmicutes、Crenarchaeota、Verrucomicrobia、Nitrospirae、Bacteroidetes在不同树叶处理土壤中地位不同。在门的水平上,人参土壤真菌优势菌群均为Ascomycota,添加树叶处理土壤中真菌Basidimoycota丰度为第二位,而对照土壤中真菌Chytridiomycota为第二位(图3)。
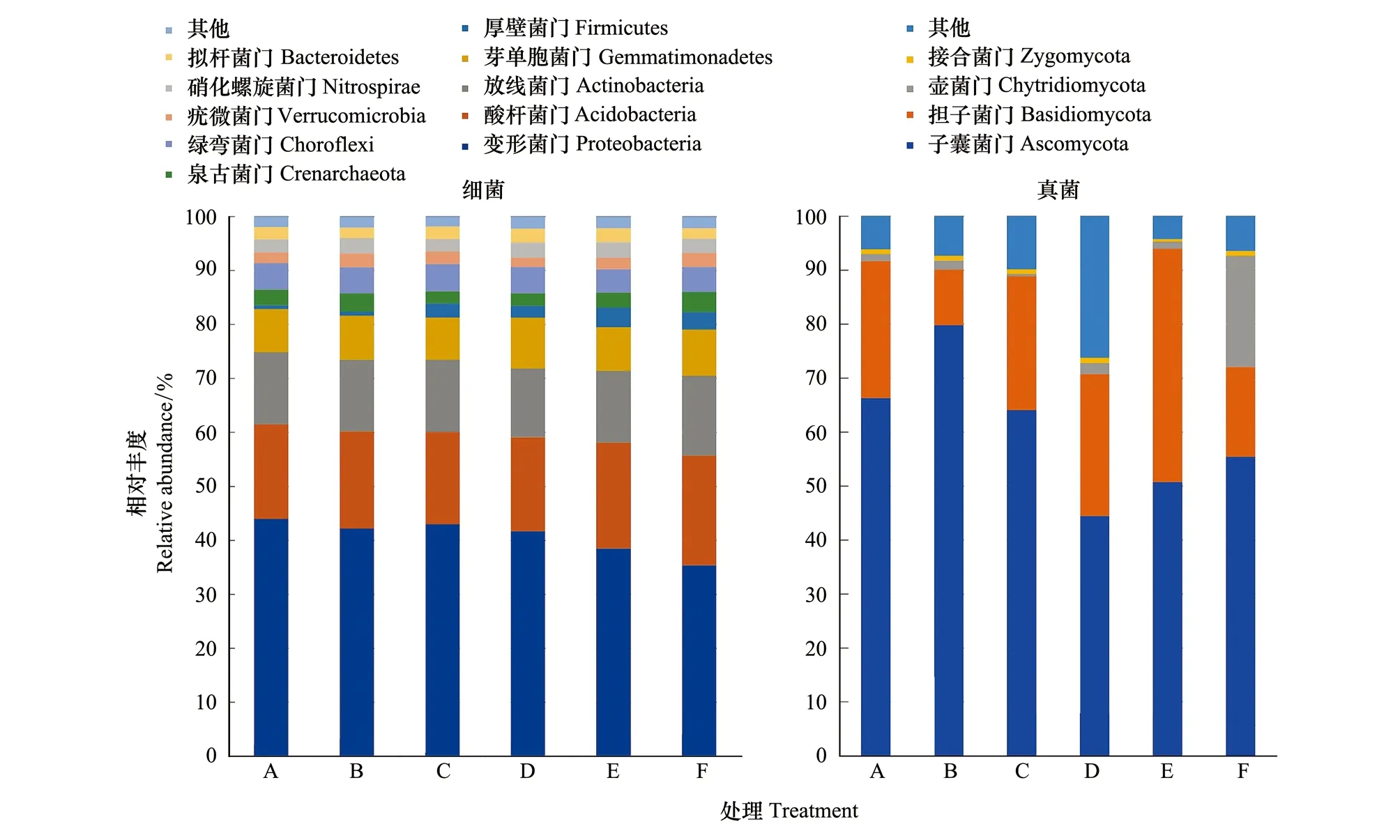
图3 不同树叶处理土壤细菌、真菌在门水平上系统分类图Fig.3 Taxonomic classification of bacterial and fungal reads of soil samples with different leaf addition treatments at the phylum level, using RDP classifier
为了明确不同树叶处理对土壤微生物的地位的影响,利用SAS 9.0软件进行方差分析,结果表明细菌Bacteroidetes在阔叶林树种土壤中丰度显著高于针叶林,而Proteobacteria在添加树叶处理中显著高于对照土壤(P<0.05),可能与树叶在土壤中分解转化有关。不同树叶处理下,真菌Ascomycota的丰度赤松树叶处理与对照之间存在极显著差异,而树叶处理B土壤真菌Basidiomycota的丰度极显著低于处理C、处理D和处理E(P<0.01)(图4)。不同树叶处理下土壤细菌Proteobacteria和Bacteroidetes及真菌Ascomycota和Basidiomycota多样性不同,可能是响应特定树叶分解的功能微生物,如Bacteroidete和Ascomycota适宜在高微生物量氮(126.48—145.90 mg/kg)、全氮(2.66—4.11 mg/kg)及有效磷(29.33—52.80 mg/kg)土壤条件下生存,而Ascomycota适宜在低有效钾(128.67—206.86 mg/kg)条件下生存。
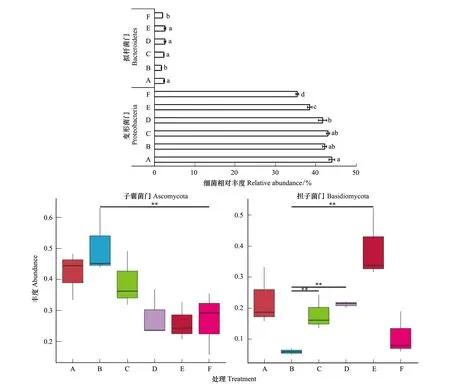
图4 不同处理下土壤主要细菌和真菌丰度差异性Fig.4 Dominant bacterial and fungal relative abundance of phylogenetic genera in different treatments图中小写字母表示在0.05水平下呈显著差异水平,**表示在0.01水平下呈极显著差异水平
利用LEfSe(Line Discriminant Analysis (LDA) Effect Size)在不同处理间不同分类水平进一步寻找具有统计学差异的Biomarker(图5)。色木槭树叶凋落物土壤标志性细菌种群为根瘤菌目(Rhizobiales),标志性真菌种群为炭疽菌Colletotrichum_anthrisci。赤松树叶凋落物土壤标志性真菌包括两个属和两个种,两个属分别为Chalara和Xenopolyscytalum,两个种分别为Exophiala_equina和Podospora_glutinans。胡桃楸树叶凋落物土壤标志性细菌为红螺菌目Rhodospirillales。紫椴标志性细菌为鞘氨醇单胞菌属Sphingomonas,标志性真菌为Harzia_acremonioides。蒙古栎树叶凋落物土壤标志性真菌共有1个科和4个属,一个科为盘菌科Pezizaceae,4个属分别为Trichoderma、Pilidiella、Minimedusa和Talaromyces。
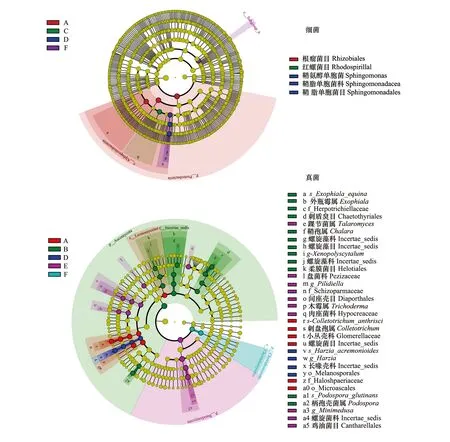
图5 LEfSe分析进化分枝图Fig.5 Cladogram of soil bacterial and fungal in different treatments via LEfSe method identifies the significantly different abundant taxa(LDA score=4.0)进化分支图由内至外辐射的圆圈代表了由门至种的分类级别;在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比;着色原则为将无显著差异的物种统一着色为黄色,其他差异物种按该物种所在丰度最高的分组进行着色
2.3 土壤性质与微生物多样性的相关性
枯枝落叶是土壤中碳氮主要来源,但是不同树叶对土壤中理化性质及微生物群落结构影响不同,特别是土壤微生物量碳氮、全氮及速效氮磷钾(表2)。为了揭示土壤理化因子对微生物群落结构的影响,利用CANOCO 5.0对土壤因子pH(pH值)、SOC(土壤有机碳)、TN(全氮)、C/N(碳氮比)、AN(速效氮)、AP(速效磷)、AK(速效钾)、SMBC(微生物量碳)和SMBN(微生物量氮)与细菌(Proteobacteria、Acidobacteria、Actinobacteria、Gemmatimonadetes、Firmicutes、Crenarchaeota、Chloroflexi、Verrucomicrobia、Nitrospirae和Bacteroidetes)及真菌(Ascomycota、Basidiomycota、Chytridiomycota和Zygomycota)开展冗余分析(图6)。结果表明SMBN、TN、AP、SOC、AK、C/N、pH值与细菌Bacteroidetes、Chloroflexi、Actinobacteria及真菌Basidiomycota、Zygomycota、Chytridiomycota及Ascomycota相关,受添加树叶种类影响。不同树叶处理土壤包含不同的微生物群落结构组成,功能微生物通过地位改变响应不同树叶处理,可能与土壤理化性质有关,特别是土壤中SMBN、TN、AP、SOC、AK、C/N、pH值有关,Chu等人在中国北方森林土壤微生物中研究发现微生物地位改变与微生物碳氮密切相关,尽管其他环境因子也可能与微生物群落结构组成有关[30]。
分析Axis1的特征值为0.7928,解释度为83.24%,Axis2的特征值为0.0959,解释度为10.07%,Axis1和Axis2对整体的解释度为93.31%,且前四个Axis解释度达到99.04,P值为0.046。
3 讨论
3.1 不同树叶处理对土壤理化性质的影响
土壤pH是人参选地的一个关键性指标[16],而土壤容重直接影响人参根的形态建成[31]。添加不同树叶处理后土壤容重降低、pH提高(表2)。之前研究表明人参生长适宜的条件为容重小于1 g/cm3、微酸性且具有高的养分供应能力[32]。人参连作土壤呈现pH值降低、养分含量下降、土壤微生物群落结构紊乱[33],本研究中添加不同树叶处理后土壤pH及容重改变可能有助于提高人参生长过程抵抗环境胁迫能力。
添加不同树叶处理后人参土壤有机碳、全氮、速效氮磷含量均增加,但是不同树叶处理增加程度不同。在森林生态系统中,落叶分解是促进养分循环的一个重要途径,树种和落叶量直接影响土壤养分含量[34-35]。枯枝落叶被视为土壤有机碳主要来源且影响着有机碳的矿化率,添加树叶后土壤有机碳、全氮及速效氮磷含量有不同程度增加,特别是添加胡桃楸、紫椴和蒙古栎树叶的3个处理土壤有机碳增加幅度最大,进一步证实落叶能够提高土壤养分含量[36-37]。其机理可能是树叶通过微生物分解在地球化学循环中产生巨大的碳流,将树叶中养分归还到土壤中,使其有助于植物生长[38]。除此之外,微生物自身繁衍受到碳源和养分的限制,进而影响树叶分解过程。
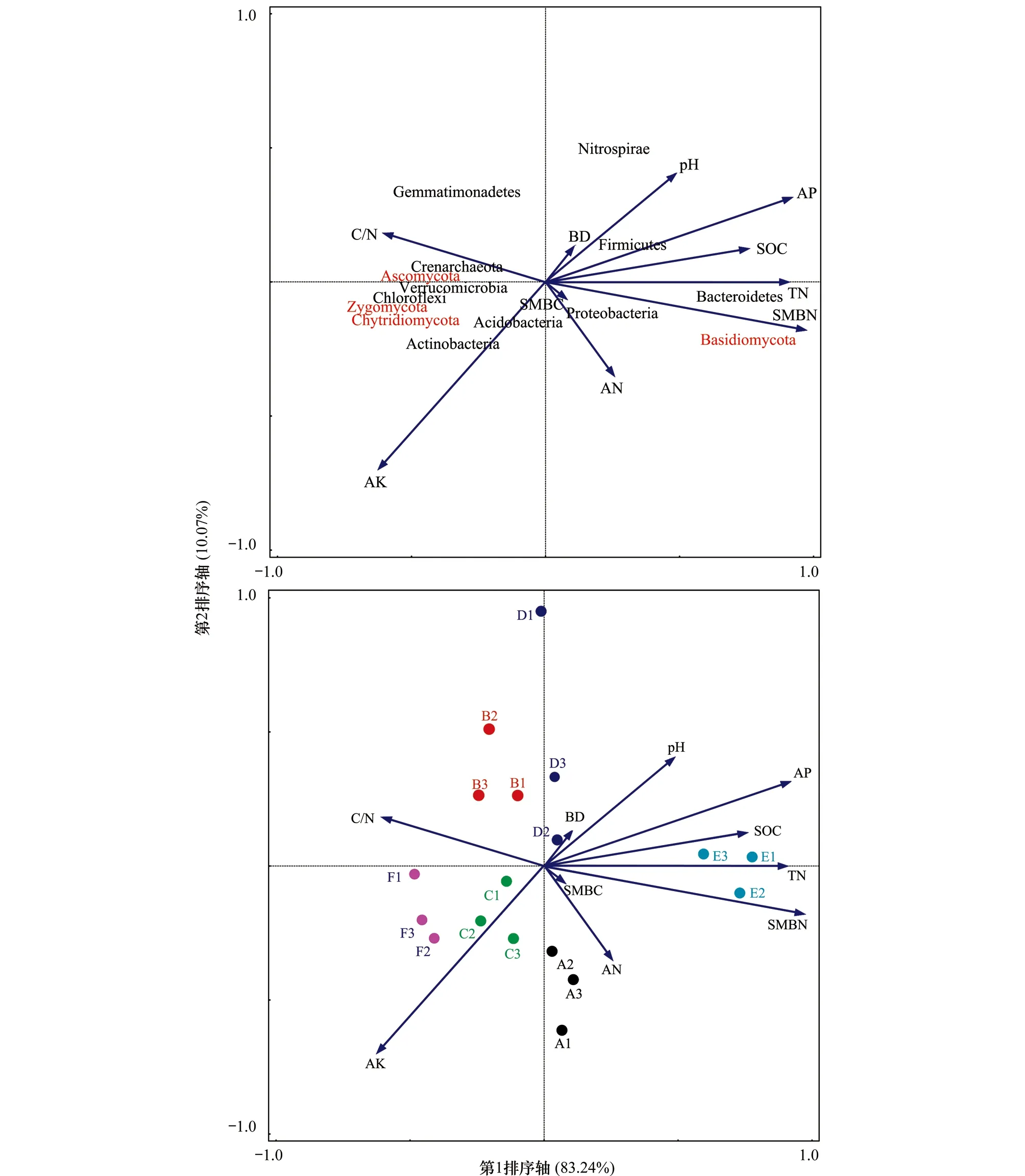
图6 不同处理下人参土壤微生物与土壤因子冗余分析 Fig.6 Redundancy analysis(RDA) based on the relative abundance of miacrobial phyla and select soil properties in adding leaf litter treatmen变形菌门,Proteobacteria;酸杆菌门,Acidobacteria;放线菌门,Actinobacteria;芽单胞菌门,Gemmatimonadetes;厚壁菌门,Firmicutes;泉古菌门,Crenarchaeota;绿弯菌门,Chloroflexi;疣微菌门,Verrucomicrobia;硝化螺旋菌门,Nitrospirae;拟杆菌门,Bacteroidetes;子囊菌门,Ascomycota;担子菌门,Basidiomycota;壶菌门,Chytridiomycota;接合菌门,Zygomycota
添加不同树叶后土壤中微生物量碳氮含量增加,但增加程度不同,其中色木槭对土壤微生物量碳氮增加效果最明显,这与前人在森林土壤中研究微生物量碳氮一致[5,39]。原因可能是添加树叶后为土壤微生物提供了更多种类的碳源,促进微生物的繁衍[40]。土壤C/N被视为土壤质量变化的指示因子,其大小能够反映养分利用效率、同时与碳氮循环及养分植物有效性有关[41],Hawke和Vallance[40]已经证实在土壤微生物参与有机质分解过程中低C/N促进养分的释放,本研究中添加树叶后土壤中C/N均低于8(对照8.36),而有机碳和土壤速效氮磷含量较高。进一步说明C/N能够调节土壤微生物繁衍和养分释放之间的平衡。
3.2 不同树叶处理对土壤微生物群落结构组成的影响
添加不同树叶处理人参土壤微生物群落结构发生改变,功能微生物地位发生改变。人参土壤细菌和真菌群落组成受针叶林和阔叶林分类影响较大,阔叶林之间微生物群落结构组成相近(图2)。其原因可能是阔叶林树叶分解引入土壤中碳含量比针叶林高,且阔叶林中包含更为丰富的碳源种类,导致了阔叶林下土壤微生物多样性高于针叶林[42]。而针叶林微生物群落组成相对单一,且针叶林土壤中含有大量的不易被微生物利用的木质素和腐殖酸,分解过程中主要以分解复杂结构有机碳为主的微生物(K-strategists)主导[12],由于碳源的种类及含量导致了不同树种微生物集群的改变。
不同树叶处理后人参土壤优势微生物种类相同,但是功能微生物地位发生改变。选择适宜树种是林下参护育成败的关键,尽管树叶凋落物对土壤微生物影响的研究较多[43-44],但是林下参土壤微生物结构和功能响应树叶凋落物分解的研究尚属空白。树叶的分解是影响土壤养分组成和微生物群落结构的重要因素,而不同的土壤特性可以诱导土壤微生物集群的改变[45],本研究中土壤细菌Proteobacteria是所有树叶处理中的优势菌群,被视为树叶分解转化的主要功能细菌,该研究结果与先前研究结果相一致[46-47]。除此之外,细菌Bacteroidetes在阔叶林处理下丰度显著高于针叶林(图4),而细菌Bacteroidetes已被证实是阔叶林分解的关键细菌[48],这有助于进一步评价阔叶林和针叶林对土壤理化性质的影响。添加树叶后真菌Basidimoycota和Chytridiomycota地位同样发生改变,与不同树叶所含的有机碳结构复杂程度不同,同时真菌自身繁衍对环境碳源和氮源的选择性,导致真菌地位的改变,比如真菌Ascomycota多样性高于对照, Basidiomycota多样性在赤松树叶处理土壤中高于胡桃楸、紫椴和蒙古栎处理的土壤。
土壤细菌的不同分类水平上,在紫椴树叶凋落物处理土壤中鞘氨醇单胞菌属Sphingomonas在目、科水平下特异表达,鞘氨醇单胞菌属可能是紫椴树叶处理的特异细菌。鞘氨醇单胞菌属已被证实能够分泌过氧化氢酶、提高植物抗逆性,被视为植物益生菌[49],该细菌属可能与林下参高抗逆性有关。不同树叶处理下土壤真菌在不同分类水平上特异表达。炭疽菌Colletotrichum_anthrisci为色木槭凋落物特异土壤真菌[50],疽菌是引起人参炭疽病的主要致病菌,需要警惕。赤松凋落物土壤真菌包括两个属(Chalara和Xenopolyscytalum)和两个种(Exophiala_equina和Podospora_glutinans),目前相关功能并不清楚,可能与针叶林分解有关。Harzia_acremonioides为紫椴树叶凋落物特异真菌。在属水平上,Trichoderma、Pilidiella、Minimedusa和Talaromyces为蒙古栎土壤特异真菌,该菌属可能参与凋落物的分解。
4 结论
土壤理化性质和土壤微生物群落结构组成受不同树叶添加物影响,尽管不同树叶添加后对优势微生物种群改变不大,但是功能微生物地位发生改变。添加不同树叶后提高了土壤中微生物量碳氮含量、增加土壤速效氮磷含量,同时改变土壤pH值和容重;18个土壤样品基因组,经16S和ITS测序分别得到6064和1900个OUTs。其中细菌涵盖了42门、117纲、170目、213科、225属,真菌涵盖了24门、98纲、196目、330科、435属。细菌Proteobacteria是树叶分解的关键微生物。而细菌Bacteroidetes和真菌Basidiomycota可能是区别阔叶林和针叶林树种的关键微生物,真菌Ascomycota是针叶林分解的功能微生物。从不同分类水平上得到特定树叶凋落物的特异细菌和真菌,不同树叶处理下人参土壤功能微生物的位置及多样性的改变均与土壤因子有关。通过进一步分析不同树叶对土壤理化性质及微生物群落结构组成的影响,将有助于模拟森林土壤微生物分布、繁衍及多样性,对于林下参选地和农田栽参土壤微生物改良具有实践意义。
参考文献(References):
[1] Gao Y G, Liu Q, Zang P, Li X, Ji Q, He Z M, Zhao Y, Yang H, Zhao X L, Zhang L X. An endophytic bacterium isolated fromPanaxginsengC.A. Meyer enhances growth, reduces morbidity, and stimulates ginsenoside biosynthesis. Phytochemistry Letters, 2015, 11: 132- 138.
[2] Jang I B, Lee D Y, Yu J, Park H W, Mo H S, Park K C, Hyun D Y, Lee E H, Kim K H, Oh C S. Photosynthesis rates, growth, and ginsenoside contents of 2-yr-oldPanaxginsenggrown at different light transmission rates in a greenhouse. Journal of Ginseng Research, 2015, 39(4): 345- 353.
[3] Lee K J, Lee B W, Kang J Y, Lee D Y, Jang S W, Kim K S. Assessment of microclimate conditions under artificial shades in a ginseng field. Journal of Ginseng Research, 2016, 40(1): 90- 96.
[4] Zhang Z Y, Lin W X, Yang Y H, Chen X J. Effects of consecutively monoculturedRehmanniaglutinosaL. on diversity of fungal community in rhizospheric soil. Agricultural Sciences in China, 2011, 10(9): 1374- 1384.
[5] Suthar S, Gairola S. Nutrient recovery from urban forest leaf litter waste solids usingEiseniafetida. Ecological Engineering, 2014, 71: 660- 666.
[6] Li X Q, Yin X Q, Wang Z H, Fan W H. Litter mass loss and nutrient release influenced by soil fauna ofBetulaermaniiforest floor of the Changbai Mountains, China. Applied Soil Ecology, 2015, 95: 15- 22.
[7] Boone R D, Nadelhoffer K J, Canary J D, Kaye J P. Roots exert a strong influence on the temperature sensitivityof soil respiration. Nature, 1998, 396(6711): 570- 572.
[8] McGuire A D. Ecosystem element cycling. In: EL-Shaarawi A H, Pigorsch W W eds. Encyclopedia of Environmetrics, Volume 2. Chichester: John Wiley & Sons, Ltd, 2002, 614- 618.
[9] 孙海, 王秋霞, 张亚玉, 杨振, 徐成路. 不同生产模式下人参土壤肥力评价. 吉林农业大学学报, 2015, 37(3): 323- 331.
[10] Chapin Ⅲ F S, Matson P A, Mooney H A. Principles of Terrestrial Ecosystem Ecology. New York: Springer-Verlag, 2002.
[11] Wang Q K, Wang S L, He T X, Wu J B. Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils. Soil Biology and Biochemistry, 2014, 71: 13- 20.
[12] Swift M J, Heal O W, Anderson J M. Decomposition in Terrestrial Ecosystems. California, USA: University of California Press, 1979: 131- 156.
[13] Wan X H, Huang Z Q, He Z M, Yu Z P, Wang M H, Davis M R, Yang Y S. Soil C:N ratio is the major determinant of soil microbial community structure in subtropical coniferous and broadleaf forest plantations. Plant and Soil, 2015, 387(1/2): 103- 116.
[14] Fanin N, Bertrand I. Aboveground litter quality is a better predictor than belowground microbial communities when estimating carbon mineralization along a land-use gradient. Soil Biology and Biochemistry, 2016, 94: 48- 60.
[15] Hristovski S, Berg B, Melovski L. Limitless decomposition in leaf litter of Common beech: patterns, nutrients’ and heavy metal’s dynamics. Pedobiologia, 2014, 57(3): 131- 138.
[16] Kim C, Choo G C, Cho H S, Lim J T. Soil properties of cultivation sites for mountain-cultivated ginseng at local level. Journal of Ginseng Research. 2015,39(1):76- 80.
[17] Garcia-Pausas J, Paterson E. Microbial community abundance and structure are determinants of soil organic matter mineralisation in the presence of labile carbon. Soil Biology and Biochemistry, 2011, 43(8): 1705- 1713.
[18] Puissant J, Cécillon L, Mills R T E, Robroek B J M, Gavazov K, De Danieli S, Spiegelberger T, Buttler A, Brun J J. Seasonal influence of climate manipulation on microbial community structure and function in mountain soils. Soil Biology and Biochemistry, 2015, 80: 296- 305.
[19] Riah-Anglet W, Trinsoutrot-Gattin I, Martin-Laurent F, Laroche-Ajzenberg E, Norini M P, Latour X, Laval K. Soil microbial community structure and function relationships: a heat stress experiment. Applied Soil Ecology, 2016, 86: 121- 130.
[20] Nguyen T T, Cavagnaro T R, Ngo H T T, Marschner P. Soil respiration, microbial biomass and nutrient availability in soil amended with high and low C/N residue-Influence of interval between residue additions. Soil Biology and Biochemistry, 2016, 95: 189- 197.
[21] Nazaries L, Tottey W, Robinson L, Khachane A, Al-Soud W A, Sørensen S, Singh B K. Shifts in the microbial community structure explain the response of soil respiration to land-use change but not to climate warming. Soil Biology and Biochemistry, 2015, 89: 123- 134.
[22] Li Y, Ying Y X, Zhao D Y, Ding W L. Influence of allelochemicals on microbial community in ginseng cultivating soil. Chinese Herbal Medicines, 2014, 6(4): 313- 318.
[23] Ying Y X, Ding W L, Zhou Y Q, Li Y. Influence ofPanaxginsengcontinuous cropping on metabolic function of soil microbial communities. Chinese Herbal Medicines, 2012, 4(4): 329- 334.
[24] 孙海, 王秋霞, 张迪迪, 刘宁, 李乐, 徐成路, 张亚玉. 不同生长模式下人参土壤微生物群落结构研究. 东北农业大学学报, 2016, 47(2): 16- 23.
[25] 张新平, 王襄平, 朱彪, 宗占江, 彭长辉, 方精云. 我国东北主要森林类型的凋落物产量及其影响因素. 植物生态学报, 2008, 32(5): 1031- 1040.
[26] 景莎, 田静, Luke M M, 王晶苑, 王秋凤, 杨国栋, 郭大立, 于贵瑞. 长白山原始阔叶红松林土壤有机质组分小尺度空间异质性. 生态学报, 2016, 36(20): 6445- 6456.
[27] 鲍士旦. 土壤农化分析(第三版). 北京: 中国农业出版社, 2005: 2- 114.
[28] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C. Soil Biology and Biochemistry, 1987, 19(6): 703- 707.
[29] Caporaso J G, Lauber C L, Walters W A, Berg-Lyons D, Lozupone C A, Turnbaugh P J, Fierer N, Knight R. Global patters of 16S rRNA diversity at a depth of mmillions of sequence per sample. Proceedings of the National Academy of Sciences, 2011, 108(Supplement 1): 4516- 4522.
[30] Chu H Y, Xiang X J, Yang J, Adams J M, Zhang K P, Li Y T, Shi Y. Effects of slope aspects on soil bacterial and Arbuscular fungal communities in a Boreal forest in China. Pedosphere, 2016,26(2):226- 234.
[31] 李志洪, 陈丹, 吴培祥, 刘兆荣, 鞠玉章. 土壤容重对床土水分特性和人参生长的影响. 吉林农业大学学报, 1991, 13(3): 39- 44.
[32] You J F, Liu X, Zhang B, Xie Z K, Hou Z G, Yang Z M. Seasonal changes in soil acidity and related properties in ginseng artificial bed soils under a plastic shade. Journal of Ginseng Research, 2015, 39(1): 81- 88.
[33] 简在友, 王文全, 孟丽, 王丹, 游佩进, 张子龙. 人参连作土壤元素含量分析. 土壤通报, 2011, 42(2): 369- 371.
[34] Hobbie S E. Plant species effects on nutrient cycling: revisiting litter feedbacks. Trends in Ecology & Evolution, 2015, 30(6): 357- 363.
[35] Liu D, Keiblinger K M, Leitner S, Mentler A, Zechmeister-Boltensterm S. Is there a convergence of deciduous leaf litter stoichiometry, biochemistry and microbial population during decay? Geoderma, 2016, 272: 93- 100.
[36] Ravindran A, Yang S S. Effects of vegetation type on microbial biomass carbon and nitrogen in subalpine mountain forest soils. Journal of Microbiology, Immunology and Infection, 2015, 48(4): 362- 369.
[37] Deng Q, Cheng X L, Hui D F, Zhang Q, Li M, Zhang Q F. Soil microbial community and its interaction with soil carbon and nitrogen dynamics following afforestation in central China. Science of the Total Environment, 2016, 541: 230- 237.
[37] Schlesinger W H, Andrews J A. Soil respiration and the global carbon cycle. Biogeochemistry, 2000, 48(1): 7- 20.
[39] Mukhopadhyay S, Joy V C. Influence of leaf litter types on microbial functions and nutrient status of soil: ecological suitability of forest trees for afforestation in tropical laterite wastelands. Soil Biology and Biochemistry, 2010, 42(12): 2306- 2315.
[40] Hawke D J, Vallance J R. Microbial carbon concentration in samples of seabird and non-seabird forest soil: implications for leaf litter cycling. Pedobiologia, 2015, 58(1): 33- 39.
[41] Blair G J, Lefroy R D B, Lisle L. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Australian Journal of Agricultural Research, 1995, 46(7): 1459- 1466.
[42] 贺云龙, 齐玉春, 彭琴, 董云社, 郭树芳, 闫钟清, 王丽芹, 李兆林. 外源碳输入对陆地生态系统碳循环关键过程的影响及其微生物学驱动机制. 生态学报, 2017, 37(2): 358- 366.
[43] Joly F X, Coulis M, Gerard A, Fromin N, Hattenschwiler H. Litter-type specific microbial resposes to the transformation of leaf litter into millipede faces. Soil Biology and Biochemistry, 2015,86:17- 23.
[44] Wang C T, Wang G X, Wang Y, Rafique R, Ma L, Hu L, Luo Y Q. Urea addition and litter manipulation alter plant community and soil microbial community composition in aKobresiahumilismeadow. European Journal of Soil Biology, 2015, 70: 7- 14.
[45] Shi L L, Zhang H Z, Liu T, Zhang W X, Shao Y H, Ha D L, Li Y Q, Zhang C M, Cai X A, Rao X Q, Lin Y B, Zhou L X, Zhao P, Ye Q, Zou X M, Fu S L. Consistent effects of canopy vs. understory nitrogen addition on the soil exchangeable cations and microbial community in two contrasting forests. Science of the Total Environment, 2016, 553: 349- 357.
[46] Mander C, Wakelin S, Young S, Condron L, O′Callaghan M. Incidence and diversity of phosphate-solubilising bacteria are linked to phosphorus status in grassland soils. Soil Biology and Biochemistry, 2012, 44(1): 93- 101.
[47] Huang J S, Hu B, Qi K B, Chen W J, Pang X Y, Bao W K, Tian G L. Effects of phosphorus addition on soil microbial biomass and community composition in a subalpine spruce plantation. European Journal of Soil Biology, 2016, 72: 35- 41.
[48] Sauvadet M, Chauvat M, Cluzeau D, Maron P A, Villenave C, Bertrand I. The dynamics of soil micro-food web structure and functions vary according to litter quality. Soil Biology and Biochemistry, 2016, 95: 262- 274.
[49] 陈冬梅, 柯文辉, 陈兰兰, 黄锦文, 吴文祥, 陈婷, 张重义, 林文雄. 连作对白肋烟根际土壤细菌群落多样性的影响. 应用生态学报, 2010, 21(7): 1751- 1758.
[50] Ryu H, Park H, Suh D S, Jung G H, Park K, Lee B D. Biological control ofColletotrichumpanacicolaonPanaxginsengbyBacillussubtilisHK-CSM- 1. Journal of Ginseng Research, 2014, 38(3): 215- 219.

