黄土丘陵区不同施肥处理对土壤微生物特性的影响
梁楚涛,张娇阳,艾泽民,肖 列,薛 萐1,,*
1 中国科学院教育部水土保持与生态环境研究中心黄土高原土壤侵蚀与旱地农业国家重点实验室,杨凌 712100 2 中国科学院大学,北京 100085 3 西北农林科技大学水土保持研究所,杨凌 712100
黄土高原土壤贫瘠,已成为该区作物产量提高的一个重要限制因素[1]。而随着人口的快速增加,特别是退耕还林政策的实施,该区域面临着严重的粮食供应问题,截至2008年,黄土高原地区已退耕土地483万hm2,局部已出现人-粮关系紧张的局面[2]。施肥由于可明显地改善土壤理化性质、增加土壤肥力,调节土壤养分循环,提高作物产量[3-4],越来越受到人们的重视。但由于肥料种类的不同,长期施肥对土壤质量的影响也存在较大差异,如一些研究发现长期使用无机肥会导致土壤质量下降,农业污染加重[4-5]。如何合理培肥,保持粮食产量、土壤质量和环境之间的友好发展已成为研究的重点。
土壤微生物群落被认为是土壤生态系统变化的预警及敏感指标,用来指示土壤质量变化。施用的肥料可以通过影响土壤化学成分引起土壤微生物活性、土壤微生物群落结构改变,也可以通过改变土壤的物理性状影响地上植被的生长状况,从而间接地影响土壤微生物群落结构[4]。有研究表明施肥管理可以迅速地影响土壤呼吸、微生物量及其他土壤性质[6]。近年来,许多学者也开展了不同地区长期施肥对微生物量碳氮[6-7]、微生物多样性[8-9]、微生物活性[10]和酶活性[11-12]等方面影响的研究。Kama等[13]在肯尼亚的试验发现,氮磷混施降低了细菌群落结构的多样性,有机肥或有机无机肥混施能明显影响微生物群落结构。Zheng等[14]在中国北部沙壤土的试验发现,氮磷钾混施对于FAMEs含量影响不显著,有机肥或有机无机肥混施对微生物群落的FAMEs含量影响最大。Yu等[15]在淋溶土地上的施肥研究发现,无机肥的施用抑制生长,有机肥促进微生物的生长。张焕军等[16]在对潮土的研究中发现长期施用有机肥改变了土壤微生物的群落结构,提高了细菌数量,降低了放线菌含量,而对真菌数量没有明显影响,陆海飞等[17]对红壤性水稻土的研究中发现长期有机无机肥配施可显著提高土壤细菌多样性。由此发现,由于气候条件、土壤类型以及耕作施肥的差异,无机肥对土壤微生物特性的影响结果不一致;但有机肥和有机肥与化肥混施对微生物影响的研究结果基本一致,表现为促进作用。
尽管关于施肥对土壤微生物影响的研究报道较多,但关于黄土丘陵区农业生产中占有很大的比重的川地农田,在这方面研究较少,尤其是长期施肥后土壤微生物群落结构的变化及施肥对土壤质量影响方面的报道更是缺乏。因此,探究施肥对农田微生物群落变化特征的影响,评价土壤性质变化及指导作物产量变化的分析具有重要意义。本试验以黄土丘陵区安塞野外试验站川地长期肥料试验样地的土壤为研究对象,分析不同施肥处理对土壤微生物群落多样性及其活性的影响,明确影响土壤微生物学特征的关键因子,以期为该区域农田系统进行土壤质量评价,建立合理施肥制度、提高土地生产力提供数据支持和科学依据。
1 材料与方法
1.1 研究区概况
试验于2011年在中国科学院安塞水土保持综合试验站进行,该站位于黄土高原中部(109°19′23″E,36°51′30″N),海拔1068—1309m。属暖温带半干旱气候,年均温8.8℃,有效积温(>10 ℃)为3114℃,年均降雨量535mm,60%的降水集中在7—9月,且多暴雨,干燥度1.48;无霜期160d。地貌类型为典型的梁峁状丘陵沟壑区,沟壑密度8.06km/km2。土壤类型处于黄绵土与沙黄土交错区,地带性土壤为黑垆土,绝大部分已流失,黄土母质广泛出露地表,主要为黄绵土。养分比较贫瘠,氮、磷缺乏,钾富足。受自然条件和人类活动共同影响,水土流失严重。因无灌溉条件,靠天然降水,属雨养农业地区,农作制一年一熟,以秋作物为主。
1.2 试验设计
所选样地位于墩滩川地养分长期定位试验场,从1997年开始设置,为旱地,轮作方式为玉米-玉米-大豆。样地面积378m2,每块小区为14m2。本研究选择8个处理:CK(对照)、N(氮肥)、P(磷肥)、M(有机肥)、NP(氮肥和磷肥配施)、MN(有机肥和氮肥配施)、MP(有机肥和磷肥配施)和MNP(有机肥、氮肥和磷肥配施)。小区随机区组排列,每个处理布设了3块样地重复。有机肥用冬羊粪,氮肥为尿素,磷肥为过磷酸钙,施肥量分别为N:97.5kg/hm2;P:75.0kg/hm2;M:有机肥(羊粪)7500kg/hm2。施肥方法为将有机肥和磷肥做种肥一次施入,尿素做种肥施总量的20%,余下80%的尿素在玉米大喇叭口期与抽雄期之间追施。
1.3 样品的采集与测试分析
待作物收获后,于2012年10月19日,采用S型取样法采取了0—20cm和20—40cm两层的土壤,装在布袋中立即送回实验室保存。剔除根系和凋落物后,分为2份,一份风干,然后分别过0.25mm筛和1mm筛。过0.25mm筛的用于测定土壤有机碳、全氮、全磷,过1mm筛的用于测pH、速效磷和碱解氮。另一份鲜土样过2mm筛然后再分两份,一部分放4℃冰箱贮存用于基础呼吸和诱导呼吸;另一部分贮存于-80℃冰箱用于磷脂脂肪酸测定。
土壤理化性质采用常规测定方法[18]。土壤有机碳用重铬酸钾氧化-外加热法;土壤全氮采用凯氏定氮法;土壤全磷采用硫酸-高氯酸消煮,钼锑抗比色法测定;土壤碱解氮采用碱解扩散法;土壤速效磷采用碳酸氢钠提取钼锑抗比色法测定;pH值用pH计测定(水∶土=2.5∶1)。
土壤基础呼吸(BR)和诱导呼吸(SIR)的测定参考Hueso等[19]采用红外气体分析仪测定。土壤微生物磷脂脂肪酸采用修正的Blight-Dyer法[20],取3.0g冻干土样,通过氯仿-甲醇-柠檬酸缓冲液振荡提取总脂,采用硅胶柱分离,分别以氯仿、丙酮、甲醇洗脱,收集甲醇分离液。甲脂化后,以酯化的C19:0为内标,用气相色谱仪(GC7890A,Agilent Technologies) 进行测定,应用美国MIDI公司开发的Sherlock MIS4. 5系统分析鉴定微生物类群。PLFA的总量和单个PLFA的量可根据内标C19: 0进行计算,用nmol/g干土表示。
本文常见的13:0 iso、13:0 anteiso、14:0 iso、14:0 anteiso、15:1 iso w9c、15:0 iso、15:0 anteiso、16:0 iso、17:1 iso w9c、17:0 iso、17:0 anteiso、19:0 anteiso、22:0 iso表征革兰氏阳性菌;12:1 w4c、15:1 w8c、17:1 w8c、18:1 w9c、18:1 w7c、19:0 cyclo w7c、20:1 w9c、22:1 w9c表征革兰氏阴性菌;16:0 10-methyl、17:1 w7c 10-methyl、17:0 10-methyl、18:0 10-methyl表征放线菌;18:2 w6c表征真菌。
1.4 数据处理
利用SPSS 20.0统计分析软件对施肥处理下各样地土壤呼吸、诱导呼吸、代谢熵、土壤微生物群落结构进行单因素方差分析(one-way ANOVA);利用三因素方差分析检测氮肥、磷肥和有机肥对各指标的影响程度及其交互作用;利用R软件中Redundancy analysis(RDA)分析环境因素对微生物群落结构变异的解释程度及影响程度。
2 结果与分析
2.1 施肥对土壤呼吸的影响
0—20cm和20—40cm的基础呼吸、诱导呼吸的变化趋势基本一致,且0—20cm的呼吸强度和诱导呼吸强度高于20—40cm(图1)。0—20cm土层中,与CK相比,除M和NP处理外,其余各处理均显著提高了土壤的基础呼吸,呼吸强度增幅达31.18%—53.76%;20—40cm土层中,与CK相比,仅MP和MNP处理对基础呼吸强度产生显著影响(P<0.05),其余各处理均无显著性差异(图1)。
耕作层各处理与CK相比,只有NP未对诱导呼吸产生显著影响,其余各处理显著增强土壤的诱导呼吸(P<0.05)(图1),增加幅度为40.12%—139.38%;而在20—40cm土层中,与CK相比,仅MN、MP、MNP对诱导呼吸产生显著性影响(P<0.05),其余各配施处理对诱导呼吸均未产生显著性影响。
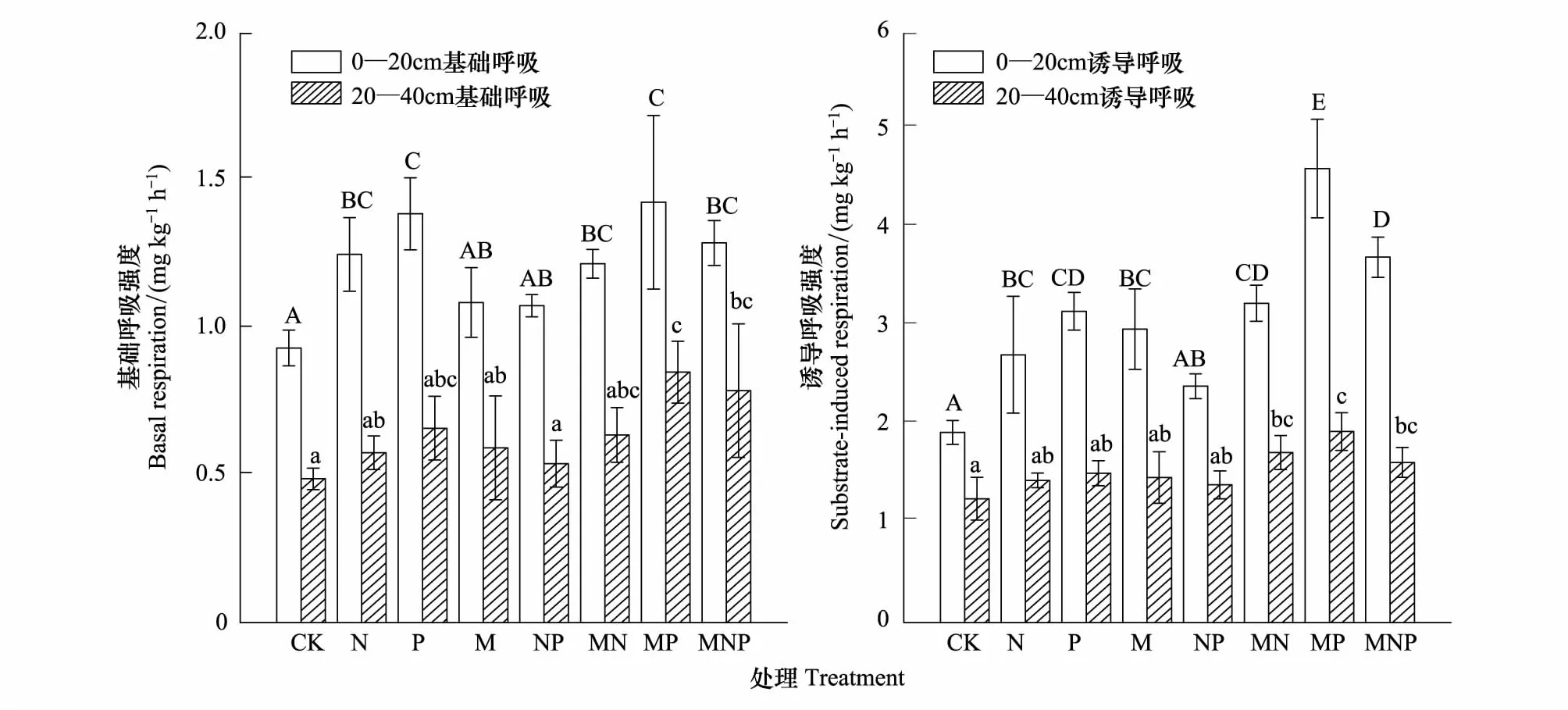
图1 不同施肥处理的土壤基础呼吸和诱导呼吸Fig.1 basal respiration and substrate—induced respiration under different treatments同一土层不同字母表示处理之间差异达到显著水平(P<0.05)
2.2 施肥对土壤微生物群落结构多样性的影响
不同施肥处理对土壤微生物群落结构构成产生显著影响,但不同处理对不同群落结构影响不同(表1)。其中0—20cm土层,除了NP处理对总PLFA无显著影响外不同施肥措施均显著增加了G-PLFA和总PLFA含量,其中PM、NPM和NM增加幅度最大;总体来说,施肥处理增加了G+PLFA、放线菌PLFA和真菌PLFA含量,但仅PM、NPM等个别处理影响达到了显著水平。真菌/细菌仅在PM和NPM两个处理下显著降低,其余处理均未显著变化。施肥处理对20—40cm土层的影响弱于0—20cm土层,仅对G-PLFA、G+PLFA、放线菌PLFA和总PLFA含量产生了显著影响,对真菌PLFA和真菌/细菌未产生显著影响;其中G+PLFA 和放线菌PLFA仅在PM和NPM处理中显著增加,其余处理均为产生显著变化;施肥处理总体增加了G-PLFA和总PLFA含量,但M和NP两个处理影响并未达到显著水平,PM、NPM和NM增加幅度高于N和P处理。
2.3 施肥处理对土壤微生物特性影响的交互作用
通过对氮肥、磷肥和有机肥三因素方差进行分析,表明三因素对不同指标具有不同的作用,且呈现不同程度的交互作用(表2)。在0—20cm土层中,氮肥因素仅对放线菌PLFA有显著影响(P<0.05),磷肥因素仅对真菌PLFA没有显著影响,有机肥仅对BR没有显著影响。氮肥和磷肥对放线菌PLFA外的其它指标具有显著的交互作用,而与有机肥仅对总PLFA显著交互作用。磷肥和有机肥对SIR、G+PLFA、细菌PLFA、放线菌PLFA和总PLFA具有显著的交互作用,而它们和氮肥三者之间对几个指标均没有显著的交互作用。20—40cm表2说明,20—40cm土层中,氮肥因素仅对放线菌和总PLFA有显著影响,磷肥因素处理显著影响土壤微生物的BR、SIR和G+PLFA和放线菌PLFA(P<0.05),有机肥显著改变除真菌外的其它指标。氮肥和磷肥对SIR、G+PLFA、G-PLFA、真菌及总PLFA有显著交互作用,而和有机肥的交互作用与0—20cm土层的结果相似仅对总PLFA产生显著影响,磷肥和有机肥对G+、细菌、放线菌和总PLFA有显著的交互作用,与耕层结果一致,氮肥磷肥和有机肥三者之间对几个指标均没有显著的交互作用。
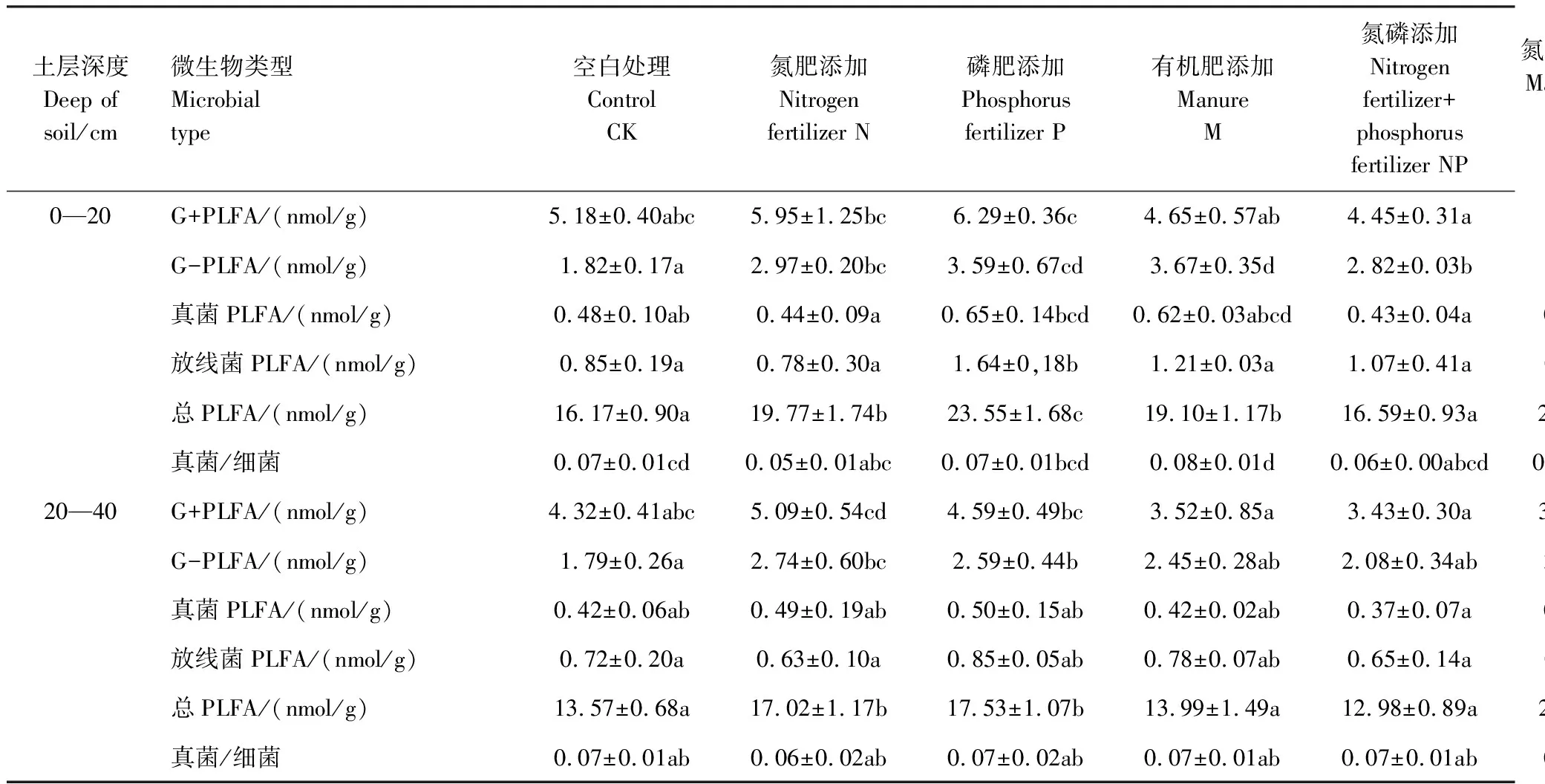
表1 不同施肥处理对土壤微生物特性的影响
同一行不同字母代表处理间差异显著;G+PLFA Gram Positive PLFA;格兰仕阳性菌PLFA G-PLFA Galanz negative 格兰仕阴性菌PLFA
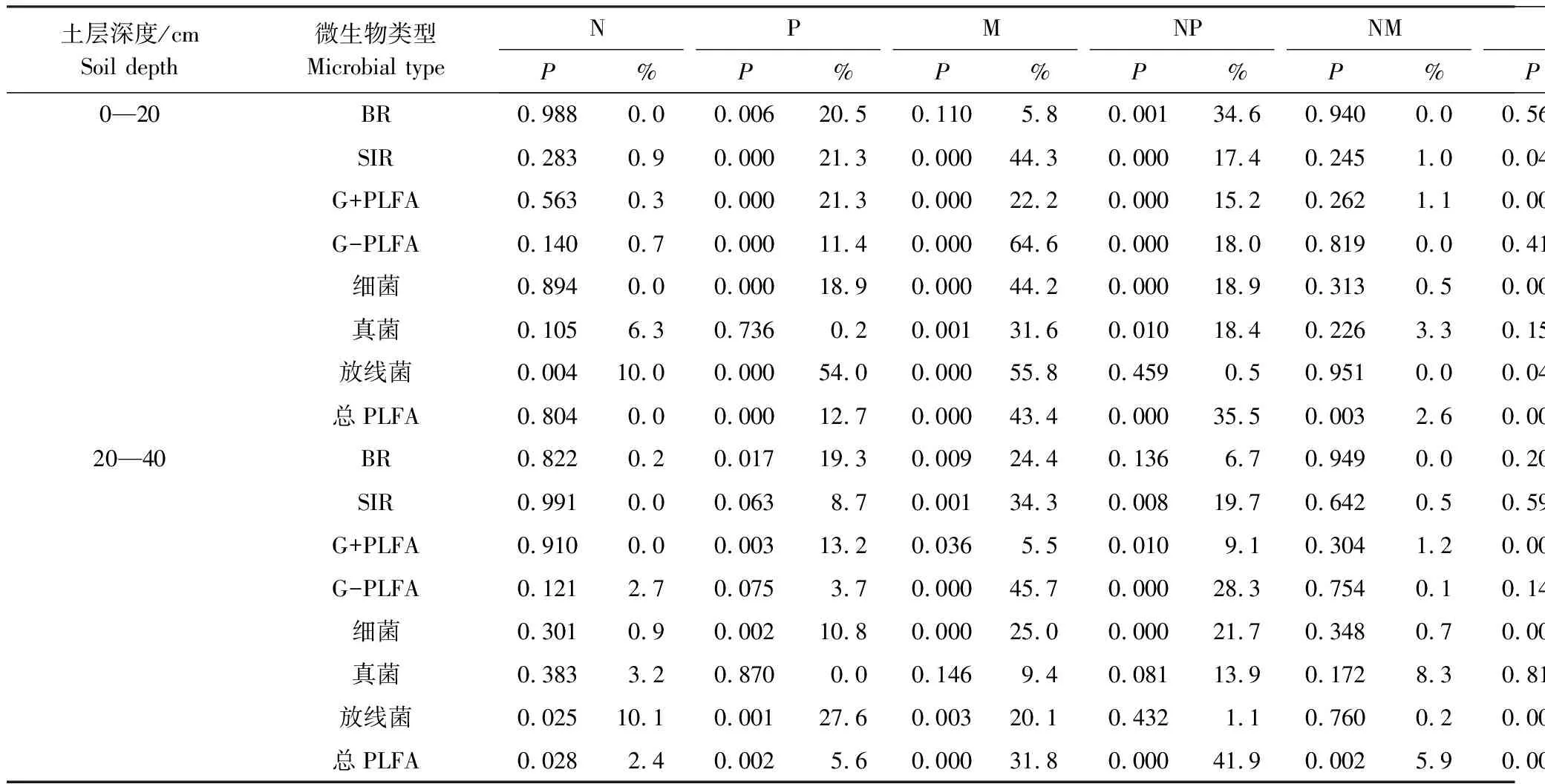
表2 氮、磷、有机肥对微生物呼吸、土壤微生物群落影响的三因素方差分析
BR: basal respiration,代表基础呼吸; SIR: substrate-induced respiration,代表诱导呼吸;qCO2: metabolic quotient,代表代谢熵;G+PLFA: Gram Positive PLFA,格兰仕阳性菌PLFA; G-PLFA: Galanz negative PLFA 格兰仕阴性菌PLFA;CK: contorl空白处理;N: Nitrogen fertilizer氮肥添加;P: Phosphorus fertilizer磷肥添加;M: Manure有机肥添加;NP: Nitrogen fertilizer + phosphorus fertilizer氮磷添加;NM: Manure + nitrogen fertilizer氮肥和有机肥添加;PM:Manure + phosphorus fertilizer磷肥和有机肥添加;NPM: Manure + nitrogen fertilizer + phosphorus fertilizer氮磷和有机肥添加
2.4 微生物群落结构变化的驱动因素
在0—20cm土层中,对施肥处理样地的土壤微生物群落PLFAs进行主成分分析,结果表明(图2),主成分1(PC1)对总PLFAs数据变异的贡献率为24.3%,主成分2(PC2)对总PLFAs数据变异的贡献率为19.37%,累计贡献率为43.67%。各施肥处理在图中上分别成簇出现,主成分1和主成分2基本上能把不同施肥处理区分开,但是NP与NM的样点分布部分重合,表明施肥处理改变了土壤微生物的群落结构。
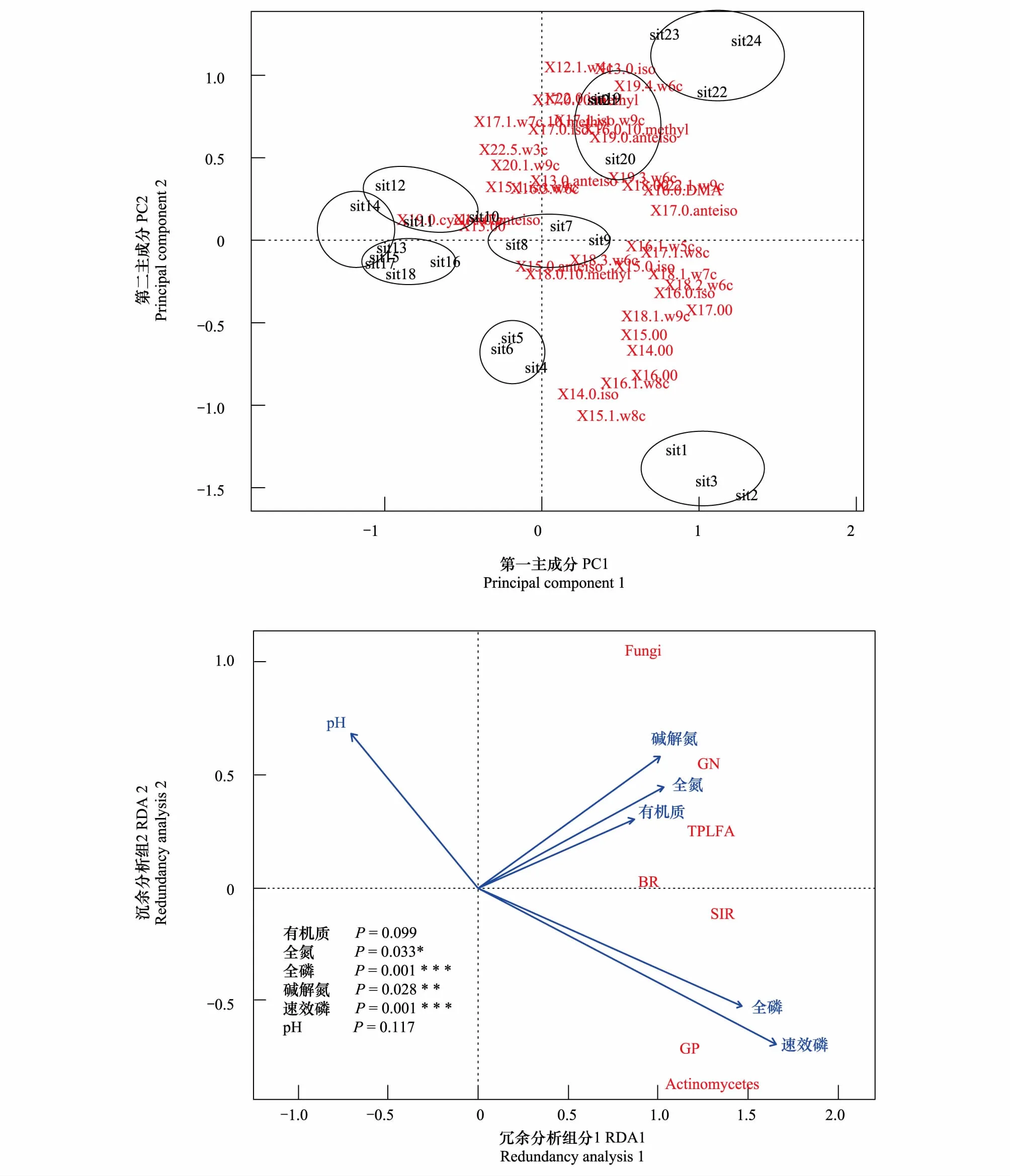
图2 0—20cm土壤各菌群磷脂脂肪酸(PLFAs)和环境因子的冗余分析Fig.2 Redundancy analysis of soil microbial PLFAs in 0—20cm and environmental variables CK样地包括sit1、sit2、sit3;N样地包括:sit4、sit5、sit6;P样地包括:sit7、sit8、sit9;M样地包括:sit10、sit11、sit12;NP样地包括:sit13、sit14、sit15;NM样地包括:sit16、sit17、sit18;PM样地包括:sit19、sit20、sit21;NPM样地包括: sit22、sit23、sit24。TPLFA:Total PLFA代表总PLFA含量,GP:Gram Positive代表革兰氏阳性菌PLFA含量,GN:Gram Negative代表革兰氏阴性菌PLFA含量,Fungi:真菌PLFA含量,Actinomycetes:放线菌PLFA含量,BR:基础呼吸强度,SIR:诱导呼吸强度;******依次表示P≤0.001,0.001 在0—20cm土层中,以土壤微生物和土壤性质为因子进行冗余分析,土壤性质选取土壤有机碳(TOC)、总氮(TN)、总磷(TP)、碱解氮、pH、速效磷(aP)6个环境因子,对不同施肥处理的土壤微生物特性进行冗余分析。其中,第一轴解释了58.46%的变异,第二轴解释了4.7%的变异(如图2)。结果表明,土壤因子中全磷和速效磷对于土壤微生物特性产生极显著影响,全氮和碱解氮对微生物性质产生显著影响。由图2可知,pH对微生物性质有负向作用。 在20—40cm土层中,对施肥处理样地的土壤微生物群落PLFAs进行主成分分析,结果表明(图3),主成分1(PC1)对总PLFAs数据变异的贡献率为19.63%,主成分2(PC2)对总PLFAs数据变异的贡献率为17.16%,累计贡献率为36.79%。主成分1和主成分2基本上能把不同施肥处理区分开,但是对照CK与NP配施出现分布重合。 在20—40cm土层中,同样以土壤微生物和土壤性质为因子进行冗余分析,土壤性质选取土壤有机碳(TOC)、总氮(TN)、总磷(TP)、碱解氮、pH、速效磷(aP)6个环境因子,对不同施肥处理的土壤微生物特性进行冗余分析。其中,第一轴解释61.6%的变异,第二轴解释14.96%的变异(如图3)。结果表明,土壤因子中速效磷对于土壤微生物特性产生极显著影响,有机质、全磷和碱解氮对微生物性质产生显著影响。由图3可知,与0—20cm土层一致,pH对微生物性质有负向作用。 图3 20—40cm土壤各菌群磷脂脂肪酸(PLFAs)和环境因子的冗余分析Fig.3 Redundancy analysis of soil microbial PLFAs in 20—40cm and environmental variableCK样地包括sit1、sit2、sit3;N样地包括:sit4、sit5、sit6;P样地包括:sit7、sit8、sit9;M样地包括:sit10、sit11、sit12;NP样地包括:sit13、sit14、sit15;NM样地包括:sit16、sit17、sit18;PM样地包括:sit19、sit20、sit21;NPM样地包括: sit22、sit23、sit24。TPLFA:Total PLFA代表总PLFA含量,GP:Gram Positive代表革兰氏阳性菌PLFA含量,GN:Gram Negative代表革兰氏阴性菌PLFA含量,Fungi:真菌PLFA含量,Actinomycetes:放线菌PLFA含量,BR:基础呼吸强度,SIR:诱导呼吸强度。******依次表示P≤0.001,0.001 本研究发现,0—20cm土壤微生物的呼吸强度以及土壤微生物PLFA含量均比20—40cm土层高(图1,表1),但两个土层各指标的变化趋势基本一致。其主要原因是,有机和无机肥料施于0—20cm表层土壤,对微生物产生直接影响,并且这一土层是耕作层,植物根系多分布于这一土层,可以满足微生物的生长和繁殖需要,但是20—40cm土层中改变微生物特性的物质来自于表层物质下渗[21],其对土壤微生物特性的影响结果不如表层明显。 在0—20cm土层和20—40cm土层中,单施N显著提高土壤呼吸、G-和总磷脂脂肪酸含量,而对其他土壤微生物群落的脂肪酸含量影响不显著。这可能是由于细菌C/N比真菌更低,这使细菌有更强的利用低C/N有机质的能力[22],施用N增加土壤氮的有效性,碳氮比降低,细菌更适应由于氮添加导致土壤C/N降低的环境而增加。目前长期施用N肥对土壤微生物群落影响的结果不尽一致。Bardgett等[23]发现,施用氮肥可能通过改变土壤养分有效性促进细菌生长,从而影响微生物群落。Yu等[24]的研究则指出,氮肥对真菌的促进作用最明显。高明霞等[25]研究表明,长期施用N对于提高提高微生物多样性没有显著作用。白震等[26]研究表明,单施N不仅对细菌或真菌无显著影响,甚至对于微生物活性和结构影响都比较小。这可能是因为长期施用无机氮肥,使土壤的C/N比降低,加速了土壤中原有有机碳的分解,导致土壤中积累的有机碳总量较少,从而不利于微生物的积累[27]。并且不同地区土壤类型不同以及施肥种类和方式的多样性也能导致单施氮肥结果的差异。 在0—20cm土层中,单施P能提高微生物的活性、显著增加G-、放线菌和总PLFA含量;在20—40cm土层中,单施P能显著提高土壤微生物的G-和总PLFA含量。氮磷有机肥配施的革兰氏阳性菌、革兰氏阴性菌以及总PLFA含量均低于磷肥有机肥配施,主要原因是供试土壤作物的主要限制因子是P。施瑶等[28]在内蒙古草原进行6a的氮磷添加实验,发现磷添加有助于提高土壤总磷脂脂肪酸、细菌、放线菌的磷脂脂肪酸含量。Li等[29]发现磷肥能够增加真菌、细菌的PLFA的含量,但是真菌PLFA含量比细菌增加的快。这些与本试验的研究结果基本一致。通过冗余分析发现,施入的磷肥主要是以速效磷的形式对植物及微生物产生作用,与白震等研究结果一致[30]。并且根据RDA分析,在0—20cm土层,主要是通过全磷和速效磷对微生物群落结构变化起驱动作用,在20—40cm土层,主要通过速效磷对微生物群落结构变化起驱动作用。这可能是由于黄土丘陵区土壤贫瘠,缺乏磷肥,所以施用磷肥能对微生物群落产生显著的影响。本试验结果表明氮磷肥混施对微生物群落结构的影响不显著,与白震等[30]氮磷肥配施对微生物活性与结构影响较小的结果相一致。但Kamaa等[13]研究表明,氮磷混施抑制细菌的微生物群落结构。 在0—20cm土层,M对土壤呼吸没有显著影响;但在20—40cm土层中,单施有机肥显著提高了土壤的诱导呼吸。单施M显著提高0—20cm土层的G-和总PLFA含量;但在20—40cm土层,M并未对土壤微生物PLFA含量产生显著性影响。通过三因素方差分析,结果表明有机肥这个因素在整个实验中对0—20cm的土壤微生物PLFA含量产生显著的影响,对20—40cm土层除真菌外的微生物PLFA含量产生显著影响。张焕君等[16]在潮土的研究中发现,有机肥的长期施用提高了土壤微生物PLFA含量和细菌量却抑制放线菌的生长。Zhong等[31]认为有机肥施用会显著增加土壤细菌和放线菌的生物量。张奇春等[32]采用室内恒温培养法发现施用有机肥显著增加了土壤微生物群落结构的多样性。分析其产生影响可能原因有:(1) 有机肥的施用提高了土壤中有机质的含量,而有机质既含有相当数量的碳、氮、磷、钾等营养元素,又具有改善土壤理化性状和土壤的结构、提高土壤肥力的作用,为微生物生长提供了良好的环境,从而促进微生物结构的多样性和活性[33];(2) 有机肥本身含有大量活的微生物、活性有机碳源和能源,会起到“接种”和“导入”作用[34]。 本试验结果表明,有机无机肥配施对土壤微生物活性及结构影响显著。Yuan等[35]对施肥超过25年的稻田进行研究,发现有机无机混施能增加微生物群落多样性。这与本试验的结果相一致,与其他施肥处理相比,有机无机混施,明显改变微生物的群落结构。有机无机肥配合施用能提高微生物活性及改变微生物群落结构的原因是施肥增加根系生物量及根系分泌物,促进微生物生长繁殖,使土壤微生物量碳、氮含量明显高于单施化肥的处理[36]。因此,长期有机无机肥配施能通过提高土壤细菌多样性,并改变土壤细菌和真菌的群落结构,提高土壤酶活性,进而提高了农田生态系统的生产力并对生态系统健康有改善作用[2]。 由于黄土丘陵区土壤贫瘠,土壤质量较差,通过分析可知P作为本区土壤的限制因子,施加P显著增加土壤呼吸强度,改变了微生物群落结构,并且施用P肥以速效磷形式对微生物特性的变化起主要驱动作用。在黄土丘陵区农田,长期施用NPM有助于提高土壤微生物的特性,从而改善了土壤的生态环境,进而增强农田生态系统的稳定和健康。建立科学的施肥制度,通过有机无机配施等培肥措施提高土壤肥力的同时改善土壤生物学特性对于促进土壤生态系统稳定性、健康以及粮食产量有重要意义。 参考文献(References): [1] 陈磊, 郝明德, 张少民. 黄土高原长期施肥对小麦产量及肥料利用率的影响. 麦类作物学报, 2006, 26(5): 101- 105. [2] Chen Y P, Wang K B, Lin Y S, Shi W Y, Song Y, He X H. Balancing green and grain trade. Nature Geoscience, 2015, 8(10): 739- 741. [3] Marschner P, Kandeler E, Marschner B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biology and Biochemistry, 2003, 35(3): 453- 461. [4] 胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展. 土壤通报, 2006, 37(1): 170- 176. [5] 李娟, 赵秉强, 李秀英, 姜瑞波, So H B. 长期不同施肥制度下几种土壤微生物学特征变化. 植物生态学报, 2008, 32(4): 891- 899. [6] 臧逸飞, 郝明德, 张丽琼, 张昊青. 26年长期施肥对土壤微生物量碳、氮及土壤呼吸的影响. 生态学报, 2015, 35(5): 1445- 1451. [7] 徐一兰, 唐海明, 肖小平, 郭立君, 李微艳, 孙继民. 长期施肥对双季稻田土壤微生物学特性的影响. 生态学报. 2016, 36(18): 5847- 5855. [8] 唐海明, 肖小平, 李微艳, 孙耿, 程凯凯. 长期施肥对双季稻田根际土壤微生物群落功能多样性的影响. 生态环境学报, 2016, 25(3): 402- 408. [9] 樊晓刚, 金轲, 李兆君, 荣向农. 不同施肥和耕作制度下土壤微生物多样性研究进展. 植物营养与肥料学报, 2010, 16(3): 744- 751. [10] 李东坡, 武志杰, 陈利军. 有机农业施肥方式对土壤微生物活性的影响研究. 中国生态农业学报, 2005, 13(2): 99- 101. [11] Bhattacharyya P, Chakrabarti K, Chakraborty A. Microbial biomass and enzyme activities in submerged rice soil amended with municipal solid waste compost and decomposed cow manure. Chemosphere, 2005, 60(3): 310- 318. [12] 李晨华, 贾仲君, 唐立松, 吴宇澄, 李彦. 不同施肥模式对绿洲农田土壤微生物群落丰度与酶活性的影响. 土壤学报, 2012, 49(3): 567- 574. [13] Kammaa M, Mburu H, Blanchart E, Chibole L, Chotte J L, Kibunja C, Lesueur D. Effects of organic and inorganic fertilization on soil bacterial and fungal microbial diversity in the Kabete long-term trial, Kenya. Biology and Fertility of Soil, 2011, 47(3): 315- 321. [14] Zheng S X, Hu J L, Jiang X F, Ji F Q, Zhang J B, Yu Z N, Liu X G. Long-term fertilization regimes influence FAME profiles of microbial communities in an arable sandy loam soil in Northern China. Pedobiologia, 2013, 56(4/6): 179- 183. [15] Yu W T, Bi M L, Xu Y G, Zhou H, Ma Q, Jiang C M. Microbial biomass and community composition in a Luvisol soil as influenced by long-term land use and fertilization. CATENA, 2013, 107: 89- 95. [16] 张焕军, 郁红艳, 丁维新. 长期施用有机无机肥对潮土微生物群落的影响. 生态学报, 2011, 31(12): 3308- 3314. [17] 陆海飞, 郑金伟, 余喜初, 周惠民, 郑聚锋, 张旭辉, 刘晓雨, 程琨, 李恋卿. 长期无机有机肥配施对红壤性水稻土微生物群落多样性及酶活性的影响. 植物营养与肥料学报, 2015, 21(3): 632- 643. [18] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2001. [19] Hueso S, Hernández T, García C. Resistance and resilience of the soil microbial biomass to severe drought in semiarid soils: The importance of organic amendments. Applied Soil Ecology, 2011, 50: 27- 36. [20] Frostegard A, Baath E, Tunlid A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis. Soil Biology and Biochemistry, 1993, 25(6): 723- 730. [21] Li C H, Yan K, Tang L S, Jia Z J, Li Y. Change in deep soil microbial communities due to long-term fertilization. Soil Biology and Biochemistry, 2014, 75: 264- 272. [22] 赵超, 王文娟, 阮宏华, 葛之葳, 徐长柏, 曹国华. 氮添加对杨树人工林表层土壤微生物群落结构的影响. 东北林业大学学报, 2015, 43(6): 83- 88. [23] Bardgett R D, Lovell R D, Hobbs P J, Jarvis S C. Seasonal changes in soil microbial communities along a fertility gradient of temperate grasslands. Soil Biology and Biochemistry, 1999, 31(7): 1021- 1030. [24] Yu C, Hu X M, Deng W, Li Y, Xiong C, Ye C H, Han G M, Li X. Changes in soil microbial community structure and functional diversity in the rhizosphere surrounding mulberry subjected to long-term fertilization. Applied Soil Ecology, 2015, 86: 30- 40. [25] 高明霞, 孙瑞, 崔全红, 杨学云, 张树兰, 孙本华. 长期施用化肥对塿土微生物多样性的影响. 植物营养与肥料学报, 2015, 21(6): 1572- 1580. [26] 白震, 张明, 闫颖, 郑立臣, 张旭东. 长期施用氮、磷及有机肥对农田黑土PLFA的影响. 浙江大学学报: 农业与生命科学版, 2008, 34(1): 73- 80. [27] Parham J A, Deng S P, Da H N, Sun H Y, Raun W R. Long-term cattle manure application in soil. II. Effect on soil microbial populations and community structure. Biology and Fertility of Soils, 2003, 38(4): 209- 215. [28] 施瑶, 王忠强, 张心昱, 孙晓敏, 刘希玉, 何念鹏, 庾强. 氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响. 生态学报, 2014, 34(17): 4943- 4949. [29] Li J, Li Z A, Wang F M, Zou B, Chen Y, Zhao J, Mo Q F, Li Y W, Li X B, Xia H P. Effects of nitrogen and phosphorus addition on soil microbial community in a secondary tropical forest of China. Biology and Fertility of Soils, 2015, 51(2): 207- 215. [30] 白震, 张明, 宋斗妍, 刘宁, 张旭东. 长期施肥对农田黑土微生物群落的影响. 中国科学院研究生院学报, 2008, 25(4): 479- 486. [31] Zhong W H, Gu T, Wang W, Zhang B, Lin X G, Huang Q R, Shen W S. The effects of mineral fertilizer and organic manure on soil microbial community and diversity. Plant and Soil, 2010, 326(1/2): 511- 522. [32] 张奇春, 王雪芹, 时亚南, 王光火. 不同施肥处理对长期不施肥区稻田土壤微生物生态特性的影响. 植物营养与肥料学报, 2010, 16(1): 118- 123. [33] Debosz K, Rasmussen P H, Pedersen A R. Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils: effects of organic matter input. Applied Soil Ecology, 1999, 13(3): 209- 218. [34] 郭芸, 孙本华, 王颖, 魏静, 高明霞, 张树兰, 杨学云. 长期施用不同肥料塿土PLFA指纹特征. 中国农业科学, 2017, 50(1): 94- 103. [35] Yuan H Z, Ge T D, Zhou P, Liu S L, Roberts P, Zhu H H, Zou Z Y, Tong C L, Wu J S. Soil microbial biomass and bacterial and fungal community structures responses to long-term fertilization in paddy soils. Journal of Soil and Sediments, 2013, 13(5): 877- 886.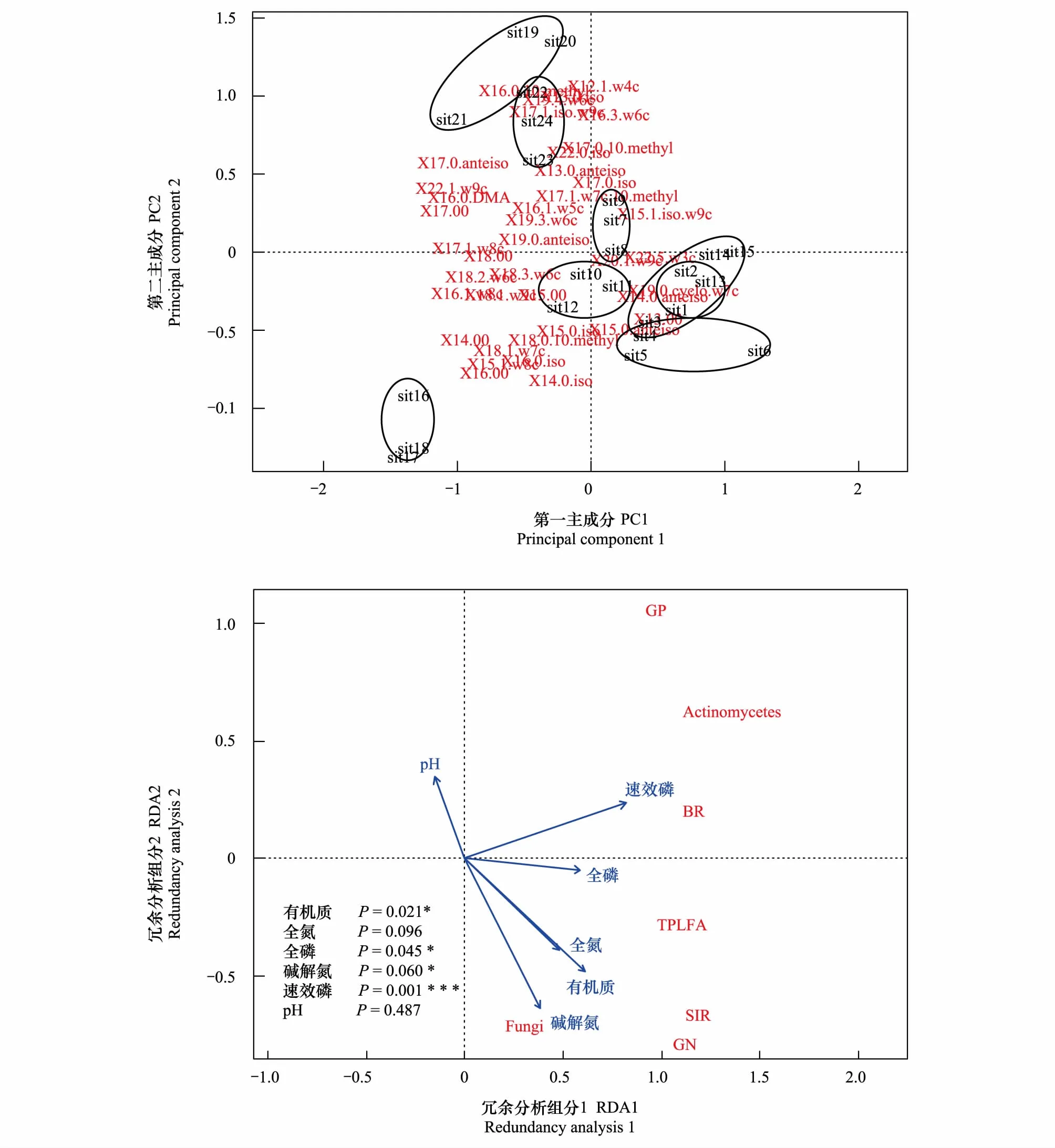
3 讨论
3.1 N对于微生物特性的影响
3.2 P对于微生物特性的影响
3.3 M对于微生物特性的影响
4 结论

