杉木叶形态特征与叶面积估算模型
彭 曦, 闫文德,王光军, 赵梅芳,*
1 中南林业科技大学, 生命科学与技术学院, 长沙 410004 2 湖南会同杉木林国家重点野外科学观测研究站, 会同 418307 3 南方林业生态应用技术国家工程实验室, 长沙 410004
植物叶片被认为是碳水交换和能量平衡过程最重要的场所[1],叶片各工作环节对外界环境的响应特点、功能发挥、协调机制和权衡策略,以及其结构建成和形态变异成为近年来的研究热点。目前对叶片结构的研究已经从单株植物的叶片功能性状扩展到群落冠层、区域生产经营、甚至全球尺度下的生物功能地理参考量,为全球生产力变化和代谢理论提供依据和验证[2-3]。植物叶面积(Leaf area,LA)是指植物单叶或总平均叶片的单面投影面积[4],以LA为基础转换成的相关指标,包括比叶面积(Specific leaf area,SLA,单叶面积/叶干重,cm2/g)、林分叶面积指数(Leaf area index,LAI,叶面积/土地面积,m2/m2),植被季节性叶面积动态(NDVI)等,叶面积大小能直接影响叶片光截取和碳获取能力,是作物育种、农林生产经营、模型估算以及物种结构变异-功能适应机理分析的关键参考量。
LA与植物光合、呼吸、蒸腾等生理生态过程密切相关,因此常被用来对农作物和果树进行品种选育和性状培育,以及估算农作物产量和森林生产及其影响机制,初步探讨生态系统服务功能[5- 7],促进农林生产经营。基于冠层光合模型[8]、生物量模型[9-10]、全球植被动力学模型(DGVM)[11]、生物地球化学循环过程模型(Biome-BGC)[12-13]等生态学模型研究,LA与其相关的指标都作为植物重要特征参数参与模型估算输入与输出。还有研究通过对叶化石的LA等形态学指标测量来重建古气候历史和叶的进化[14-16],以及对叶形态指标单独或联合研究来解释个体在不同环境下的可塑性和适应机制[17-18],以此来分析物种结构变异-功能适应机理[3,19-21]等。但SLA和LAI的值受叶大小的影响较大[22-23],叶面积准确测定是研究植物光合生产和生理生态等过程的基础,因此,精确的LA值及其测量具有重要意义。
杉木(Cunninghamialanceolata)作为我国分布最为广泛的造林树种,对杉木LA研究主要集中在与林分生产和生物量之间的关系[9-10]。杉木叶片呈披针状,单叶小而多。已有报道的通过仪器间接测量的松类LA处于2.242—4.364 cm2[22],仅有研究实测杉木单叶LA处于0.6873—1.316 cm2[24-25]。杉木SLA通过模型预测处于37—50 cm2/g[10, 26],手工实测值为79.1 cm2/g[23]。而被报道的杉木LAI实测和模型估算值都在0.02—6.34 m2/m2之间[9-10, 23, 26],通过遥感数据模型估算的NDVI信息值在0.16—0.71之间[27]。杉木LA值的不确定性大,有碍于生产经营高效性、风险评估有效性及相关科学研究进展,其LA的测量难度大是造成其值的不确定性的原因之一。
LA测量可以分为人工测量法和仪器测量法。人工测量法消耗人力物力较多,不适用于大批量的LA测定,但结果可靠[28],常用于检验和校准间接测量结果。仪器测量法对样本有选择性[29],且受叶片自身平整度以及测量视角的不同而影响精度[30],且若样品残缺较大,也会产生较大的误差。目前国内外地面实测工作大多采用仪器测量方法,缺乏人工测量方法校验,不同方法之间缺乏比较。LA的测定也可基于简单易测量的指标叶长和叶宽,或是二者的综合指标如长宽比、周长等进行回归模型预测[31],已有大量研究进行广泛验证,并认为该方法高效快捷。预测模型一般仅选用单变量模型或多变量模型,对两种模型同时进行比较研究较少,且样本大多集中在农产品[32-37]、果树[38-40]、花卉[41- 42]等,以及阔叶常绿乔木[43-45]等,它们都属于阔叶规则叶树种,相对针叶树种而言叶形态指标测定更简便。目前基于叶形态指标对针叶树种建立叶面积估算模型的研究鲜有报道。
本研究对杉木LA测定采用游标卡尺法和手持叶面积仪法对杉木单叶LA进行同时测量,得到叶长(Leaf length,LL)、平均叶宽(Mean leaf width,LWmean)、最大叶宽(Max leaf width,LWmax)、平均叶厚(Mean leaf thickness,LTmean)、最大叶厚(Max leaf thickness,LTmax)、叶面积(Leaf area,LA)、叶周长(Leaf perimeter,LP)、叶延长率(Leaf elongation,LE)8个形态学指标,分别通过多变量线性模型和单变量非线性模型构建杉木LA估算模型。无论对校准仪器测量结果还是利用杉木LA准确估测其他叶功能性状指标,以及促进相关的连续性研究都具有现实意义,并且补充杉木单叶面积数据空白,提高杉木叶面积估算模型精度及稳定性,为今后杉木树种研究及提高杉木人工林经营管理提供基础数据,为验证和完善其他树种的叶片性状及其叶片功能性状的测定提供借鉴意义。
1 材料与方法
1.1 研究地概况
本研究试验设在中国杉木中心产区的湖南会同杉木林生态系统国家野外科学观测研究站(109°45′E, 26°50′N)和非中心产区的河南信阳南湾实验林场(113°58′E, 31°53′N),其海拔高度范围分别为270—400、300—1100 m,均系低山地丘陵地貌。湖南会同与河南信阳同属于亚热带季风气候,气候温和,年均温在15.1—16.8℃间,年均相对湿度均在77%以上,雨热同期,年均降水量分别为1304.2 mm和1106 mm,雨水集中在夏季,日照充沛,年日照时数均在1900 h以上。湖南会同林分密度约为2400株/hm2,河南信阳约为1500—1800株/hm2,且土壤类型均为山地黄壤,其光照和水热条件均适宜杉木生长。
1.2 研究方法

图1 用于形态指标测定的杉木小叶示例 Fig.1 Examples of leaf morphological traits measurements of C. lanceolata
于杉木生长旺盛期4月在湖南会同和河南信阳的不同林龄(幼龄林、中龄林、近熟林、成熟林)中设置样方(10 m×10 m),LA主要受林分的光照和水分等多重影响[46-47],因此在每个样方内随机选取3株杉木,为保持叶龄序列,分别在树冠上层、中层、下层随机采集生长健康、无病虫害的杉木整枝。为防止叶片失水,将采集样品尽快带回实验室。由于杉木叶形不是常规的针叶形,将每束针叶近似假设成圆柱体对针叶树种进行叶面积直接测量的方法并不适用[23,48]。我们选择对杉木每片单叶进行逐个测量,在每个枝条上随机选择三片小叶,逐一编号并通过两种方法分别测定小叶形态指标(图1)。(1)游标卡尺法:用游标卡尺(精确到0.002 cm)分别测量杉木小叶的LL(叶连接叶柄的最底端到叶梢的距离),小叶1/4、1/2、3/4长处的LW和LT[49],每处重复3次取平均值作为该处的LW和LT,计算3处平均值的均值作为该叶片的LW和LT,求得LL、LWmean、LWmax、LTmean和LTmax等5个直接测量指标。将杉木小叶的投影面积近似看做矩形,将LL与LWmean的乘积算得LA,LL与LWmean和的两倍为LP,LL/LWmean算得LE,得到3个间接转算指标。(2)手持叶面积仪法(Yaxin- 1242),得到LL(精确到0.1cm)、LWmean(精确到0.01 cm)等2个直接测量指标,以及LA(精确到0.001 cm2)、LP(精确到0.01 cm)、LE(保留三位小数)3个间接转算指标。
1.3 模型选择和拟合
为了构建不同形态指标与LA最佳拟合估算模型,采用多变量线性回归模型和非线性回归指数模型进行模型拟合。首先,为了探索不同指标对LA的影响和贡献量,选择综合指标共同作用的多变量线性模型:Y=a+∑biXi,i=1—7,并且通过逐步法对变量筛选进行模型优化。为了探究不同指标单独对LA的估算,根据散点图分布情况,采用单变量非线性回归指数模型:LA=a×(1 +X)b,通过对校正的决定系数(R2)、卡方(2)和显著性(P)综合参考,对变量拟合和研究,并且筛选出最佳拟合指标。
1.4 数据分析
数据进行初步的整理在Microsoft Excel 2010上进行,数据分析和模型拟合用IBM SPSS Statistics 21.0,作图在R软件上完成。
2 结果与分析
2.1 杉木叶形态指标的生态特征
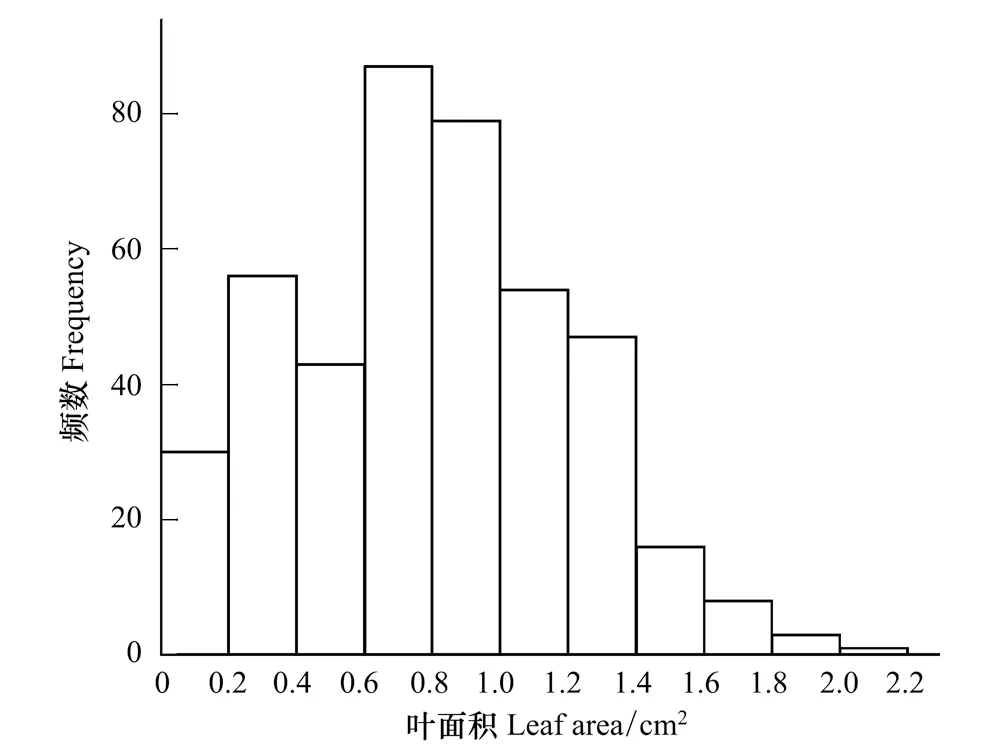
图2 杉木单叶面积频数分布Fig.2 Frequency distribution of leaf area of C. lanceolata
在LL、LWmean、LWmax、LTmean、LTmax、LA、LE和LP等8个指标实测值的分布中(表1),变异系数大小为LA>LTmax>LTmean>LE>LL>LP>LWmean>LWmax,其中LA的变异程度最大(CV=0.513),均值为(0.797±0.409)(SD)cm2(图2),数值大致分布在(0.758—0.836)cm2(95%CI)。LTmax和LTmean两个指标变异度仅次于LA(CV=0.489, 0.465),LTmax和LTmean均值分别为(0.032±0.016) cm和(0.028±0.013) cm,但数值分布集中呈现明显的尖峰态(峰度分别为16.383和13.851),数据分布与均值最接近(LTmax和LTmean的MAD、SE、95%CI分别0.011、0.001、0.03—0.034和0.009、0.001、0.027—0.029)。LE、LL、LP3个指标变异系数接近(CV=0.414, 0.411, 0.398),其中LE数值分布范围最大且值偏差最大(0.526—33.495,MAD=4.628,SE=0.292,95%CI为13.941—15.087)。LL和LP的数值分布总体分布稳定,和平均值相差不大(MAD分别为1.071和2.19)。变异程度最小为衡量叶宽的两个指标LWmean和LWmax(CV=0.238, 0.224),二者数值波动和偏差都较小,分布集中,LWmean和LWmean的范围、MAD、SE和95%CI分别为0.11—0.486 cm和0.8—0.377 cm,0.051和0.043,0.003和0.003,0.284—0.297 cm和0.227—0.238 cm。
2.2 形态学指标相关性
通过对杉木叶形态学指标相关性(Pearson)分析(表2)发现不同指标对LA的直接影响或间接影响。LA除了与LE、LP线性相关程度较弱(r=0.292,0.244),与其他指标都呈不同程度的显著线性正相关性。其中LA与LL、LTmean呈强线性正相关(r=0.896, 0.911),LL与LTmean也成极显著线性正相关(r=0.999);LA与LWmean、LTmax呈较强线性正相关(r=0.682, 0.709),LWmean与LTmax之间也呈极强线性正相关(r=0.94)。因此,LA与LTmean、LTmax可能是由于LL和LWmean的影响而成伪相关。除了LWmax与LE、LP几乎不呈相关性(r分别为0.073和0.041),其余指标间都呈不同程度的显著相关性。LWmax与LWmean、LTmax两个指标间呈现唯一的负相关,但相关程度较弱(r=-0.29,r=-0.201)。LE、LP与其他指标之间线性相关都较弱(r<3.5),但二者之间呈极显著的线性正相关(r=0.946)。
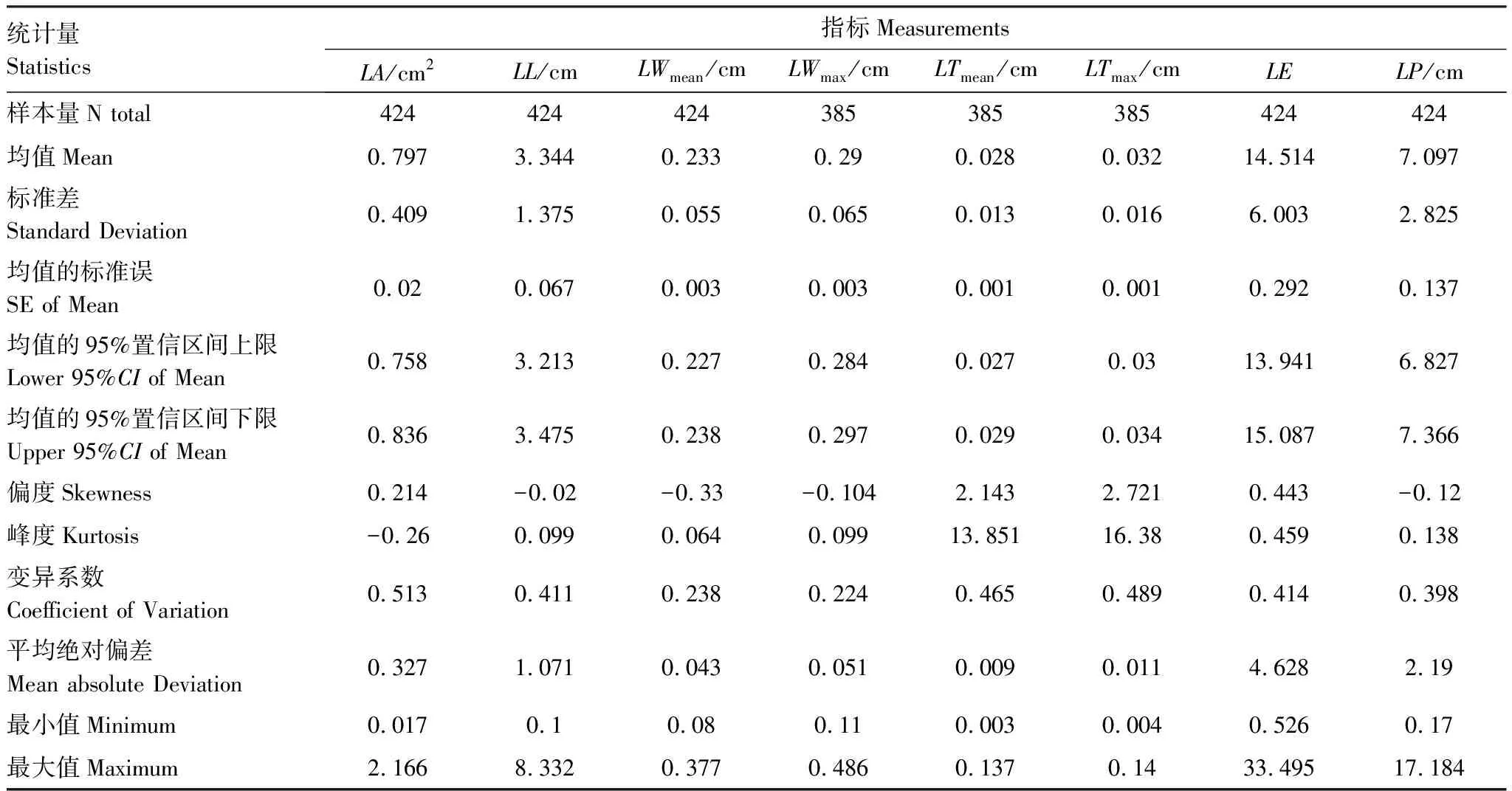
表1 杉木叶片形态指标值总体分布特征
注:LA:叶面积,leaf area;LL:叶长,leaf length;LWmean:平均叶宽,leaf mean width;LWmax:最大叶宽,leaf maximum width;LTmean:平均叶厚,leaf mean thickness;LTmax:最大叶厚,leaf maximum width;LE:叶延长率,leaf elongation;LP:叶周长,leaf perimeter
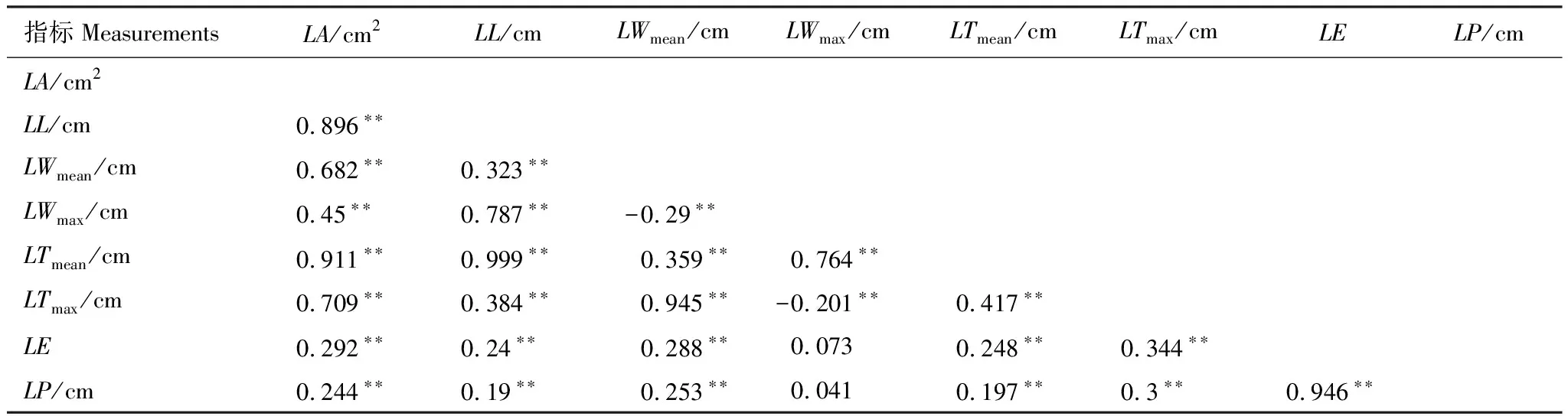
表2 杉木叶片形态学指标相关性(Pearson)分析
**在P=0.05水平上表现显著性差异。LA:叶面积,leaf area;LL:叶长,leaf length;LWmean:平均叶宽,leaf mean width;LWmax:最大叶宽,leaf maximum width;LTmean:平均叶厚,leaf mean thickness;LTmax:最大叶厚,leaf maximum width;LE:叶延长率,leaf elongation;LP:叶周长,leaf perimeter
2.3 杉木叶面积多元回归模型
将LL、LWmean、LWmax、LTmean和LTmax、LE、LP等7个指标与LA进行多变量线性拟合和优化,由上述杉木叶形态学指标相关性(Pearson)分析(表2)得出LL与LTmean存在的极强显著相关性(r=0.999),且大于LL与LA的相关性(r=0.896),这违背了变量间的相互独立原则,为了避免多重共线性带来的影响,在多变量线性回归时,指标LL被排除。
如表3,首先,选择全入法构建多变量线性回归方程模型1:
Y=-0.397+0.164X1-0.022X2+1.253X3+0.24X4-1.416X5+0.854X6(R2=0.981,SE=0.053),其中X1—X6分别为LP、LE、LWmean、LWmax、LTmean、LTmax。
虽然模型拟合度很好(R2=0.981),但存在3个回归系数不显著的指标LWmax、LTmean、LTmax(P=0.074, 0.031, 0.11)。为使方程达到最优,选择逐步法再次构建多变量线性回归方程。模型2 以LP为自变量得到:Y=-0.174+0.138X(R2=0.83,SE=0.157);继续引入变量LE得到模型3:Y=-0.076+0.207X1-0.041X2(R2=0.977,SE=0.058),X1、X2分别为LP和LE;进一步引入变量LWmean得到模型4:Y=-0.388+0.165X1-0.023X2+1.453X3(R2=0.981,SE=0.053),X1—X3分别为LP、LE、LWmean,此时LWmax、LTmean、LTmax由于指标不显著被排除(P>0.01),模型4以最少的变量达到最大的拟合优度(R2=0.981),模型达到最优。
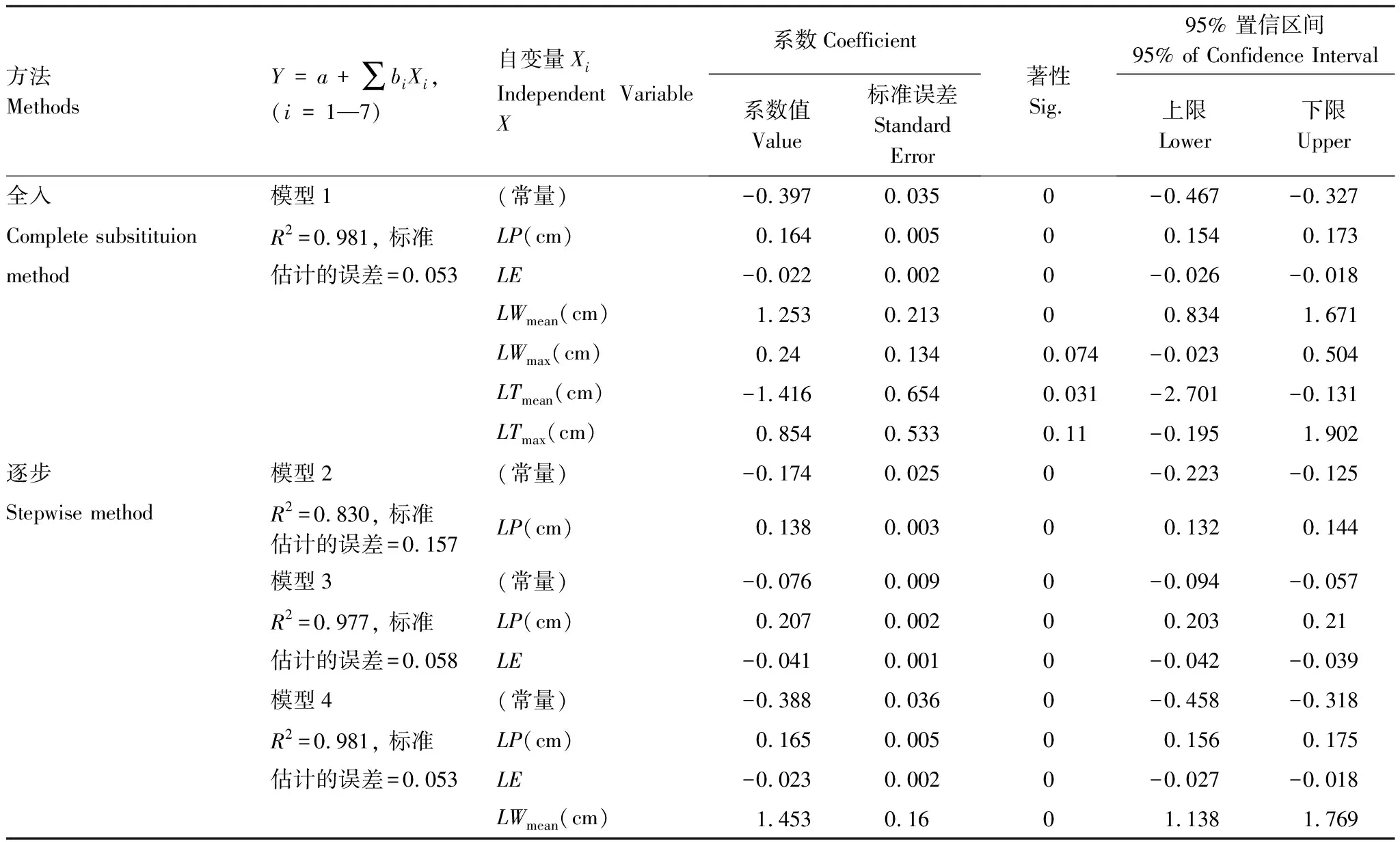
表3 杉木形态学指标多变量线性回归
2.4 杉木叶面积指数模型
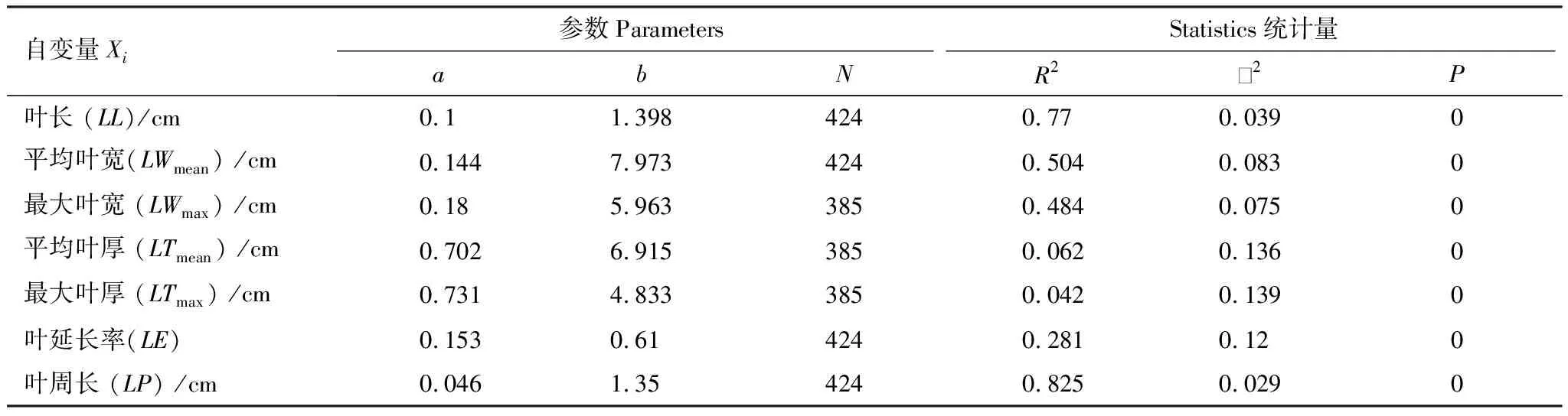
表4 杉木叶面积指数模型
N= Number of Points;R2=Adj;R-Square;2=Reduced Chi-Sqr
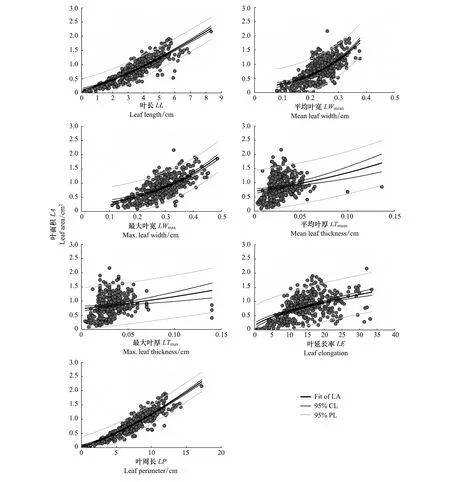
图3 杉木叶面积指数非线性拟合Fig.3 Nonlinear fitting of Chinese fir leaf areaFit of LA:叶面积拟合线,Fit of leaf area;95% CL:95%置信区间线,95% confidential line;95% PL:95% probability line
2.5 杉木叶面积估算模型检验
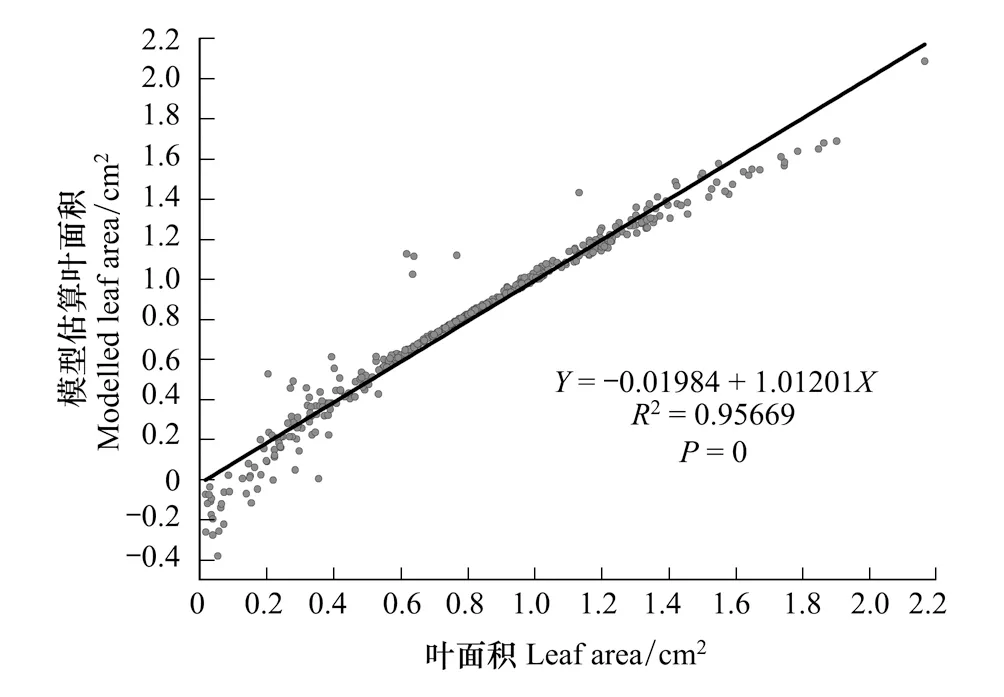
图4 杉木叶面积实测值与表3中多元线性回归模型4的估算值的关系Fig.4 Relationship between measured and estimated leaf area when leaf area was modeled implicitly with leaf perimeter, leaf elongation and leaf mean width (multiple linear regression model 4 referred in Table 3)
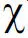
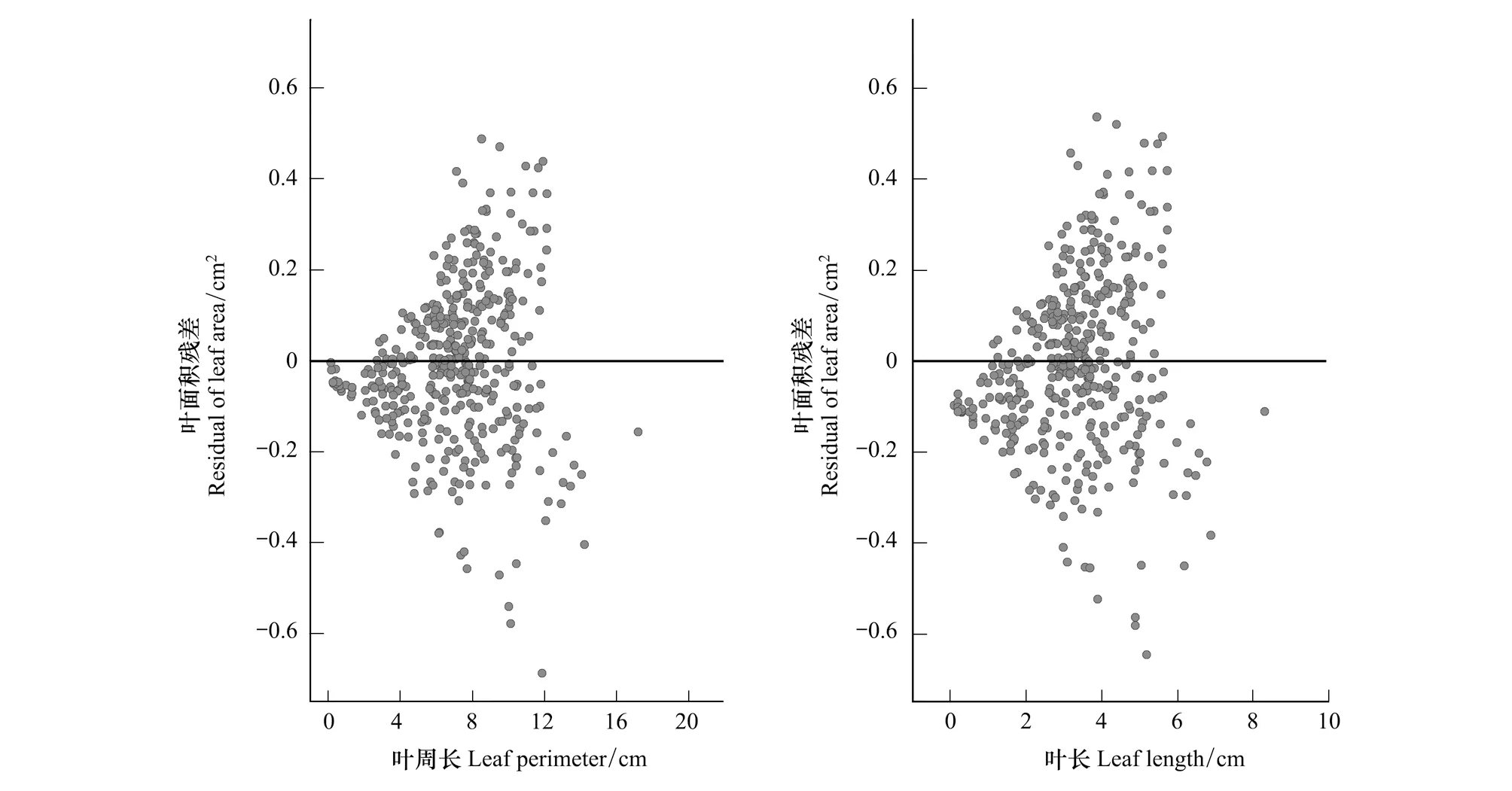
图5 基于叶周长和叶长的叶面积非线性拟合模型残差图Fig.5 Residual of leaf area based on leaf perimeter and leaf length nonlinear fitting models
3 讨论
3.1 杉木叶面积特征
相对其他形态学指标,杉木的LA变异(CV=0.513)最大,这与对南方四种阔叶树种的形态学指标变异分析的结果相同[43, 50],原因可能由于LA度量单位为平方厘米,因此测量方法导致的误差相对其他指标贡献更大。且杉木单叶为狭长的披针状,其LL的变异程度较LW更大(CV=0.411, 0.238),通过相关性(Pearson)分析(表2)发现LL也为LA的变异提供了更多的解释空间(r=0.896),这与已有对阔叶的研究发现不同,已有研究认为阔叶的LW对LA的变异程度有近90%的解释力度,比LL(75%)更大[32]。可见不同叶形下,LL和LW对LA的影响和贡献量不同。已有研究对杉木的LA的测量范围在0.6873—1.316 cm2,标准差分布在0.136—0.316 cm2之间[24-25],本研究杉木LA的95%CI范围在0.758—0.836 cm2,而本研究的有效值的范围相比已有研究更精确,但标准偏差偏大(SD=0.409),原因可能是由于已有研究的样本主要是一棵树的50—60杉木叶片,而本研究的样本在不同林龄、不同冠层和不同叶龄皆有分布,跨度相对已有研究更广,且手工测量误差较小,因此有效值更精确,而标准偏差较大。LT较大的变异度与集中的数值分布体现了杉木叶片LT测量的困难,要求精确度高,0.01 cm带来的影响相比其他指标更明显。但由于杉木叶片厚度测量只由人工游标卡尺测量,精确度得到保障。LE的数值偏差大是由于杉木叶较长而狭窄,而LE为通过测量LL和LWmean转算而来的比指标,因此由于测量产生的误差会比较显著,导致LE波动范围更大。LL、LP、LW的数值总体分布集中,偏差小,可能原因为杉木单叶较小,自身LL和LW相对其他树种变异小,且测量方法精确,测量方法带来的总体误差小,这为模型的建立提供依据。
LE与LP为非直接测量的转算指标,而LE和LP的转算方式与LWmax没有直接关系,因此LWmax与LE、LP几乎不呈相关性。很明显,LA会随着LL或LWmean的增大而增大,这与对常绿阔叶树种山白兰的研究相同[44],但LTmean、LTmax可能是由于LL和LWmean的影响而呈间接相关。LE和LP都是用相同的两个指标(LL、LWmean)转算而来,只是通过不同的运算方式,因此二者有明显的线性相关性。
3.2 杉木叶面积估算模型
由多变量线性回归方程发现LP、LE、LWmean对LA的直接影响最大且最显著,而由于LL在模型建立前被排除,但LP和LE都为LL和LWmean的间接转算指标,因此可以认为LL和LW都对LA的直接显著影响,已知LL和LW的值,即可以通过转算出LE和LP对叶面积进行估算。在已有研究中,LL和LW也经常作为综合指标共同对叶面积进行估算[33-35, 38, 50-54]。1.9%未拟合部分造成的可能原因是操作方法带来的误差,是可以接受的。
4 结论
参考文献(References):
[1] Niinemets Ü, Portsmuth A, Tobias M. Leaf size modifies support biomass distribution among stems, petioles and mid-ribs in temperate plants. New Phytologist, 2006, 171(1): 91- 104.
[2] Osnas J L D, Lichstein J W, Reich P B, Pacala S W. Global leaf trait relationships: mass, area, and the leaf economics spectrum. Science, 2013, 340(6133): 741- 744.
[3] Wright I J, Reich P B, Westoby M, Ackerly D D, Baruch Z, Bongers F, Cavender-Bares J, Chapin T, Cornelissen J H C, Diemer M, Flexas J, Garnier E, Groom P K, Gulias J, Hikosaka K, Lamont B B, Lee T, Lee W, Lusk C, Midgley J J, Navas M L, Niinemets Ü, Oleksyn J, Osada N, Poorter H, Poot P, Prior L, Pyankov V I, Roumet C, Thomas S C, Tjoelker M G, Veneklaas E J, Villar R. The worldwide leaf economics spectrum. Nature, 2004, 428(6985): 821- 827.
[4] Cornelissen J H C, Lavorel S, Garnier E, Díaz S, Buchmann N, Gurvich D E, Reich P B, ter Steege H, Morgan H D, van der Heijden M G A, Pausas J G, Poorter H. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide. Australian Journal of Botany, 2003, 51(4): 335- 380.
[5] Stephenson N L, Das A J, Condit R, Russo S E, Baker P J, Beckman N G, Coomes D A, Lines E R, Morris W K, Rüger N,lvarez E, Blundo C, Bunyavejchewin S, Chuyong G, Davies S J, Duque, Ewango C N, Flores O, Franklin J F, Grau H R, Hao Z, Harmon M E, Hubbell S P, Kenfack D, Lin Y, Makana J R, Malizia A, Malizia L R, Pabst R J, Pongpattananurak N, Su S H, Sun I F, Tan S, Thomas D, van Mantgem P J, Wang X, Wiser S K, Zavala M A. Rate of tree carbon accumulation increases continuously with tree size. Nature, 2014, 507(7490): 90- 93.
[6] Lizaso J I, Batchelor W D, Westgate M E. A leaf area model to simulate cultivar-specific expansion and senescence of maize leaves. Field Crops Research, 2003, 80(1): 1- 17.
[7] Luo T X, Pan Y D, Ouyang H, Shi P L, Luo J, Yu Z L, Lu Q. Leaf area index and net primary productivity along subtropical to alpine gradients in the Tibetan Plateau. Global Ecology and Biogeography, 2004, 13(4): 345- 358.
[8] Leverenz J W, Hinckley T M. Shoot structure, leaf area index and productivity of evergreen conifer stands. Tree Physiology, 1990, 6(2): 135- 149.
[9] Zhao M F, Xiang W H, Deng X W, Tian D L, Huang Z H, Zhou X L, Yu G R, He H L, Peng C H. Application of TRIPLEX model for predictingCunninghamialanceolataandPinusmassonianaforest stand production in Hunan Province, southern China. Ecological Modelling, 2013, 250: 58- 71.
[10] Zhao M F, Xiang W H, Peng C H, Tian D L. Simulating age-related changes in carbon storage and allocation in a Chinese fir plantation growing in southern China using the 3-PG model. Forest Ecology and Management, 2009, 257(6): 1520- 1531.
[11] Lucht W, Prentice I C, Myneni R B, Sitch S, Friedlingstein P, Cramer W, Bousquet P, Buermann W, Smith B. Climatic control of the high-latitude vegetation greening trend and Pinatubo effect. Science, 2002, 296(5573): 1687- 1689.
[12] Krinner G, Viovy N, de Noblet-Ducoudré N, Ogée J, Polcher J, Friedlingstein P, Ciais P, Sitch S, Prentice I C. A dynamic global vegetation model for studies of the coupled atmosphere-biosphere system. Global Biogeochemical Cycles, 2005, 19(1): GB1015.
[13] White M A, Thornton P E, Running S W, Nemani R R. Parameterization and sensitivity analysis of the BIOME-BGC terrestrial ecosystem model: net primary production controls. Earth Interactions, 2000, 4(3): 1- 85.
[14] Krieger J D, Guralnick R P, Smith D M. Generating empirically determined, continuous measures of leaf shape for paleoclimate reconstruction. Palaios, 2007, 22(2): 212- 219.
[15] Royer D L, Sack L, Wilf P, Lusk C H, Jordan G J, Niinemets Ü, Wright I J, Westoby M, Cariglino B, Coley P D, Cutter A D, Johnson K R, Labandeira C C, Moles A T, Palmer M B, Valladares F. Fossil leaf economics quantified: calibration, Eocene case study, and implications. Paleobiology, 2007, 33(4): 574- 589.
[16] Huff P M, Wilf P, Azumah E J. Digital future for paleoclimate estimation from fossil leaves? Preliminary results. Palaios, 2003, 18(3): 266- 274.
[17] Rozendaal D M A, Hurtado V H, Poorter L. Plasticity in leaf traits of 38 tropical tree species in response to light; relationships with light demand and adult stature. Functional Ecology, 2006, 20(2): 207- 216.
[18] White J W, Montes-R C. Variation in parameters related to leaf thickness in common bean (PhaseolusvulgarisL.). Field Crops Research, 2005, 91(1): 7- 21.
[19] Reich P B, Walters M B, Ellsworth D S. From tropics to tundra: global convergence in plant functioning. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(25): 13730- 13734.
[20] Kattge J, Díaz S, Lavorel S, Prentice I C, Leadley P, Bönisch G, Garnier E, Westoby M, Reich P B, Wright I J, Cornelissen J H C, Violle C, Harrison S P, van Bodegom P M, Reichstein M, Enquist B J, Soudzilovskaia N A, Ackerly D D, Anand M, Atkin O, Bahn M, Baker T R, Baldocchi D, Bekker R, Blanco C C, Blonder B, Bond W J, Bradstock R, Bunker D E, Casanoves F, Cavender-Bares J, Chambers J Q, Chapin Iii F S, Chave J, Coomes D, Cornwell W K, Craine J M, Dobrin B H, Duarte L, Durka W, Elser J, Esser G, Estiarte M, Fagan W F, Fang J, Fernández-Méndez F, Fidelis A, Finegan B, Flores O, Ford H, Frank D, Freschet G T, Fyllas N M, Gallagher R V, Green W A, Gutierrez A G, Hickler T, Higgins S I, Hodgson J G, Jalili A, Jansen S, Joly C A, Kerkhoff A J, Kirkup D, Kitajima K, Kleyer M, Klotz S, Knops J M H, Kramer K, Kühn I, Kurokawa H, Laughlin D, Lee T D, Leishman M, Lens F, Lenz T, Lewis S L, Lloyd J, Llusià J, Louault F, Ma S, Mahecha M D, Manning P, Massad T, Medlyn B E, Messier J, Moles A T, Müller S C, Nadrowski K, Naeem S, Niinemets Ü, Nöllert S, Nüske A, Ogaya R, Oleksyn J, Onipchenko V G, Onoda Y, Ordoez J, Overbeck G, Ozinga W A, Patio S, Paula S, Pausas J G, Peuelas J, Phillips O L, Pillar V, Poorter H, Poorter L, Poschlod P, Prinzing A, Proulx R, Rammig A, Reinsch S, Reu B, Sack L, Salgado-Negret B, Sardans J, Shiodera S, Shipley B, Siefert A, Sosinski E, Soussana J F, Swaine E, Swenson N, Thompson K, Thornton P, Waldram M, Weiher E, White M, White S, Wright S J, Yguel B, Zaehle S, Zanne A E, Wirth C. TRY-a global database of plant traits. Global Change Biology, 2011, 17(9): 2905- 2935.
[21] Díaz S, Kattge J, Cornelissen J H C, Wright I J, Lavorel S, Dray S, Reu B, Kleyer M, Wirth C, Prentice I C, Garnier E, Bönisch G, Westoby M, Poorter H, Reich P B, Moles A T, Dickie J, Gillison A N, Zanne A E, Chave J, Wright S J, Sheremet′ev S N S, Jactel H, Baraloto C, Cerabolini B, Pierce S, Shipley B, Kirkup D, Casanoves F, Joswig J S, Günther A, Falczuk V, Rüger N, Mahecha M D, Gorné L D. The global spectrum of plant form and function. Nature, 2016, 529(7585): 167- 171.
[22] 刁军, 国红, 卢军, 雷相东, 唐守正. 油松针叶面积估计模型及比叶面积的研究. 林业科学研究, 2013, 26(2): 174- 180.
[23] 李轩然, 刘琪璟, 蔡哲, 马泽清. 千烟洲针叶林的比叶面积及叶面积指数. 植物生态学报, 2007, 31(1): 93- 101.
[24] 温远光. 利用枝长与叶面积的关系估测杉木叶面积. 林业科技通讯, 1985, (9): 15- 17.
[25] 朱守谦, 杨世逸. 杉木叶面积测算方法. 林业科技通讯, 1980, (1): 24- 26.
[26] Lu Y H, Coops N C, Wang T L, Wang G Y. A process-based approach to estimate Chinese Fir (Cunninghamialanceolata) distribution and productivity in southern China under climate change. Forests, 2015, 6(2): 360- 379.
[27] 严恩萍, 林辉, 洪奕丰, 张雨, 陈利. 杉木人工林叶面积指数估测及影响因子分析. 水土保持研究, 2013, 20(4): 75- 81.
[28] 刘贯山. 烟草叶面积不同测定方法的比较研究. 安徽农业科学, 1996, 24(2): 139- 141.
[29] 王方永, 王克如, 李少昆, 肖春华, 王琼, 陈江鲁, 金秀良, 吕银亮. 利用数字图像估测棉花叶面积指数. 生态学报, 2011, 31(11): 3090- 3100.
[30] 王宝琦, 刘志理, 戚玉娇, 金光泽. 利用不同方法测定红松人工林叶面积指数的季节动态. 生态学报, 2014, 34(8): 1956- 1964.
[31] Verwijst T, Wen D Z. Leaf allometry ofSalixviminalisduring the first growing season. Tree Physiology, 1996, 16(7): 655- 660.
[32] Schwarz D, Kläring H P. Allometry to estimate leaf area of tomato. Journal of Plant Nutrition, 2001, 24(8): 1291- 1309.
[33] Tsialtas J T, Koundouras S, Zioziou E. Leaf area estimation by simple measurements and evaluation of leaf area prediction models in Cabernet-Sauvignon grapevine leaves. Photosynthetica, 2008, 46(3): 452- 456.
[34] Kandiannan K, Parthasarathy U, Krishnamurthy K S, Thankamani C K, Srinivasan V. Modeling individual leaf area of ginger (ZingiberofficinaleRoscoe) using leaf length and width. Scientia Horticulturae, 2009, 120(4): 532- 537.
[35] Mokhtarpour H, Teh C B S, Saleh G, Selamat A B, Asadi M E, Kamkar B. Non-destructive estimation of maize leaf area, fresh weight, and dry weight using leaf length and leaf width. Communications in Biometry and Crop Science, 2010, 5(1): 19- 26.
[36] Abajingin D D, Ajayi N O. Non-destructive method for estimation of leaf area of clerodendrum volubile, a West African non-conventional vegetable. Research in Plant Sciences, 2015, 3(2): 38- 42.
[37] Tartaglia F D L, Righi E Z, da Rocha L, Loose L H, Maldaner I C, Heldwein A B. Non-destructive models for leaf area determination in canola. Revista Brasileira de Engenharia Agrícola e Ambiental, 2016, 20(6): 551- 556.
[38] Serdar Ü, Demirsoy H. Non-destructive leaf area estimation in chestnut. Scientia Horticulturae, 2006, 108(2): 227- 230.
[39] Demirsoy H, Demirsoy L, Uzun S, Ersoy B. Non-destructive leaf area estimation in peach. European Journal of Horticultural Science, 2004, 69(4): 144- 146.
[40] Gugliuzza G, Fascella G, Mammano M M, Militello M. Non-destructive leaf area estimation inMyrtuscommunisplants. Acta Horticulturae, 2015, 1104: 89- 94.
[41] Rouphael Y, Colla G, Fanasca S, Karam F. Leaf area estimation of sunflower leaves from simple linear measurements. Photosynthetica, 2007, 45(2): 306- 308.
[42] Fascella G, Darwich S, Rouphael Y. Validation of a leaf area prediction model proposed for rose. Chilean Journal of Agricultural Research, 2013, 73(1): 73- 76.
[43] 柯娴氡, 周庆, 苏志尧. 我国南方四种植物的叶面积无损测定. 广东林业科技, 2009, 25(6): 39- 44.
[44] 王慧, 郑明朝, 谢安德, 王凌晖. 基于偏最小二乘法的山白兰叶面积分析及测定方法的研究. 安徽农业科学, 2011, 39(18): 10862- 10864, 10876- 10876.
[45] de Swart E A M, Groenwold R, Kanne H J, Stam P, Marcelis L F M, Voorrips R E. Non-destructive estimation of leaf area for different plant ages and accessions ofCapsicumannuumL. The Journal of Horticultural Science and Biotechnology, 2004, 79(5): 764- 770.
[46] Nicotra A B, Leigh A, Boyce C K, Jones C S, Niklas K J, Royer D L, Tsukaya H. The evolution and functional significance of leaf shape in the angiosperms. Functional Plant Biology, 2011, 38(7): 535- 552.
[47] James S A, Bell D T. Influence of light availability on leaf structure and growth of twoEucalyptusglobulusssp.globulusprovenances. Tree Physiology, 2000, 20(15): 1007- 1018.
[48] 李轩然, 刘琪璟, 蔡哲, 马泽清. 湿地松林叶面积指数测算. 生态学报, 2006, 26(12): 4099- 4105.
[49] Gamiely S, Randle W M, Mills H A, Smittle D A. A rapid and nondestructive method for estimating leaf area of onions. Hortscience, 1991, 26(2): 206- 206.
[50] 谢安德, 王凌晖, 潘启龙. 灰木莲叶面积回归方程的建立. 广东农业科学, 2011, 38(14): 28- 29, 32- 32.
[51] 王勇, 杜晓军, 招礼军, 焦志华, 安明态. 五种火棘属植物的叶面积回归分析. 广西植物, 2013, 33(6): 756- 762.
[52] 李碧洳, 翁殊斐, 冯嘉仪, 欧泳欣. 龙船花两变种叶面积回归方程的建立. 亚热带植物科学, 2015, 44(3): 218- 222.
[53] Cirillo C, Pannico A, Basile B, Rivera C M, Giaccone M, Colla G, de Pascale S, Rouphael Y. A simple and accurate allometric model to predict single leaf area of twenty-one European apricot cultivars. European Journal of Horticultural Science, 2017, 82(2): 65- 71.
[54] Montero F J, de Juan J A, Cuesta A, Brasa A. Nondestructive methods to estimate leaf area inVitisviniferaL. HortScience, 2000, 35(4): 696- 698.
[55] Ghoreishi M, Hossini Y, Maftoon M. Simple models for predicting leaf area of mango (MangiferaIndicaL.). Journal of Biology and Earth Sciences, 2012, 2(2): B45-B53.
[56] Ames Z R, Olmstead M A. Estimation of leaf area for ‘Blanc Du Bois’Vitisspp., ‘Carlos’Vitisrotundifolia, and ‘Southern Home’Vitisrotundifolia×Vitisviniferausing simple linear measurement. Journal of Horticulture, 2016, 3(3): 1000178.
[57] 杨劲峰, 陈清, 韩晓日, 李晓林, Liebig H P. 数字图像处理技术在蔬菜叶面积测量中的应用. 农业工程学报, 2002, 18(4): 155- 158.
[58] 程鸿, 吕军芬. CAD图形处理技术在植物叶面积测量中的应用. 甘肃农业大学学报, 2003, 38(4): 467- 470.
[59] Wilson P J, Thompson K E N, Hodgson J G. Specific leaf area and leaf dry matter content as alternative predictors of plant strategies. New Phytologist, 1999, 143(1): 155- 162.
[60] Zhang L, Liu X S. Non-destructive leaf-area estimation forBergeniapurpurascensacross timberline ecotone, Southeast Tibet. Annales Botanici Fennici, 2010, 47(5): 346- 352.
[61] Meziane D, Shipley B. Direct and indirect relationships between specific leaf area, leaf nitrogen and leaf gas exchange. Effects of Irradiance and nutrient supply. Annals of Botany, 2001, 88(5): 915- 927.

