表观扩散系数灰度直方图在多形性胶质母细胞瘤鉴别诊断中的价值
任琦,程敬亮,马桢,张勇(郑州大学第一附属医院,郑州450052)
多形性胶质母细胞瘤(GBM)是成人最常见、最具侵袭性的原发性脑瘤,在免疫功能正常个体中的发病率逐步增加,占颅内原发肿瘤的1%~6%[1]。术后PCNSL患者缺乏生存获益且神经功能缺陷风险增加[2],因此手术不作为PCNSL患者治疗的首选,通常采用高剂量联合放化疗进行治疗[3,4]。在采取治疗措施前,GBM常需与原发性中枢神经系统淋巴瘤(PCNSL)及单发脑转移瘤(SMT)进行鉴别诊断。单发转移瘤患者需要系统的临床及影像学检查来确定原发肿瘤及其他远处转移病灶的位置[5]。GBM、PCNSL及SMT的治疗方法不同,术前鉴别诊断具有重要临床意义。本研究提取表观扩散系数(ADC)图肿瘤全域感兴趣区(ROI)内的灰度值并对相应参数进行分析,量化肿瘤全域水分子扩散情况,以期从肿瘤全域ADC图中获取鉴别GBM、PCNSL和SMT的可靠信息,为临床决策提供参考。
1 资料与方法
1.1 临床资料 2014年5月~2017年10月于本院就诊的脑肿瘤患者95例,纳入标准:均行颅脑MRI检查,成像序列包括轴位T1WI、T2WI、T2FLAIR、DWI和动态增强T1WI,图像质量佳;MRI检查前无任何影响肿瘤形态学特征的医疗行为,如穿刺、放化疗等;均经术后病理检查确诊。其中GBM 29例(GBM组),男17例、女12例,年龄10~69(51.2±14.5)岁;PCNSL 38例(PCNSL组),男17例、女21例,年龄33~81(57.1±12.5)岁,弥漫性大B细胞淋巴瘤37例、淋巴浆细胞性淋巴瘤1例,均无获得性免疫缺陷;SMT 28例(SMT组),男15例、女13例,年龄36~76(59.8±10.32)岁,原发肿瘤部位为肺24例(腺癌18例、神经内分泌癌4例、鳞癌2例)、乳腺2例(浸润性导管癌1例、原发病理类型不明1例)、胃2例(腺癌2例)。三组性别、年龄比较差异无统计学意义(P均>0.05)。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
1.2 ADC灰度直方图的获取与处理 采用德国Siemens Skyra 3.0T磁共振扫描仪,32通道标准头颈联合线圈。扫描序列包括轴位T1WI、T2WI、T2液体衰减反转恢复、磁共振扩散加权成像(SE-EPI序列,b值分别为0、1 000 s/mm2),参数:TR/TE分别为260.0 ms/2.46 ms、3 800 ms/93.0 ms、4 500 ms/93.0 ms、3 500 ms/119 ms;FOV 23 cm×23 cm,层间距0.3 mm,层厚5 mm,层数20。增强扫描序列包括轴位、矢状位和冠状位T1WI,扫描参数与T1WI平扫相同。对比剂使用钆喷替酸葡胺,剂量0.2 mmol/kg,注射速率2 mL/s,按0.5 mL/kg生理盐水以同速率进行注射冲洗。以BMP格式导出轴位ADC图像,导出前图像窗宽、窗位保持一致。参照增强扫描图像上的肿瘤范围,利用MaZda软件在导出的ADC图像上沿肿瘤边缘手动勾画ROI,由软件自动生成ROI直方图数据,选取灰度值的均值、方差、偏度、峰度及第1、10、50、90、99百分位数(Perc.01%、Perc.10%、Perc.50%、Perc.90%、Perc.99%)等参数用于统计学分析。勾画过程由从事影像诊断工作10年以上的2位影像专家进行指导。
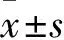
2 结果
2.1 三组ADC灰度直方图参数比较 三组的ADC图灰度值、方差、偏度、峰度、Perc.01%、Perc.10%、Perc.50%、Perc.90%、Perc.99%比较差异有统计学意义(P均<0.05)。GBM组与PCNSL组比较,以上参数差异有统计学意义(P均<0.05);GBM组与SMT组比较,均值、偏度、Perc.01%、Perc.10%、Perc.50%、Perc.99%差异有统计学意义(P均<0.05),方差、峰度、Perc.90%差异无统计学意义(P均>0.05);PCNSL组与SMT组比较,均值、方差、偏度、Perc.50%、Perc.90%差异有统计学意义(P均<0.05),峰度、Perc.01%、Perc.10%差异无统计学意义(P均>0.05)。

表1 三组ADC灰度直方图灰度值、方差、偏度、峰度值比较

表2 三组ADC灰度直方图灰度值第1、10、50、90、99百分位数比较
2.2 ADC灰度直方图鉴别诊断GBM、PCNSL及SMT的效能 绘制ROC曲线。ADC灰度直方图参数中Perc.50%鉴别诊断GBM、PCNSL的AUC最大(0.90),灵敏度与特异度分别为84.21%、86.21%),见表3。Perc.50%鉴别GBM、PCNSL的AUC最大(0.794),灵敏度和特异度相同,分别为96.43%、55.17%,见表4。Perc.90%鉴别PCNSL与SMT的AUC最大(0.814),灵敏度和特异度分别为92.86%、68.42%,见表5。
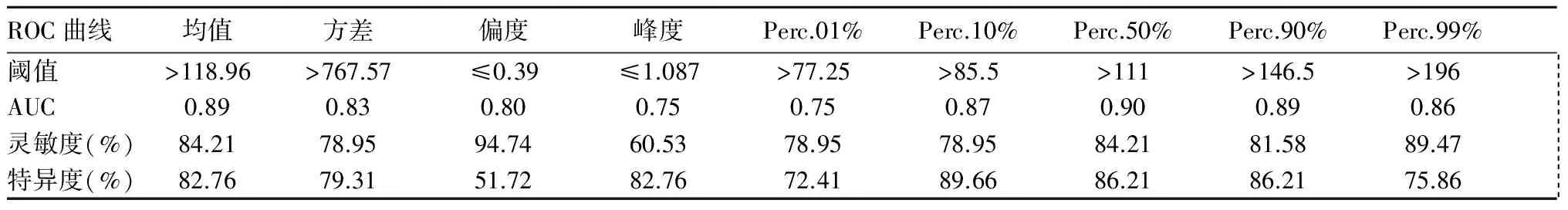
表3 ADC灰度直方图参数鉴别诊断GBM与PCNSL的效能
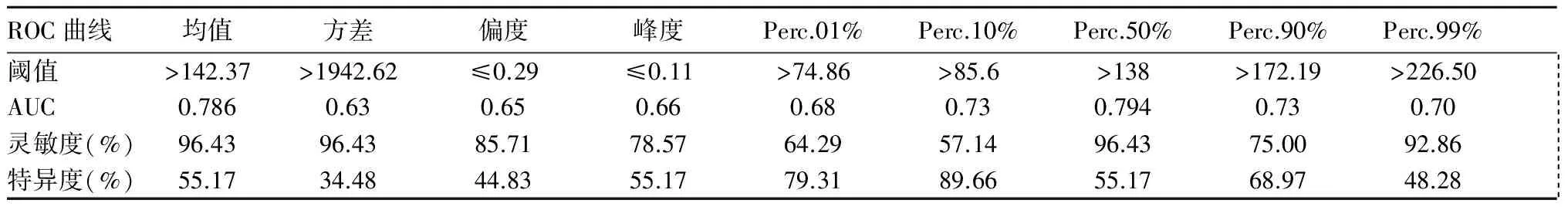
表4 ADC灰度直方图参数鉴别诊断GBM与SMT的效能

表5 ADC灰度直方图参数鉴别诊断PCNSL与SMT的效能
3 讨论
纹理分析量化了图像表面密度的变化及其模式[4],描述了医学图像中像素灰度空间分布,可反映病变的组织类型和病理特征,常应用于数字图像的分析,因此在人工智能医学影像领域中引起了越来越多的关注。灰度直方图分析主要描述的是肿瘤内每个灰度级出现的频率,与来自血流动力学模型的局部脑血容量和局部脑血流量等灌注参数不同,灰度直方图参数没有直接的生理意义。然而,这些描述性特征被认为是由MRI扫描仪将组织的结构和功能特征具体可视化的结果。在神经肿瘤影像学方面,基于MRI的纹理分析涉及放射性治疗所致坏死和复发肿瘤的鉴别[6]、GBM患者的生存预测[7]、脑胶质瘤的分级[8]、不同类型肺肿瘤的脑转移的鉴别[9]、后颅窝肿瘤病理类型的鉴别[10]及髓母细胞瘤复发风险预测[11]等方面,应用价值可观。
ADC值反映了肿瘤微环境内水分子扩散情况,与肿瘤细胞密度呈反比[12],有助于疾病的诊断、生物侵袭性评估及治疗反应预测。ADC图像灰度反映的是ADC值的大小,灰度越低(黑)ADC值则越低。而灰度直方图作为图像纹理的一级特征[13],可量化图像体素内的灰度分布。因此,灰度直方图分析可用于评估肿瘤内部ADC值的整体分布情况。传统的弥散加权成像研究多以病变局部区域为ROI进行分析,本研究以肿瘤全域ADC值为对象,分析GBM、PCNSL和SMT整体ADC值,以期对肿瘤整体水分子扩散情况提供一个更为全面的认识。
PCNSL的ADC图灰度均值低于GBM和SMT,其余5项百分位数当存在组间统计学差异时也保持了这一特征。这可能由于PCNSL细胞密集且核质比较大等组织学特征导致其细胞外水分子扩散受限,ADC值降低明显[1]。GBM恶性程度高,肿瘤细胞增殖与核异型性明显,常出现缺血性改变或血栓形成导致的大片坏死,从而使GBM的全域ADC图灰度均值高于PCNSL和SMT。Lu等[1,3]研究发现,PCNSL的相对ADC值及相对ADC均值低于GBM,这与本研究结果一致。
方差描述的是数据的离散程度。本研究发现GBM与SMT的ADC灰度直方图方差值高于PCNSL,而GBM的ADC灰度直方图方差虽高于SMT,但差异无统计学意义。GBM的传统MRI信号表现多不均匀,其ADC值灰度方差较大,说明GBM微环境中水分子扩散受限程度的异质性较大;而PCNSL较低的方差值则反映了PCNSL更为单一均匀的细胞成分,水分子扩散受限程度差异小。灰度直方图分析参数量化了这一传统的主观性概念。肿瘤异质性是GBM治疗耐药、影响预后的主要原因之一[14],灰度直方图参数能否间接反映GBM治疗及预后情况还需进一步研究证实。
峰度表示灰度值总体分布形态的平坦程度,反映该图像灰度频数分布形态,比正态分布更为尖锐或平坦,尖锐者峰度值为正,相反为负[15]。本研究中,PCNSL峰度值高于PCNSL,说明PCNSL的ADC值灰度分布图像上部分灰度值频数较多,直方图分布形态更为尖锐,表明PCNSL的ADC图灰度值分布更为集中,这一结果与PCNSL较小的方差值相一致,均体现了PCNSL更为均匀的MRI信号表现。
ADC灰度直方图参数鉴别GBM-PCNSL、GBM-SMT、PCNSL-SMT的最高效能分别为0.90(第50百分位数)、0.794(第50百分位数)、0.814(第90百分位数)。本研究中的ADC灰度直方图参数对这三种肿瘤的鉴别诊断效能高于之前的多数研究[1,2,16~18]。与之前的研究不同,灰度直方图分析量化了不同肿瘤影像图像细微特征,包括人眼察觉不到的细微差异,可帮助提高对肿瘤传统影像表现的客观认识。
ADC肿瘤灰度直方图分析是一种有前途的非侵入性图像分析方法,可帮助鉴别GBM、PCNSL和SMT,易从常规MRI扫描中获取参数,无需增加额外的扫描时间,将有望成为使患者受益的辅助诊断方法。
本研究的局限性:本研究的回顾性性质导致偏倚;让2名经验丰富的神经肿瘤影像诊断医师指导画取ROI以减小误差;本研究结果缺少直接的病理影像相关证据验证灰度直方图参数与病理组织学的相关性。因此,需针对直方图参数与组织学特征的关系进行更大样本量的相关性研究,进一步探究灰度直方图分析的诊断潜力。
参考文献:
[1] Lu S, Wang S, Gao Q, et al. Quantitative evaluation of diffusion and dynamic contrast-enhanced magnetic resonance imaging for differentiation between primary central nervous system lymphoma and glioblastoma[J]. J Comput Assist Tomogr, 2017,41(6):898-903.
[2] Lin X, Lee M, Buck O, et al. Diagnostic accuracy of T1-weighted dynamic contrast-enhanced-MRI and DWI-ADC for differentiation of glioblastoma and primary CNS lymphoma[J]. AJNR Am J Neuroradiol, 2017,38(3):485-491.
[3] Ma JH, Kim HS, Rim NJ, et al. Differentiation among glioblastoma multiforme, solitary metastatic tumor, and lymphoma using whole-tumor histogram analysis of the normalized cerebral blood volume in enhancing and perienhancing lesions[J]. AJNR Am J Neuroradiol, 2010,31(9):1699-1706.
[4] Kunimatsu A, Kunimatsu N, Kamiya K, et al. Comparison between glioblastoma and primary central nervous system lymphoma using MR image-based texture analysis[J]. Magn Reson Med Sci, 2018,17(1):50-57.
[5] Cha S, Lupo JM, Chen MH, et al. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging[J]. AJNR Am J Neuroradiol, 2007,28(6):1078-1084.
[6] Tiwari P, Prasanna P, Wolansky L, et al. Computer-extracted texture features to distinguish cerebral radionecrosis from recurrent brain tumors on multiparametric MRI: a feasibility study[J]. AJNR Am J Neuroradiol, 2016,37(12):2231-2236.
[7] Lee J, Jain R, Khalil K, et al. Texture feature ratios from relative CBV maps of perfusion MRI are associated with patient survival in glioblastoma[J]. AJNR Am J Neuroradiol, 2016,37(1):37-43.
[8] Skogen K, Schulz A, Dormagen JB, et al. Diagnostic performance of texture analysis on MRI in grading cerebral gli-omas[J]. Eur J Radiol, 2016,85(4):824-829.
[9] Li Z, Mao Y, Li H, et al. Differentiating brain metastases from different pathological types of lung cancers using texture analysis of T1 postcontrast MR[J]. Magn Reson Med, 2016,76(5):1410-1419.
[10] Rodriguez Gutierrez D, Awwad A, Meijer L, et al. Metrics and textural features of MRI diffusion to improve classification of pediatric posterior fossa tumors[J]. AJNR Am J Neuroradiol, 2014,35(5):1009-1015.
[11] 朱晨迪,张勇,程敬亮,等.MRI灰度直方图分析在髓母细胞瘤复发风险评估中的应用[J].中国介入影像与治疗学,2017,14(8):480-483.
[12] Guo AC, Cummings TJ, Dash RC, et al. Lymphomas and high-grade astrocytomas: comparison of water diffusibility and histologic characteristics[J]. Radiology, 2002,224(1):177-183.
[13] Liu Y, Xu X, Yin L, et al. Relationship between glioblastoma heterogeneity and survival time:an MR imaging texture analysis[J]. AJNR Am J Neuroradiol, 2017,38(9):1695-1701.
[14] Inda MM, Bonavia R, Seoane J, et al. Glioblastoma multiforme: a look inside its heterogeneous nature[J]. Cancers (Basel), 2014,6(1):226-239.
[15] 张胜,李玉林,黄送,等.增强T1WI直方图在胶质母细胞瘤和脑单发转移瘤鉴别诊断中的应用[J].中国医学影像学杂志,2017,25(2):89-92.
[16] Lu S, Gao Q, Yu J, et al. Utility of dynamic contrast-enhanced magnetic resonance imaging for differentiating glioblas-toma,primary central nervous system lymphoma and brain metastatic tumor[J]. Eur J Radiol, 2016,85(10):1722-1727.
[17] Bauer AH, Erly W, Moser FG, et al. Differentiation of solitary brain metastasis from glioblastoma multiforme: a predictive multiparametric approach using combined MR diffusion and perfusion[J]. Neuroradiology, 2015,57(7):697-703.
[18] Mouthuy N, Cosnard G, Abarca-Quinones J, et al. Multiparametric magnetic resonance imaging to differentiate high-grade gliomas and brain metastases[J]. J Neuroradiol, 2012,39(5):301-307.

