基于GPER/PI3K/AKT通路探究四物汤对成骨细胞的雌激素样效应及其分子机制*
卢 迪,崔丽霞,石丹宁,陈 梦,杨 阳,牛建昭,赵丕文
(北京中医药大学生命科学学院 北京 100029)
四物汤,源于宋《太平惠民和剂局方》,由熟地、当归、白芍与川芎组成,具有补血、养血功效,用于治妇人诸疾,尤其冲任虚损所致各种妇科病证。作为中医经典方剂,近年来多项实验研究表明,四物汤及其组方有一定的雌激素样作用,本课题组在研究中也发现,四物汤可通过核受体ER途径发挥雌激素样作用[1]。GPER是新型雌激素受体,四物汤是否通过GPER途径发挥雌激素效应尚不明确,本实验旨在在既往研究的基础上深入探索四物汤是否经GPER介导途径发挥雌激素样效应及其可能分子机理。
1 材料
1.1 实验动物
健康雌性SD大鼠,出生后21天,体质量50 g,SPF级,斯贝福实验技术有限公司提供,生产许可证号:SCXK(京)2016-0002。动物饲养在温度适宜、自然光照动物室内。
1.2 实验药物
四物汤组方:熟地15 g,当归10 g,白芍10 g,川芎6 g,药物颗粒剂购自北京中医药大学附属东方医院,按体质量折算大鼠灌胃剂量(总生药材质量)为6.6 g·kg-1。阳性药物戊酸雌二醇(商品名:补佳乐)为拜耳医药有限公司生产,批号:195A5。
1.3 实验仪器和器材
低温离心机(3K15,SIGMA)、超净工作台(022-2522,北京亚泰隆实验技术中心)、倒置显微镜(TS100,NIKON),CO2培养箱((MCO-20AIC,日本SANYO)、超净工作台(022-2522,北京亚泰实验技术中心)、多功能荧光酶标仪(SAFIRE2,TECAN),倒置荧光显微镜(IX71,OLYMPUS)、NuncTMLab-TekTM腔室载玻片系统(Thermo Scientific)。
1.4 实验试剂
α-MEM培养基(Hyclone),活性炭-葡聚糖处理的胎牛血清(CDT-FBS)(Cellgro,澳洲),0.25%胰蛋白酶(gibico),胶原酶Ⅰ(investergen),碱性磷酸酶染色试剂盒(钙钴法)(南京建成科技有限公司),激动剂G1、拮抗剂G15(Cayman公司),MTT(solarbio),DMSO(ACS Grade),4%多聚甲醛(南京凯基生物有限公司),PI3K抗体(proteintech)、AKT抗体(abcam)、p-Akt抗体(Cell Signaling Technology),DAPI染色液(solarbio),Anti-RabbitIgG-FITC二抗、Anti-MouseIgG-FITC二抗、Anti-RabbitIgG-TRITC二抗(北京中杉金桥有限公司)。
2 方法
2.1 实验分组和给药
40只雌性SD大鼠,按照随机分组的原则分为5组:正常对照组、雌激素组和四物汤高、中、低剂量组。动物适应性喂养3天后,给予灌胃给药。(1)正常对照组:灌胃生理盐水;(2)雌激素组:灌胃补佳乐,0.16 mg·kg-1·d-1;(3)四物汤高剂量组:灌胃四物汤2.08 g·kg-1.d-1;(4)四物汤中剂量组:灌胃四物汤1.04 g·kg-1·d-1;(5)四物汤低剂量组:灌胃四物汤0.52 g·kg-1·d-1。每天早、晚灌胃,持续4天。
2.2 制备含药血清
各组动物最后1次灌胃3 h后称重,腹腔麻醉后,腹主动脉取血,4℃过夜,3 000 rpm离心10 min,收集血清,0.22 μm无菌滤器过滤,56℃、30 min灭活补体,-20℃保存。
2.3 成骨细胞提取和培养
在乳鼠出生后72 h内提取原代成骨细胞,提取细胞所用器械均已在使用前高压灭菌。SD乳鼠浸泡于75%酒精中消毒10 min左右,移入超净工作台,取其颅骨并剥离干净,剪碎、消化后离心收集骨片,加入0.5%胶原酶Ⅰ,放入培养箱培养1 h左右;离心,弃上清液,加入α-MEM(含10%CDT-FBS)培养基,充分吹打后,离心或静置5 min,取上清,放入培养瓶培养[2]。
2.4 成骨细胞的形态学观察和碱性磷酸酶(ALP)活性鉴定
取第2代ROBs,观察细胞形态,并拍照记录;另取部分细胞消化、离心,以5×103个/孔接种于24孔板中,待细胞生长至80%时,吸弃培养液后,以4%多聚甲醛固定细胞,按照碱性磷酸酶染色试剂盒说明书(钙钴法)染色,并在倒置显微镜下拍照记录。
2.5 细胞增殖实验
选取第2或3代的ROBs细胞,加入α-MEM(含10%CDT-FBS)培养基,在细胞培养箱培养后,PBS洗涤2次,用0.25%胰蛋白酶消化5 min,加入α-MEM完全培养基,以3×103个/孔的细胞密度接种于96孔板内,每孔培养液总体积为100 μL。细胞贴壁后,换为含10%含药血清的DMEM培养液中继续培养;同时设置激动剂组、拮抗剂组,即在加入含药血清之前1 h加入GPER激动剂G1或拮抗剂G15,浓度为10-8mol·L-1。每组设5个复孔,同时设置调零组(只加培养基,不加细胞)。在加药24 h后,避光加入MTT(5 mg·ml-1,14 μL/孔),继续孵育4 h后,每孔加入150 μLDMSO,避光在摇床上摇动10 min。以DMSO调零,用酶标仪测定各孔490 nm下吸光度值并记录。
2.6 细胞免疫荧光实验
细胞培养条件同2.5。选取第2或3代ROBs,以5×103个/孔的细胞密度接种于腔室载玻片系统中,细胞贴壁后,换为含10%含药血清的DMEM培养液中继续培养24 h,同时设置激动剂组、拮抗剂组。培养24 h后,4%多聚甲醛固定20 min,0.03%Trinton-100透膜10 min,5%山羊血清封闭30 min后分别加入PI3K、AKT、p-Akt一抗,4℃过夜;第二天将载玻片恢复至室温,吸弃一抗,洗后避光加入Anti-RabbitIgG-FITC二抗、Anti-MouseIgG-FITC或Anti-RabbitIgG-TRITC二抗,室温30 min;洗后避光加入DAPI染液10 min,倒置荧光显微镜拍照记录[3]。
2.7 统计学处理
采用SPSS20统计软件进行分析。实验数据以平均值±标准差(xˉ±s)表示,多组比较采用单因素方差分析,组间多重比较用LSD法。以P<0.05表示差异有统计学意义。
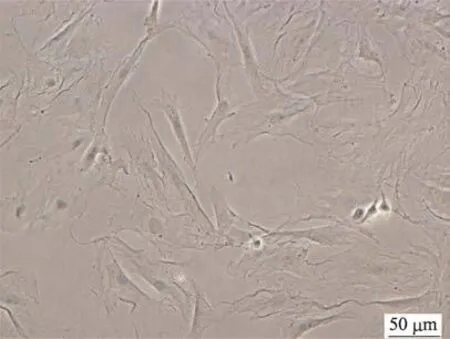
图1 成骨细胞的形态学特征(×400)
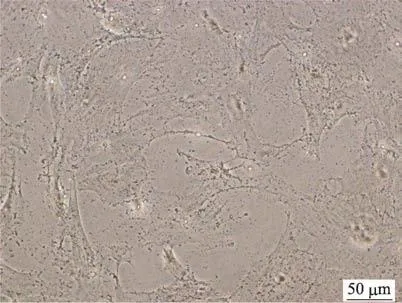
图2 碱性磷酸酶染色(×400)
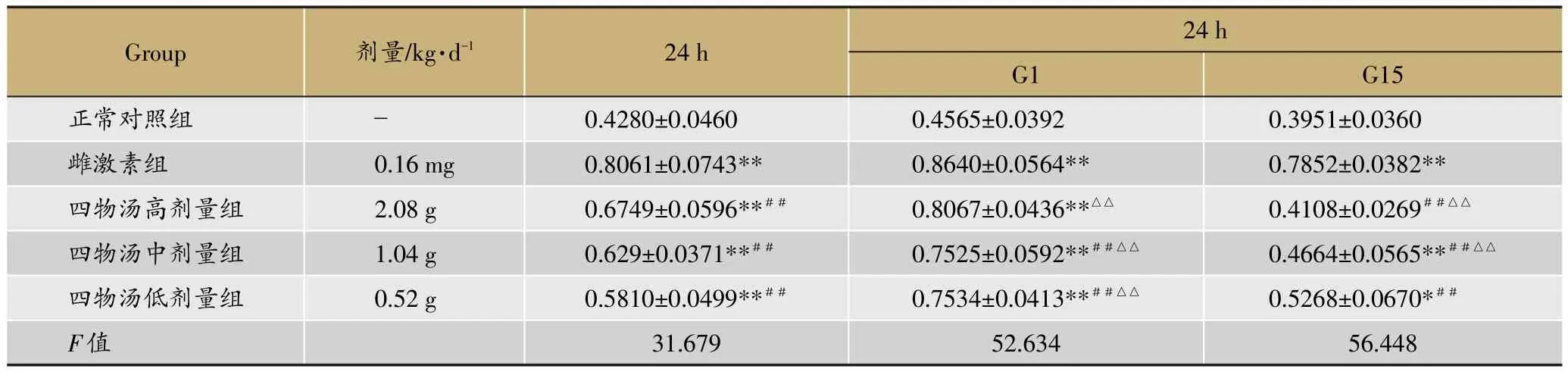
表1 四物汤含药血清对ROBs增殖速率的影响(xˉ±s,n=5)
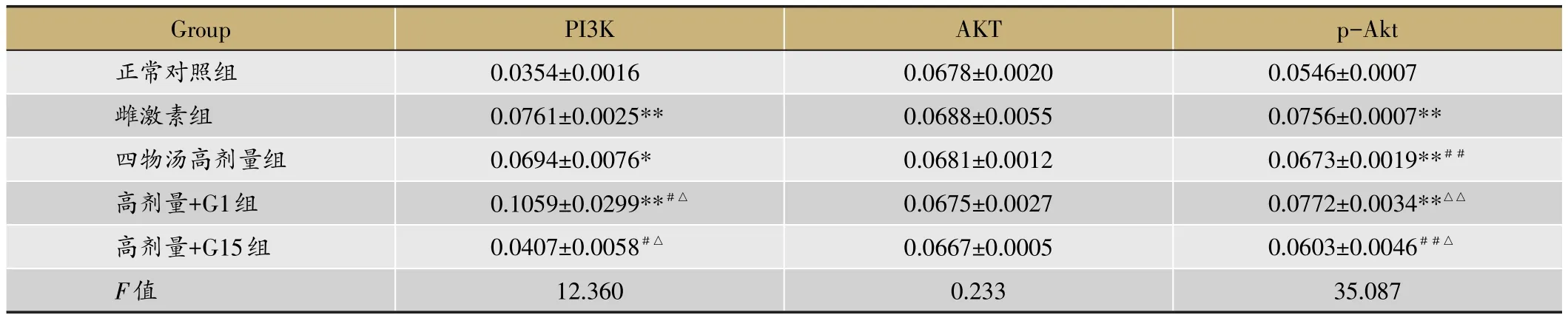
表2 四物汤含药血清对ROBs中PI3K、AKT、p-Akt平均荧光强度表达的影响(xˉ±s,n=3)
3 结果
3.1 成骨细胞的形态学特征和碱性磷酸酶活性鉴定
由图1和图2可知,在显微镜下观察,ROBs细胞呈现梭形或多边形形态,多突起;通过碱性磷酸酶染色发现,ROBs细胞胞质中阳性反应呈现灰黑色颗粒或块状、条状沉淀。
3.2 四物汤含药血清对ROBs细胞增殖的影响
由表1可知,与正常对照组相比,雌激素含药血清可使ROBs细胞增殖速率显著增加(P<0.01);与雌激素的作用趋势类似,四物汤高、中、低剂量组含药血清也可使ROBs细胞增殖速率明显增加(P<0.01),并具有一定的剂量依赖性。该促细胞增殖的作用在加入GPER激动剂G1后可被进一步增强(P<0.01);而在加入GPER拮抗剂G15后,四物汤含药血清各剂量组促进细胞增殖的作用均被明显拮抗(P<0.05或P<0.01)。
3.3 四物汤含药血清对ROBs PI3K、AKT、p-Akt表达的影响
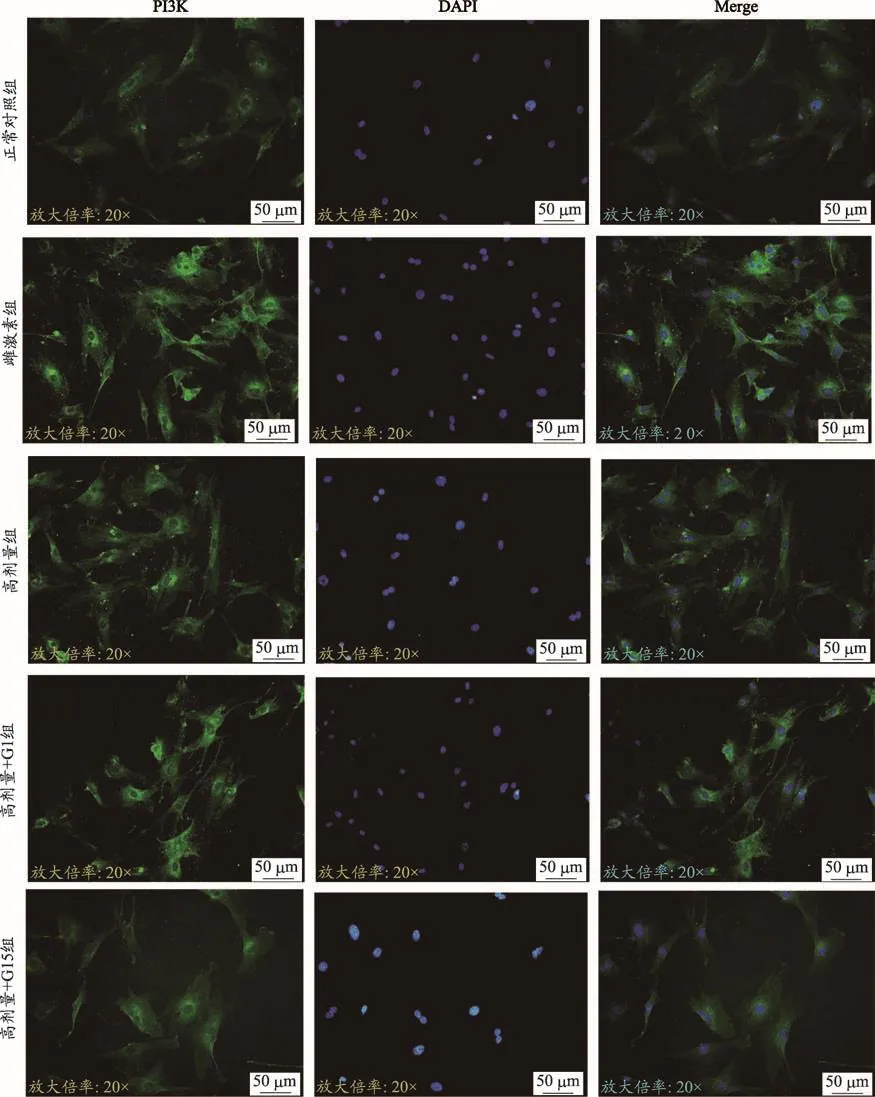
图3 四物汤含药血清对ROBs PI3K表达的影响(FITC染色×400)
由表2和图3、图4、图5的结果可知,雌激素组含药血清对ROBs中PI3K、p-Akt的平均荧光表达强度有促进作用(P<0.01),在四物汤高剂量含药血清作用后,ROBs细胞中PI3K、p-Akt的平均荧光强度高于正常对照组的平均荧光强度(P<0.05或P<0.01),在加入激动剂G1后,其表达强度相比高剂量组进一步增强(P<0.05或P<0.01),在加入拮抗剂G15后,其表达强度相比高剂量组明显减弱(P<0.05);而总AKT的平均荧光强度在五组中表达程度相当,无统计学意义(P>0.05)。
4 讨论
四物汤作为妇科补血调经的经典方剂,本实验证明其可通过GPER通路发挥雌激素样效应,促进成骨细胞增殖,提高GPER介导下游信号分子PI3K、p-Akt的表达水平。
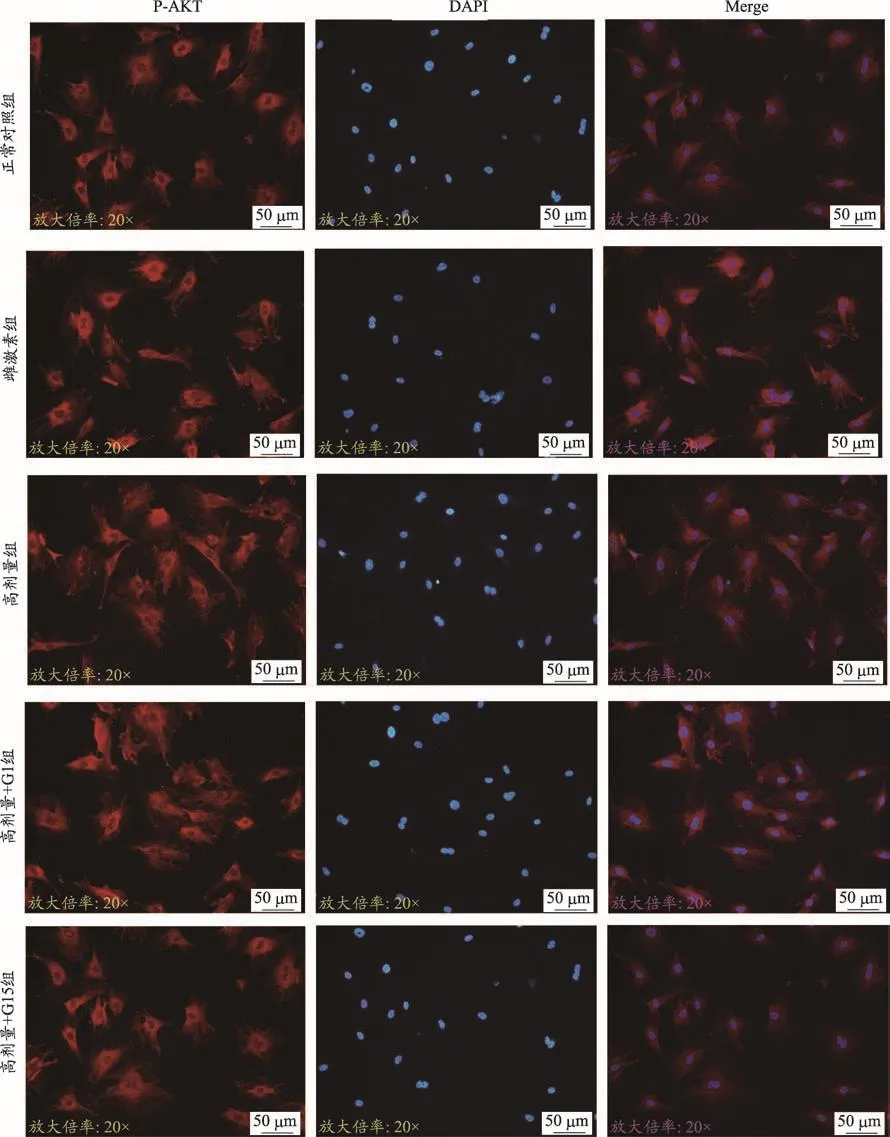
图4 四物汤含药血清对ROBs AKT表达的影响(TRITC染色×400)
成骨细胞是骨形成的主要功能细胞,负责骨基质的合成、分泌和矿化。功能活跃的成骨细胞内碱性磷酸酶组织化学染色阳性[2],大量的实验研究表明,ALP可用作成骨细胞的鉴定和细胞分化的标志之一。本实验结果与文献报道一致,即通过碱性磷酸酶染色发现,ROBs细胞质有灰黑色染色颗粒。
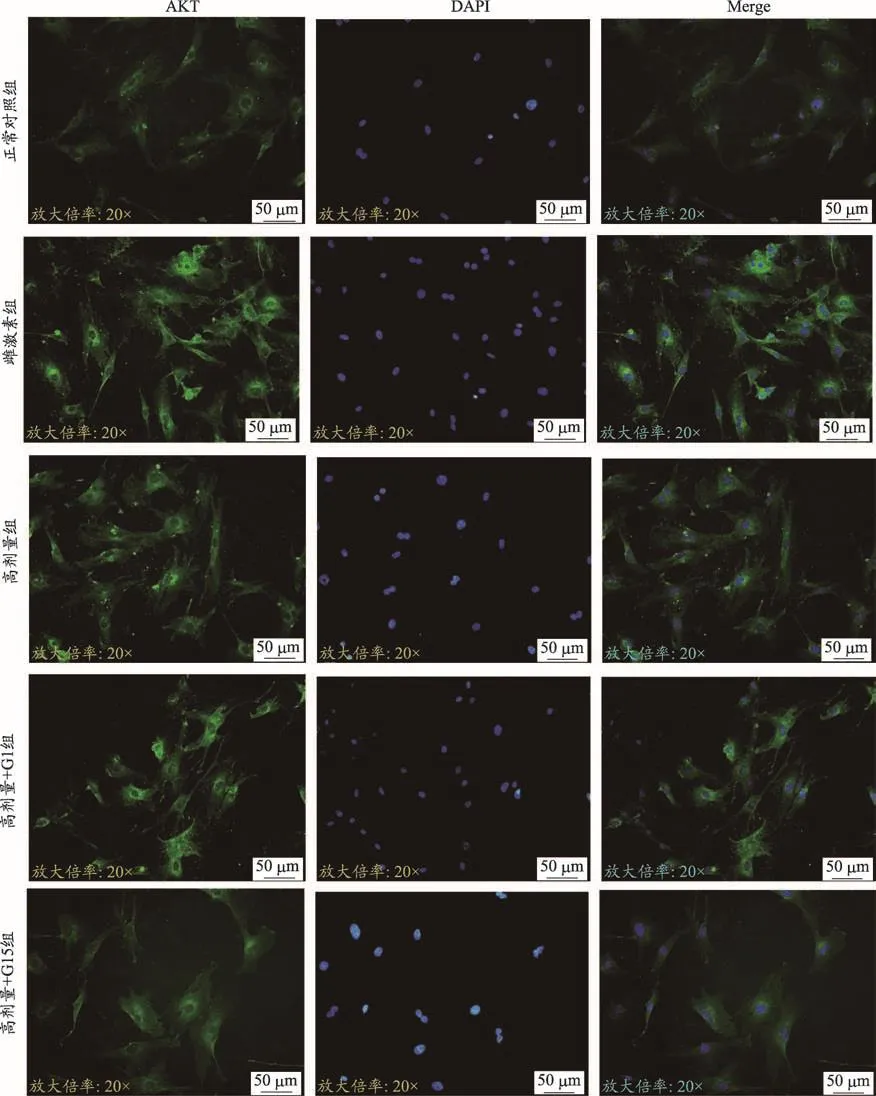
图5 四物汤含药血清对ROBs p-Akt表达的影响(FITC染色×400)
雌激素在骨代谢中发挥着重要作用,40年前,科学家们首次在体外培养的成骨细胞上发现了雌激素受体,并在蛋白水平和mRNA水平上证明了雌激素对成骨细胞的影响[4-5]。雌激素通过直接结合ER或者间接作用可促进成骨细胞的增殖和骨形成,抑制破骨细胞的分化和促进其凋亡等[6]。近年来,除经典雌激素核受体之外,一种新型雌激素膜受体—GPER的发现为雌激素效应分子机理的研究提供了新的思路。不同于经典雌激素核受体的核效应,GPER不仅能介导雌激素快速非基因组效应,也可间接参与基因转录的调控,通过影响下游信号分子的表达发挥其调控机制。GPER介导的信号转导途径主要包括PI3K途径、cAMP途径、MAPK途径、IP3-Ca2+途径等[7]。近年来关于GPER在骨代谢中的机制研究日益增多。在成骨,破骨和骨细胞中均表达GPER,但在雌鼠的脂肪、子宫等生殖系统[8]和皮质骨小梁骨中,其作用不明显[9]。在体动物实验结果证明,GPER激活能够提高卵巢摘除后大鼠的骨密度,发挥调节骨代谢功能[10];体外细胞实验表明,GPER可通过激活PI3K/AKT、MAPK(ERK、p38、JNK)以及cAMP-PKA-CREB等信号通路影响ROBs细胞的增殖与分化[8]。雌激素与缺乏ER受体的人胚胎成骨细胞(hFOB)上的GPER结合后,可通过激活下游MAP激酶介导促进成骨细胞的增殖,发挥骨保护作用[11]。进一步的研究表明,GPER激活后可介导多方面的雌激素样作用,对脊髓损伤所致的骨质疏松也可发挥神经保护作用[12]。
本研究通过细胞增殖实验发现,四物汤含药血清组与雌激素组含药血清作用类似,可促进ROBs的增殖,而四物汤含药血清的促细胞增殖作用在加入GPER激动剂G1后进一步增强,加入抑制剂G15可被减弱。有研究表明,G15对GPER具有高亲和力而对经典ER结合力很弱[13]。本实验中G15能够抑制四物汤含药血清的效应,这表明在经典雌激素受体途径之外,四物汤含药血清可通过非核途径来发挥雌激素样效应,即GPER是四物汤含药血清发挥促细胞增殖效应的重要途径和作用靶点。细胞免疫荧光实验表明,与雌激素组含药血清作用类似,在四物汤含药血清作用下,ROBs细胞中PI3K、p-Akt的表达量增强,而四物汤含药血清的这种增强作用也可在加入G1后进一步增强,加入G15明显减弱。该结果进一步说明,四物汤含药血清可通过非核途径,即GPER信号途径发挥雌激素样作用,且该效应是通过影响下游的PI3K/AKT信号通路中相关调控因子的活化和表达实现的。PI3K/AKT信号通路,即磷脂酰肌醇-3-激酶/蛋白质丝氨酸苏氨酸激酶通路,是经典的抗凋亡信号通路之一,有促进细胞周期增殖、调节细胞生长等作用[14]。所以影响该信号通路的效应也是四物汤调控细胞增殖活性的重要途径和机制。
有调查研究表明,我国女性有50%以上会发生绝经后骨质疏松,绝经后5-10年是集中发病时段[15]。妇女在绝经后体内雌激素水平下降,雌激素缺乏使骨的吸收与形成失衡,破骨细胞性骨吸收超过成骨细胞性骨形成,使骨量减少,骨密度下降,骨脆性增加,易发生骨折[16]。而传统的雌激素替代疗法的临床疗效有一定争议,增加乳腺癌等肿瘤疾病的发生风险[17]。四物汤作为妇科补血调经的经典方剂,本实验证明其能通过GPER途径发挥雌激素样作用,对成骨细胞的成熟和骨化有促进作用,可为其治疗女性绝经后骨质疏松的临床应用提供实验依据。
1 卢迪,赵丕文,陈梦.基于ER亚型特异性介导和调节作用的四物汤雌激素样效应及其机制的研究.第十四次中国中西医结合实验医学学术研讨会论文汇编,2017:36-45.
2 程浩,张延芳,许巍.新生大鼠成骨细胞原代培养与鉴定.中国组织工程研究,2013,17(41):7200-7202.
3 何芳.基于胶质细胞HIF-1α通路调控细胞凋亡研究清脑滴丸对急性脑缺血再灌注损伤的作用机制.北京:北京中医药大学.2017:49-50.
4 Gray T C,Flynn T C,Gray K M,et al.17-β estradiol acts directly on the clonal osteROBslastic cell line UMR106.Pro Natl Acad Sci,1987,87:6267-6271.
5 Komm B S,Terpening C M,Benz D J,et al.Estrogen binding,receptor mRNA,and biolo gic response in osteoblast-like osteosarcoma cells.Sci,1988,241:81-83.
6 李微,张博,张雨薇,等.雌激素调节骨代谢作用的研究进展.中国骨质疏松杂志,2017,23(2):262-263.
7 闫懿,敖锋,宋健.雌激素及雌激素受体信号转导途径的研究进展.山西医药杂志,2016,45(9):1032-1034.
8 康文博.雌激素膜受体GPR30/GPER1在骨质疏松治疗中的作用与机制研究.上海:第二军医大学.2016:50-57.
9 Heino T J,Chagin A S,Savendahl L.The novel estrogen receptor gprotein-coupled receptor 30 is expressed in human bone.J Endocrinol,2008,197(2):R1-6.
10 Kang W B,Cong Y,Ru J Y,et al.Osteoprotective effect of combination therapy of low-dose oestradiol with g15,a specific antagonist of gpr30/gper in ovariectomy-induced osteoporotic rats.Biosci Rep,2015,35(4):e00239.
11 Noda-Seino H,Sawada K,Hayakawa J,et al.Estradiol and raloxifene induce the proliferation of osteoblasts through G-protein-coupled receptor GPR30.J Endocrinol Invest.,2013,36(1):21-27.
12 程强.新型G蛋白偶联雌激素受体GPER与雄性小鼠骨质疏松相关性研究.上海:第二军医大学.2017:40-45.
13 Fitzgerald A C,Peyton C,DongJ,et al.Bisphenol A and Related Alkylphenols Exert Nongenomic Estrogenic Actions Through a G Protein-Coupled Estrogen Receptor 1(Gper)/Epidermal Growth Factor Receptor(Egfr)Pathway to Inhibit Meiotic Maturation of Zebrafish Oocytes.Biol Reprod,2015,93(6):135.
14 Pfeifer M,Grau M,Lenze D,et al.PTEN loss defines a PI3k/Akt pathway-dependent germinal center subtype of diffuse large B-cell lymphoma.Proc Natl AcadSci U S A,2013,110(30):12420-12425.
15 Bastos-Silva Y,Aguiar L B,Pinto-Neto A M,et al.Correlation between osteoporotic fracture risk in Brazilian postmenopausal women calculated using the FRAX with and without the inclusion of bone densitometry data.Arch Osteoporos,2016,11(1):16.
16 Clarke B L,Khosla S.Physiology of bone loss.Radiol Clin North Am,2010,48(3):483-495.
17 Villiiers J D,Pines A,Panay Net al.Updated 2013 International Menopause Society recommendations on menopausal hormone therapy and preventive strategies for midlife health.Climacteric,2013,16(3):316-337.

