调质温度及模孔长径比对颗粒饲料加工质量的影响
段海涛,李军国,秦玉昌,李 俊,杨 洁,董颖超
(1. 中国农业科学院饲料研究所,北京 100081;2. 农业部食物与营养发展研究所,北京 100081;3. 农业部饲料生物技术重点实验室,北京 100081;4. 中国农业科学院北京畜牧兽医研究所,北京 100081)
0 引 言
饲料加工过程中,影响颗粒饲料加工质量的主要因素包括配方原料组成、调质制粒设备和参数及粉碎粒度等[1],其中调质和制粒是影响颗粒饲料加工质量的重要因素占40%以上[2-3]。随着无抗/减抗时代的来临,益生菌等热敏性抗生素替代品较多的应用到饲料配方中,饲料加工过程中,较高的调质温度则引起益生菌等热敏性饲料原料失活,温度较低则杀菌不彻底[4],为克服工艺缺点,饲料生产中存在大宗原料熟化后低温制粒工艺,如断奶仔猪料加工工艺中大料膨胀(膨化)低温制粒工艺,熟化的大宗原料冷却后与配方中热敏性成分混合低温制粒,目前,此类工艺研究主要集中于大宗原料的熟化工艺调节方面[5],较少考虑到低温制粒环节对饲料加工质量的影响,低温制粒过程中,温度较高则引起热敏性饲料原料损失较大,温度较低则制粒能耗高、环模磨损严重等[6-8]。
颗粒饲料加工过程中,针对调质温度对颗粒饲料加工质量的影响研究较多,张现玲等[9]研究发现玉米豆粕型日粮适宜调质温度为75~80 ℃,植酸酶保留率及淀粉糊化度较高。Lewis等[10]研究制粒过程中调质温度与调质时间对淀粉糊化度及维生素保留率的影响,结果表明调质温度、调质时间及其交互作用均对核黄素、烟酸及维生素D3的浓度有所降低,但不同调质温度或调质时间组间差异不显著。Spring等[11]在60,70,80,90和100 ℃下将小麦-豆粕制成颗粒饲料,发现提高调质温度可以提高颗粒硬度。提高调质温度可显著改善颗粒饲料加工质量PDI和硬度。除调质温度外,有研究环模厚度(60与50 mm),在相同的模孔直径(3.5 mm)下,环模厚度为60 mm 表现出更高的 PDI[12],还有颗粒直径对颗粒饲料加工质量的影响,有研究报道了玉米-大豆和大麦-豆粕日粮模孔直径的减小(从5到3 mm)对PDI产生强烈正效应[13]。目前,国内外学者并未针对低温调质温度与模孔长径比及其双因素对颗粒饲料加工质量进行过系统性研究,及大宗原料熟化后低温制粒常面临颗粒硬度高或成形率低等问题未进行探究。
因此,本试验针对熟化后大宗原料进行低温制粒,研究调质温度与模孔长径比对颗粒饲料加工质量与加工能耗的影响,评价大宗原料熟化后低温制粒颗粒能否满足颗粒饲料加工指标要求,旨在为畜禽饲料低温调质、制粒等加工过程的优化提供理论指导。
1 材料与方法
1.1 试验日粮与配方
试验所需基础饲粮配方见表1[14],玉米与豆粕等大宗原料均采用2.0 mm粉碎机筛片粉碎,参照配方配料混合后采用调质保持器(STZW60x40Ⅱ)熟化处理,冷却熟化料添加乳酸菌等热敏性饲料原料进行调质制粒,调质温度为50、55、60及65 ℃,模孔长径比为6∶1、8∶1及 10∶1,试验饲粮在基础饲粮配方基础上添加200 mg/kg乳酸菌(大北农生物科技有限公司,5.0×1010CFU/kg),以研究调质温度与模孔长径比对益生菌保留率的影响,日粮配方中预混料为每千克饲粮提供: 维生素A 6 312 IU,维生素D32 600 IU,维生素E 35 IU,维生素K34 mg,维生素B12.8 mg,维生素B25 mg,维生素 B64 mg,叶酸 1.1 mg,维生素 B1228.1 μg,泛酸 14 mg,烟酸 40 mg,生物素 44 μg,氯化胆碱 400 mg,铜 100 mg,铁80 mg,锰40 mg,锌75 mg,L-赖氨酸3.3%,钙10%,磷2%。碘0.3 mg,硒0.3 mg。

表1 试验基础饲粮组成及营养水平(干基)Table 1 Composition and nutrient levels of experimental diets (air-dry basis)
1.2 样品采集
在大料混合料调质后,低温制粒调质前和制粒机出料口各取样3次,湿热粉料、颗粒料摊开变凉后采用“四分法”逐渐缩减至2 kg,装入自封袋中于4 ℃冰箱保存待测。
1.3 检测指标与方法
1.3.1 淀粉糊化度
样品的糊化度检测采用简易酶法[15]。
1.3.2 颗粒硬度
硬度的测定参照常碧影《饲料质量与安全监测技术》中颗粒饲料硬度的测定方法检测[16]。
1.3.3 颗粒耐久性指数
颗粒耐久性指数(pellet durability index, PDI)测定参照Thomas等[17]的方法,取500 g筛分后的颗粒饲料装入回转箱内,以50 r/min回转10 min,停止后取出样品,称取颗粒饲料质量m1,见式(1)。

1.3.4 颗粒成形率的测定。
颗粒成形率的测定是在制粒机出料口,接取约 5 kg成形后饲料,冷却后称质量,然后选用孔径为颗粒直径0.8倍的筛子进行筛分,筛取筛上物,颗粒成形率计算见式(2)。
颗粒成形率=筛上物质量×100%/冷却后饲料质量 (2)
1.3.5 乳酸菌菌落的测定
乳酸菌的测定参照国标GB/T4789.35-2016食品微生物学检验,乳酸菌检验。
1.4 数据处理
试验数据以(平均值±标准差)形式表示。所有数据用软件SAS 9.2 进行单因素方差分析(ANOVA)复因子试验统计分析,用Duncan 氏法多重比较检验差异的显著性,显著性水平P<0.05,极显著水平P<0.01。
2 结果与分析
2.1 调质温度与模孔长径比对颗粒饲料颗粒硬度及颗粒耐久性指数的影响
目前,为提高颗粒饲料产品加工质量,同时,降低配方中热敏性饲料原料损失率,饲料生产中常采用大料熟化后低温制粒工艺,如断奶仔猪料加工工艺及本研究中所使用的生长育肥猪饲料加工工艺[18]。本试验即采用大料熟化后低温制粒,研究低温制粒过程中颗粒饲料加工质量的变化规律。本试验配方中大宗原料(玉米、豆粕、棉粕及麸皮)参照配方混合后熟化器湿热调质处理,淀粉糊化度为69.13%,熟化粉状大宗原料参照日粮配方与热敏性饲料原料混合进行调质制粒,调质温度及模孔长径比对颗粒饲料硬度及颗粒耐久性指数的影响如表 2所示。当模孔长径比为 6∶1时,颗粒耐久性指数 65 ℃组显著高于50 ℃处理组(P<0.05);颗粒成形率50 ℃组显著低于其余3组(P<0.05),但差异较小且均高于95%。当模孔长径比为8:1时,65 ℃组颗粒硬度显著高于其余3组(P<0.05);颗粒耐久性指数60 ℃组显著高于50及55 ℃组(P<0.05),但与 65 ℃组差异不显著(P>0.05);颗粒成形率50 ℃显著低于65 ℃组(P<0.05),由3×5双因素方差分析可知,调质温度与模孔长径比对颗粒硬度及颗粒耐久性指数具有极显著性影响(P<0.01),然而其交互作用对颗粒硬度及颗粒耐久性指数影响不显著(P>0.05)。可见,颗粒饲料加工质量受到调质温度及模孔长径比的双因素共同作用,低温制粒调质温度或模孔长径比的提高,颗粒硬度及颗粒耐久性指数随之升高,然而乳酸菌保留率呈下降趋势,制粒吨料电耗呈上升趋势,从颗粒硬度及颗粒耐久性指数可得,颗粒成形率均96%以上,颗粒耐久性指数均大于95%,满足颗粒饲料加工质量要求。
随行业的发展,市场对颗粒饲料加工质量要求的提高,更多的报道研究如何提高颗粒饲料加工质量。Duan等[19]研究表明调质器类型的改进可以提高颗粒饲料加工质量及生长育肥猪生长性能,即改变饲料调质时间改善颗粒饲料加工质量。张现玲等[9]研究发现提高调质温度可提高玉米-豆粕型日粮颗粒饲料加工质量,推荐调质温度为75~85℃。Svihus等[1]研究发现较高模孔长径比颗粒饲料表现较高的颗粒耐久性指数。这与本文中研究结果一致。
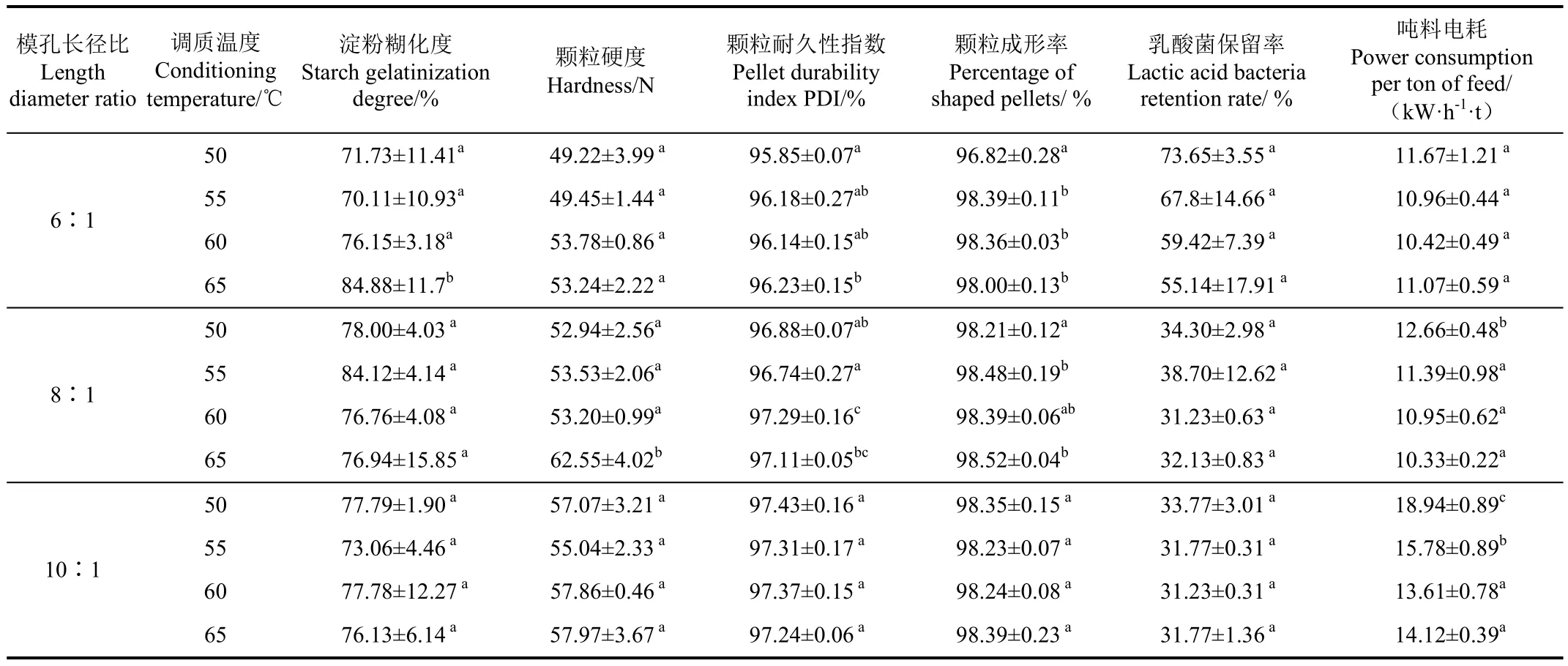
表2 调质温度与模孔长径比对颗粒饲料加工质量的影响Table 2 Influence of conditioning temperature and length- diameter ratio of ring die on feed quality and power consumption
本试验中研究发现随着调质温度及模孔长径比的提高,颗粒硬度呈升高趋势。这是由于大宗原料熟化过程即淀粉糊化及蛋白质变性过程,淀粉颗粒分子被破坏,包括不可逆吸水膨胀、双折射消失及结晶区消失等,蛋白质的四级结构打开,分子结构松散,不能形成结晶等[20]。大宗原料熟化后冷却,此过程中伴随热的淀粉糊转变成具有粘弹性和硬的凝胶,已经溶解膨胀的淀粉分子重新排列组合,形成一种类似天然淀粉结构的物质,即淀粉的老化[21-22],值得注意的是:淀粉老化的过程是不可逆的,不可能通过糊化再恢复到老化前的状态,但是,老化淀粉由于其分子链已全部破碎,再次受热时,其黏度呈一直上升趋势,且糊化温度较于熟化前较低[20]。冷却后大宗原料添加热敏性饲料原料低温调质制粒,由于老化淀粉较好的粘结性及较低的糊化温度,因此颗粒饲料硬度较高。
2.2 调质温度与模孔长径比对淀粉糊化度的影响
调质温度及模孔长径比对颗粒饲料淀粉糊化度的影响如表2所示。当模孔长径比为61∶时,65 ℃组淀粉糊化度显著高于其余3组(P<0.05)。当模孔长径比为81∶时,低温制粒调质温度50、55、60及65 ℃处理组间淀粉糊化度差异不显著(P>0.05)。当模孔长径比为101∶时,处理组间淀粉糊化度差异不显著(P>0.05)。由3×5双因素方差分析,调质温度与模孔长径比交互作用对淀粉糊化度具有显著性影响(P<0.05)。可以看出当模孔长径比较低时,淀粉糊化度随着调质温度的升高呈升高趋势,低温制粒模孔长径比推荐选用6:1。
淀粉糊化是在水和湿热的存在下,β-淀粉受热分解成α-淀粉,直链淀粉打开形成无序的支链淀粉的过程[23-27].高温高压是淀粉糊化的基础条件[28]。马成林等[29]在700 MPa压力下,保压2 min即可使玉米淀粉86.8%糊化,保压5 min,可使玉米淀粉 100%糊化。不仅调质过程中的高温高湿蒸汽能够提高淀粉糊化度,而且制粒过程中模孔长径比的大小同样可以提高物料淀粉糊化度。同时,制粒过程可以提高蛋白质和淀粉消化率约 3%[30],Hilton等[31]曾研究膨胀加工及制粒机制粒对颗粒耐久性指数、颗粒吸水性及虹鳟的生理指标的影响,研究表明,蒸汽调节可以改善颗粒饲料耐久性、水中稳定性及提高虹鳟对饲料原料的消化吸收利用率。淀粉糊化度是饲料加工质量的重要指标。本试验研究发现,低温调质温度各处理组间淀粉糊化度增幅约 10%,双因素结果分析显示,调质温度及模孔长径比对淀粉糊化度均无显著性影响,然而二者交互作用对淀粉糊化度具有显著性影响,因为较低温度尚未达到淀粉团打开或变性温度。调质作为制粒前准备工序,起到“软化”物料的作用,物料调质效果的好坏直接影响制粒效果及制粒能耗,同时,制粒过程中高挤压过程可提高物料淀粉糊化度,即低调质温度下二者协同作用对淀粉糊化度具有显著性影响。
2.3 调质温度与模孔长径比对乳酸菌保留率的影响
调质温度及模孔长径比对颗粒饲料中乳酸菌保留率的影响如表2所示。当模孔长径比为61∶时,4种调质温度下乳酸菌保留率差异均不显著(P>0.05)。当模孔长径比为81∶时,50 ℃组乳酸菌保留率显著高于其余3组(P<0.05)。当模孔长径比为101∶时,55 ℃组乳酸菌保留率显著高于60、65 ℃组(P<0.05),但显著低于50 ℃组(P<0.05)。由3×5双因素方差分析,模孔长径比对乳酸菌保留率具有极显著性影响(P<0.01),且模孔长径比对乳酸菌保留率的影响程度高于调质温度对其保留率的影响,由乳酸菌保留率及吨料电耗可得,推荐低温制粒调质温度为55~60 ℃,同时,结合适宜长径比选择,低温制粒加工参数调质温度为55~60 ℃,模孔长径比推荐为6∶1。
在畜禽养殖和饲料工业中,滥用抗生素和兽药导致耐药性细菌及兽药残留等问题日益严重,直接影响动物食品质量和安全性[32]。目前,随着无抗/减抗时代的来临,以及人们对环境污染的关注,抗生素替代品(无抗药性的新型益生菌)得到推广应用[33-34]。然而,在饲料加工过程中,高温高湿调质(85~90 ℃)对热敏性饲料原料有效性将产生十分严重的影响[9]。Lewis曾[25]研究饲料加工过程中热敏性饲料原料的损失规律,结果发现维生素A、维生素C及叶酸损失率最高,但烟酸、生物素和泛酸在饲料加工过程中相对稳定。不仅维生素在加工过程中会损失,而且植酸酶同样会降低保留率,张现玲等[9]曾发现 75 ℃植酸酶的保留率显著高于 80 ℃处理组植酸酶保留率。本试验采用低温调质不同模孔长径比制粒,研究二者对乳酸菌保留率的影响。结果发现调质温度越低保留率越高,模孔长径比越小保留率越高,这是因为温度越高,活菌总数死亡率越高,即保留率越低,模孔长径比越大,制粒过程挤压程度越大,活菌保留率越低。
2.4 颗粒饲料加工质量相关性分析
由表 3颗粒饲料加工质量指标相关性可得,颗粒硬度与颗粒耐久性指数呈极显著性正相关,颗粒耐久性指数与颗粒成形率呈显著性正相关(表3)。
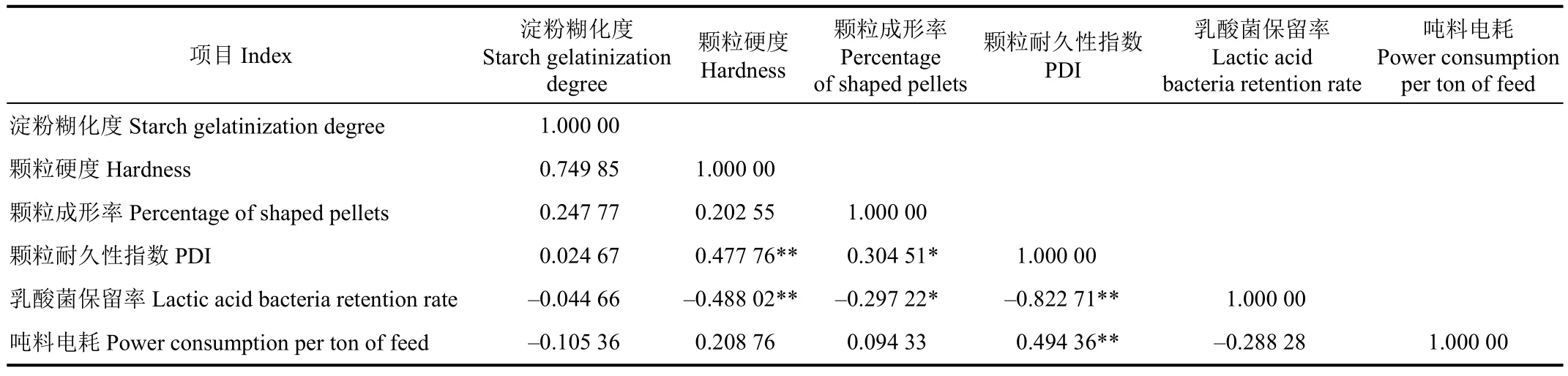
表3 颗粒饲料加工质量间相关性Table 3 Correlation of feed quality indicators

张现玲等研究发现颗粒硬度与颗粒耐久性指数呈正相关,本试验与其取得一致性研究成果。对调质温度(X)、模孔长径比(Y)与颗粒耐久性指数 Z1和颗粒硬度 Z2,作回归模型(n=4)如式(3)~(4)。即该模型具有良好的预测精度。乳酸菌保留率与颗粒硬度、颗粒耐久性指数呈极显著性负相关,与颗粒成形率呈显著性负相关,试验中颗粒硬度、颗粒成形率及颗粒耐久性指数受到调质温度与模孔长径比的显著性影响,调质温度及模孔长径比越高,颗粒硬度、颗粒成形率及颗粒耐久性指数越高,高调质温度及模孔长径比对乳酸菌保留率呈负面影响,对调质温度(X)、模孔长径比(Y)与乳酸菌保留率(Z3),作回归模型(n=4),如式(5)。
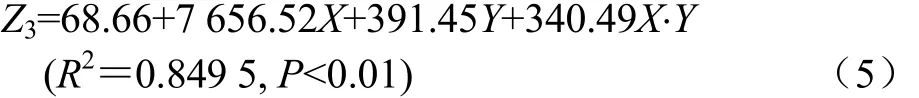
即该模型具有良好的预测精度。吨料电耗与颗粒耐久性指数呈及显著性正相关,对调质温度(X)、模孔长径比(Y)与吨料电耗(Z4),作回归模型(n=4),如式(6)。
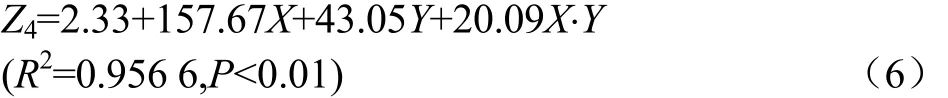
3 结 论
1)熟化大宗原料添加热敏性原料后混合低温调质制粒,颗粒饲料加工质量均满足要求,颗粒成形率均 96%以上,颗粒耐久性指数均大于95%。
2)颗粒饲料加工质量受到调质温度与模孔长径比双因素共同作用,低温调质制粒时,模孔长径比对颗粒饲料加工质量及乳酸菌保留率的影响程度高于调质温度的作用,同时,模孔长径比越高,制粒能耗越高,低温制粒加工参数调质温度为55~60℃,模孔长径比推荐为6∶1。
[1] Svihus B, Klovstad K H, Perez V, et al. Physical and nutritional effects of pelleting of broiler chicken diets made from wheat ground to different coarsenesses by the use of roller mill and hammer mill [J]. Animal Feed Science And Technology, 2004(117): 281-293.
[2] Van der P, Bosch M W. Effect of expander conditioning and or pelleting of a diet containing tapioca pea and soybean meal on the total tract digestibility in growing pigs[J]. Animal Feed Science and Technology, 1997: 289-295.
[3] Liermann W, Berk A, Boschen V, et al. Effects of particle size and hydro-thermal treatment of feed on performance and stomach health in fattening pigs[J]. Archives of Animal Nutrition, 2015(69): 455-472.
[4] Amornthewaphat N, Attamangkune S. Extrusion and animal performance effects of extruded maize quality on digestibility and growth performance in rats and nursery pigs [J]. Animal Feed Science and Technology, 2008(144): 292-305.
[5] 段海涛,李军国,张建,等. 膨胀器不同环隙开度对饲料品质和断奶仔猪生长性能的影响[J]. 动物营养学报,2015:1511-1518.
[6] Behnke K C. Feed manufacturing technology: Current issues and challenges [J]. Animal Feed Science And Technology,1996(62): 49-57.
[7] Medel P, Latorre M A, de Blas C, et al. Heat processing of cereals in mash or pellet diets for young pigs [J]. Animal Feed Science and Technology, 2004(113): 127-140.
[8] Lundblad K K, Hancock J D, Behnke K C, et al. The effect of adding water into the mixer on pelleting efficiency and pellet quality in diets for finishing pigs without and with use of an expander[J]. Animal Feed Science and Technology,2009(150): 295-302.
[9] 张现玲,秦玉昌,李俊,等. 调质温度对肉鸡颗粒饲料质量影响的实验研究[J]. 饲料工业,2013(21):24-28.
[10] Lewis L L, Stark C R, Fahrenholz A C, et al. Evaluation of conditioning time and temperature on gelatinized starch and vitamin retention in a pelleted swine diet[J]. Journal of Animal Science. 2015, 93(2): 615-619.
[11] Spring P, Newman K E, Wenk C, et al. Effect of pelleting temperature on the activity of different enzymes[J]. Poultry Science. 1996, 75(3): 357-361.
[12] Svihus B, Sacranie A, Denstadli V, et al. Nutrient utilization and functionality of the anterior digestive tract caused by intermittent feeding and inclusion of whole wheat in diets for broiler chickens[J]. Poultry Science. 2010, 89(12):2617-2625.
[13] Zimonja O, Svihus B. Effects of processing of wheat or oats starch on physical pellet quality and nutritional value for broilers[J]. Animal Feed Science and Technology. 2009,149(3): 287-297.
[14] Council N R. Nutrient Requirements of Swine: Eleventh Revised Edition [M]. Washington DC: The National Academies Press, 2012.
[15] 熊易强. 饲料淀粉糊化度(熟化度)的测定[J]. 饲料工业,2000,21(3):30-31.
[16] 常碧影,张萍. 饲料质量与安全检测技术[M]. 北京:化学工业出版社. 2008.
[17] Thomas M, van der P A F B. Physical quality of pelleted animal feed. Criteria for pellet quality [J]. Animal Feed Science and Technology, 1996(61): 89-112.
[18] 段海涛,李军国,葛春雨,等. 高效调质低温制粒工艺对颗粒饲料加工质量及维生素E保留率的影响[J]. 动物营养学报,2017:4101-4107.
[19] Duan H, Li J, Xue M, et al. Effects of conditioners(single-layer, double-layer and retention-conditioner) on the growth performance, meat quality and intestinal morphology of growing and finishing pigs [J]. Journal of Integrative Agriculture, 2018, 17(4): 919—927.
[20] De Cruz C R, Kamarudin M S, Saad C R, et al. Effects of extruder die temperature on the physical properties of extruded fish pellets containing taro and broken rice starch [J].Animal Feed Science and Technology, 2015(199):137-145.
[21] Kanmani N, Romano N, Ebrahimi M, et al. Improvement of feed pellet characteristics by dietary pre-gelatinized starch and their subsequent effects on growth and physiology in tilapia [J]. Food Chem, 2018(239): 1037-1046.
[22] Romano N, Kanmani N, Ebrahimi M, et al. Combination of dietary pre-gelatinized starch and isomaltooligosaccharides improved pellet characteristics, subsequent feeding efficiencies and physiological status in African catfish, Clarias gariepinus,juveniles [J]. Aquaculture, 2018(484): 293-302.
[23] Abdollahi M R, Ravindran V, Wester T J, et al. Influence of conditioning temperature on performance, apparent metabolisable energy, ileal digestibility of starch and nitrogen and the quality of pellets, in broiler starters fed maize- and sorghum-based diets[J]. Animal Feed Science and Technology,2010(162): 106-115.
[24] Svihus B, Zimonja O. Chemical alterations with nutritional consequences due to pelleting animal feeds: A review [J].Animal Production Science, 2011(51): 590-596.
[25] Lewis L L, Stark C R, Fahrenholz A C, et al. Evaluation of conditioning time and temperature on gelatinized starch and vitamin retention in a pelleted swine diet [J]. Journal Of Animal Science, 2015(93): 615-619.
[26] Thomas M, van Zuilichem D J, van der Poel A F B. Physical quality of pelleted animal feed. Contribution of processes and its conditions [J]. Animal Feed Science and Technology,1997(64): 173-192.
[27] Svihus B, Kløvstad K H, Perez V, et al. Physical and nutritional effects of pelleting of broiler chicken diets made from wheat ground to different coarsenesses by the use of roller mill and hammer mill [J]. Animal Feed Science and Technology, 2004(117): 281-293.
[28] Thomas M, van Vliet T, van der P A F B. Physical quality of pelleted animal feed 3. Contribution of feedstuff components[J]. Animal Feed Science and Technology,1998(70): 59-78.
[29] 马成林,左春柽,张守勤,等. 高压对玉米淀粉糊化度影响的研究[J]. 农业工程学报,1997,13(1):178-182.Ma Chenglin, Zuo Chuncheng, Zhang Shouqin, et al. Effect of high pressure on gelatiization degree of maize starch [J].Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE). 1997, 13(1): 178-182. (in Chinese with English abstract)
[30] Sakiyan O, Sumnu G, Sahin S, et al. A study on degree of starch gelatinization in cakes baked in three different ovens[J]. Food and Bioprocess Technology, 2009(4): 1237-1244.
[31] Hilton J, Cho C, Slinger S. Effect of extrusion processing and steam pelleting diets on pellet durability, pellet water absorption, and the physiological response of rainbow trout(Salmo gairdneri R.)[J]. Aquaculture, 1981(25): 185-194.
[32] Hassan Y I, Zhou T, Bullerman L B. Sourdough lactic acid bacteria as antifungal and mycotoxin-controlling agents [J].Food Science And Technology International, 2016(22):79-90.
[33] Willamil J, Creus E, Perez J F, et al. Effect of a microencapsulated feed additive of lactic and formic acid on the prevalence of Salmonella in pigs arriving at the abattoir[J]. Archives of animal nutrition, 2011(65): 431-444.
[34] Dowarah R, Verma A K, Agarwal N, et al. Effect of swine based probiotic on performance, diarrhoea scores, intestinal microbiota and gut health of grower-finisher crossbred pigs[J]. Livestock Science, 2017(195): 74-79.

