贝伐珠单抗联合化疗对复治晚期非鳞非小细胞肺癌患者的疗效及预后分析
肺癌的发病率和死亡率均位居恶性肿瘤前列,其中非小细胞肺癌约占85%[1],化疗是晚期非小细胞肺癌患者重要的治疗方法之一。绝大部分患者在一线治疗后至疾病进展(progressive disease,PD),而二线化疗的有效率仅为8%~10%,中位无进展生存期(progression-free survival,PFS)约2~4个月,中位总生存期(overall survival,OS)约8~10个月[2],三线化疗的疗效进一步下降,因此亟待寻找能够提高疗效的药物或方案。
新血管生成是肿瘤生长和演进的先决条件,血管内皮生长因子(vascular endothelial growth factor,VEGF)是重要的促血管生成的因子,能促使非正常的新生血管生成。这些血管具有无序的组织结构和异质性,通过提供氧气和养分促进肿瘤生长,使肿瘤细胞逃脱进入血液循环,导致肿瘤转移[3]。贝伐珠单抗作为一种抗VEGF的单克隆抗体,能够抑制VEGF与其受体结合,抑制肿瘤血管再生,促使肿瘤新生血管退化及存活血管正常化,达到抑制肿瘤生长和转移的效果。多项研究证实,与单纯化疗相比,化疗联合贝伐珠单抗治疗初治非鳞非小细胞肺癌(nonsquamous non-small cell lung cancer,NSNSCLC)患者,可提高治疗有效率、PFS及OS[4],但有关该治疗方案对复治NSNSCLC患者的疗效及预后因素分析的研究较少。本研究旨在评价贝伐珠单抗联合化疗对复治晚期患者的疗效、安全性,并分析影响预后的因素。
1 材料与方法
1.1 临床资料
选取2013年2月至2017年6月于北京胸科医院住院治疗、经病理组织学或细胞学确诊的ⅢB或Ⅳ期复治晚期NSNSCLC患者共41例。其中男性17例,女性24例,年龄38~78岁,中位年龄61岁;ⅢB期3例,Ⅳ期38例。腺癌38例,其他病理类型3例。二线治疗患者19例,二线以上治疗患者22例。表皮生长因子受体(epidermal growth factor receptor,EGFR)突变阳性18例,突变阴性23例(表1)。
入选标准:年龄≥18岁,体力状态评分(PS)<3分,预计生存期>3个月;有可测量的病灶;骨髓储备功能良好,心肝肾功能及凝血功能正常;4个周期内无重大手术或伤口未完全愈合,无未控制的脑转移,无重要血管受侵,无不能控制的高血压,无出血倾向或正接受抗凝治疗,6个月内无活动性心脑血管疾病;本研究通过北京胸科医院伦理委员会审查批准,治疗前告知患者治疗方案并签署知情同意书。

表1 41例复治晚期NSNSCLC患者的临床资料
1.2 方法
1.2.1 治疗方案 培美曲塞500 mg/m2,静脉滴注,d1;多西他赛75 mg/m2,静脉滴注,d1;吉西他滨1 250 mg/m2,静脉滴注,d1、8;紫杉醇175 mg/m2,静脉滴注,d1。患者PS≤1分时,可在上述某一药物的基础上加一种铂类药物:顺铂75 mg/m2,静脉滴注,d1;卡铂AUC为5,静脉滴注,d1;奈达铂80 mg/m2,静脉滴注,d1。化疗同时给予贝伐珠单抗15 mg/m2或7.5 mg/m2,静脉滴注,d1。化疗及贝伐珠单抗治疗均以每3周为1个周期。化疗最多进行4个周期,疾病控制的患者接受贝伐珠单抗维持治疗,直到疾病进展或不良反应不可耐受。
1.2.2 疗效评价标准 治疗期间每2个周期进行影像学评估,根据RECIST 1.1版标准,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)以CR+PR所占的比例计算,疾病控制率(disease control rate,DCR)为CR+PR+SD所占的比例。不良事件采用CTCAE 4.0版标准进行评价,分为1~5级。
1.2.3 随访 采用患者来院或电话随访,随访截止日期为2017年9月30日。随访时间2~32个月,平均随访期13个月。PFS定义为从开始接受贝伐珠单抗联合化疗至疾病进展或死亡的时间,OS定义为患者自接受贝伐珠单抗联合化疗起至患者死亡或末次随访时间。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。频数资料用百分率(%)表示,频数资料组间比较采用连续校正χ2检验。生存分析采用Kaplan-Meier法,生存期组间比较采用Log-rank法,多因素分析使用Cox回归模型。以P<0.05为差异具有统计学意义。
2 结果
2.1 治疗情况及疗效评价
所有患者均接受化疗及贝伐珠单抗治疗,化疗平均周期数为3.1个,贝伐珠单抗治疗的平均周期数为5.0个。24例(58.5%)患者完成了4个周期联合治疗,16例(39.0%)患者接受了贝伐珠单抗维持治疗。41例患者均可评价疗效,其中无CR病例,5例(12.2%)获得PR,29例(70.7%)达到SD,PD患者7例(17.1%),ORR为12.2%,DCR为82.9%。其中二线治疗与二线以上治疗的患者疗效接近,ORR分别为10.5%、13.6%(P=0.572),DCR分别为89.5%和77.3%(P=0.271),差异无统计学意义。全组患者中位PFS为4.6个月(95%CI:3.619~5.581,图1A),中位OS为11.9个月(95%CI:9.797~14.003,图1B)。
2.2 单因素分析
Log-rank法单因素分析显示,EGFR突变阳性、贝伐珠单抗治疗>4个周期及女性患者具有更优的OS(χ2=19.673,P<0.001;χ2=6.820,P=0.009;χ2=6.374,P=0.012;表2,图2)。而年龄、吸烟史、PS评分、治疗线数(二线或二线以上)、近期疗效是否达到PR与OS无关(表2)。
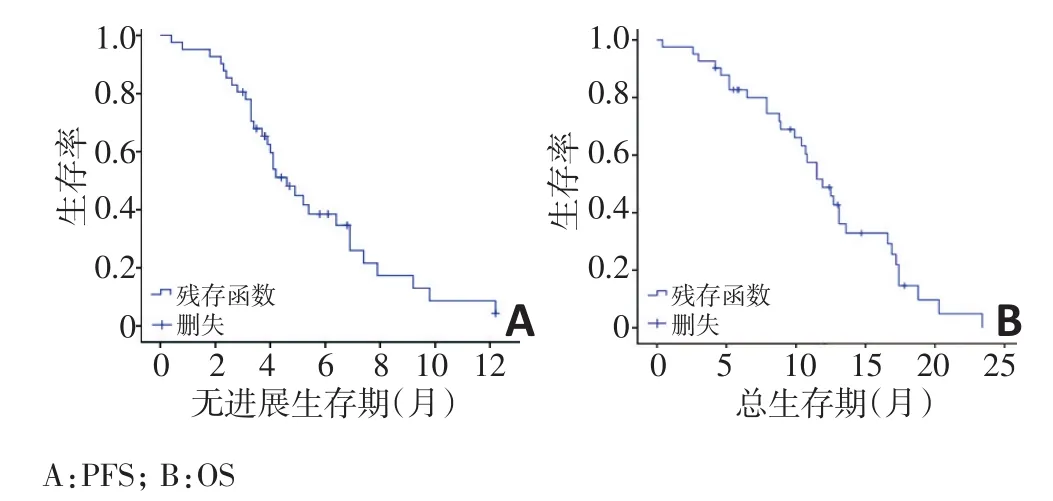
图1 41例复治晚期NSNSCLC患者的PFS和OS曲线

表2 影响41例复治晚期NSNSCLC患者OS的单因素分析

图2 Log-rank法对41例复治晚期NSNSCLC患者EGFR突变状态、贝伐珠单抗使用周期数、性别的生存比较
2.3 多因素分析
将影响患者预后的单因素共同纳入Cox回归多因素分析,结果显示,EGFR突变状态、贝伐珠单抗治疗周期数(≤4个或>4个)是影响患者生存的独立预后因素(HR=0.129,P=0.001;HR=0.336,P=0.012,表3)。

表3 影响41例复治晚期NSNSCLC患者OS的多因素分析
2.4 不良反应
主要不良反应为骨髓抑制、消化道反应、肝功能异常、出血、高血压、蛋白尿、深静脉血栓等。其中SAE 1例,为5级咯血。另有19例3级骨髓抑制、1例3级蛋白尿、1例3级深静脉血栓,其余均为1、2级。
3 讨论
抗血管生成药物如贝伐珠单抗联合化疗对于初治NSNSCLC患者的疗效和安全性已得到多项研究的证实[5-7],但这种联合治疗的方案用于二线及二线以上患者的疗效尚无定论[8-11]。本研究回顾性分析了贝伐珠单抗联合化疗对复治晚期NSNSCLC患者的疗效和安全性,并探讨影响预后的因素。
一项二期研究[12]包括9例脑转移病例在内的共36例复治非小细胞肺癌患者,接受贝伐珠单抗+奥沙利铂+培美曲塞的治疗,获得27%的反应率和71%的临床获益率,中位PFS为5.8个月,中位OS为12.5个月。此后两项国外的二期研究和一些国内研究也报道了类似的结果。Yamada等[13]对28例复治NSN⁃SCLC患者给予替吉奥联合贝伐珠单抗治疗,中位PFS为3.2个月,中位OS为11.4个月,ORR及DCR分别为14.3%、85.5%。Nishino等[14]报道两组患者各45例分别接受多西他赛加贝伐珠单抗、替吉奥加贝伐珠单抗的二线治疗,中位PFS分别为3.9、3.5个月,ORR分别为22.2%、2.2%,DCR均为62.2%。郑静娴等[15]研究得出采用贝伐珠单抗联合化疗治疗84例复治NSNSCLC患者,有效率和DCR分别为14.8%和64.8%,中位PFS和OS分别为3.8个月和8.8个月。Quan等[16]研究发现,40例NSNSCLC患者接受含贝伐珠单抗的化疗,2个周期后获得5%的反应率和50%的DCR,中位OS达29.6个月。本研究显示,全体患者的ORR为12.2%,DCR为82.9%,中位PFS和OS分别为4.6个月和11.9个月。提示在化疗的基础上增加贝伐珠单抗,可为复治NSNSCLC患者带来明显的治疗获益。贝伐珠单抗与化疗药的协同作用,其机制可能在于贝伐珠单抗能够诱导肿瘤血管正常化,从而改善肿瘤间质的高压状态,促进化疗药物有效地分布到肿瘤组织中[17]。
非小细胞肺癌三线化疗的疗效通常低于二线化疗。而本研究中二线与二线以上患者的疗效无显著性差异:ORR分别为10.5%、13.6%(P=0.572),DCR分别为89.5%和77.3%(P=0.271),OS分别为11.9个月、10.8个月(P=0.980)。与本研究结果相似,Cortot等[18]报道了针对166例复治非小细胞肺癌患者的Ⅲ期研究结果,不论二线治疗还是三线治疗,紫杉醇+贝伐珠单抗优于多西他赛单药方案。由此提示:对于多线治疗的NSCLC患者,化疗加贝伐珠单抗是一个可供选择的合理方案。
本研究单因素分析显示,EGFR突变阳性、贝伐珠单抗治疗>4个周期及女性能获得更长的生存期;多因素分析表明,EGFR突变状态、贝伐珠单抗治疗周期数是影响患者生存的独立因素。EGFR基因状态与预后有关,可能的原因在于:1)EGFR突变阳性的患者化疗疗效优于突变阴性的患者;2)这类人群在后续治疗中更有可能使用EGFR-TKI并获益;3)EGFR与VEGF受体在细胞内有共同的下游信号通路,因此贝伐珠单抗可能对具有EGFR突变的肿瘤细胞产生更大的直接或间接作用[19]。在结直肠癌的研究中发现,暂停抗血管药物可能加速肿瘤进展,产生“反弹”的效果,这为贝伐珠单抗维持治疗和PD后继续治疗提供了理论依据[3],也能解释本研究的结果,贝伐珠单抗治疗4个周期以上的患者预后较好。
有学者对贝伐珠单抗疗效相关的因素进行了研究。郑静娴等[15]研究EGFR基因突变或EGFR-TKI治疗有效者的预后好于EGFR基因野生型或EGFRTKI治疗无效者(P<0.05),含贝伐珠单抗化疗4个周期以上者比<4个周期者预后更佳(P<0.05)。这一结论与本研究结果一致。秦叔逵等[20]总结了606例转移性结直肠癌患者的数据发现,贝伐珠单抗联合含氟尿嘧啶类方案化疗≥8个周期患者的生存获益明显优于<8个周期的患者(中位PFS:P=0.000 1;中位OS:P=0.001)。WJOG 5910L研究亚组分析显示,一线治疗有效、从一线治疗至PD至少6个月的患者获益更大[9]。Liu等[19]认为,PS评分、肿瘤的组织学分型和分子特征是复治肺癌患者获得更好疗效的重要选择因素。Quan等[16]发现年轻患者更容易从含贝伐珠单抗的化疗中获益。贝伐珠单抗联合化疗治疗非小细胞肺癌的预后因素目前尚无确切结论,有待更大规模的深入研究。
现阶段尚缺乏能够鉴别贝伐珠单抗获益人群的生物标记物,因此仅能通过临床特征(如血压控制可、无大咯血、无血栓栓塞等)筛选患者,将不良反应降至最低[3]。目前研究的标记物包括VEGF、VEGF受体、血清一氧化氮等,部分标记物具有疗效预测作用,但尚未得到普遍的认可[21-22]。
本研究中41例患者基本可耐受出现的不良反应。出血是贝伐珠单抗常见的不良反应,仅出现1例致死性大咯血。目前虽然无可靠的影像学特征能够预测贝伐珠单抗相关的肺出血,但肿瘤侵犯或包绕大血管、支气管血管提示有肺出血的可能[22]。
本研究提示,贝伐珠单联合化疗具有较高的有效率和可控的安全性,可作为复治晚期NSNSCLC患者的一个适合的治疗选择。EGFR突变阳性、贝伐珠单抗应用4个周期以上的患者具有明显的生存优势。另外,还有许多问题值得深入探讨,如贝伐珠单抗最佳的使用周期数;化疗4个周期后的维持治疗方案,应选贝伐珠单抗单药还是与化疗药联合;能否找出可以确切预测疗效和预后的生物标记物,用以筛选优势人群等,期待更多的大规模的临床研究进行解答。
[1]Reck M,Rabe KF.Precision diagnosis and treatment for advanced non‐small‐cell lung cancer[J].N Engl J Med,2017,377(9):849‐861.
[2]Weiss JM,Stinchcombe TE.Second‐line therapy for advanced NSCLC[J].Oncologist,2013,18(8):947‐953.
[3]Manzo A,Montanino A,Carillio G,et al.Angiogenesis inhibitors in NSCLC[J].Int J Mol Sci,2017,18(10):2021‐2037.
[4]Gentzler RD,Patel JD.Optimal first‐line and maintenance treat‐ments for advanced‐stage nonsquamous non‐small cell lung cancer[J].J Natl Compr Canc Netw,2014,12(6):889‐897.
[5]Sandler A,Gray R,Perry MC,et al.Paclitaxel‐carboplatin alone or with bevacizumab for non‐small‐cell lung cancer[J],2006,355(24):2542‐2550.
[6]Reck M,von Pawel J,Zatloukal P,et al.PhaseⅢtrial of cisplatin plus gemcitabine with either placebo or bevacizumab as first‐line therapy for nonsquamous non‐small‐cell lung cancer:AVAiL[J].J Clin Oncol,2009,27(8):1227‐1234.
[7]Zhou C,Wu YL,Chen G,et al.Beyond:a randomized,double‐blind,placebo‐controlled,multicenter,phase Ⅲ study of first‐line carbo‐platin/paclitaxel plus bevacizumab or placebo in chinese patients with advanced or recurrent nonsquamous non‐small‐cell lung can‐cer[J].J Clin Oncol,2015,33(19):2197‐2204.
[8]Barnfield PC,Ellis PM.Second‐line treatment of non‐small cell lung cancer:new developments for tumours not harbouring targetable oncogenic driver mutations[J].Drugs,2016,76(14):1321‐1336.
[9]Takeda M,Yamanaka T,Seto T,et al.Bevacizumab beyond disease progression after first‐line treatment with bevacizumab plus che‐motherapy in advanced nonsquamous non‐small cell lung cancer(west Japan oncology group 5910l):an open‐label,randomized,phase 2 trial[J].Cancer,2016,122(7):1050‐1059.
[10]Garon EB,Ciuleanu TE,Arrieta O,et al.Ramucirumab plus docetax‐el versus placebo plus docetaxel for second‐line treatment of stageⅣ non‐small‐cell lung cancer after disease progression on plati‐num‐based therapy(REVEL):a multicentre,double‐blind,ran‐domised phase 3 trial[J].Lancet,2014,384(9944):665‐673.
[11]Raphael J,Chan K,Karim S,et al.Antiangiogenic therapy in ad‐vanced non‐small‐cell lung cancer:a meta‐analysis of phase Ⅲ ran‐domized trials[J].Clin Lung Cancer,2017,18(4):345‐353.
[12]Heist RS,Fidias P,Huberman M,et al.A phase Ⅱ study of oxaliplat‐in,pemetrexed,and bevacizumab in previously treated advanced non‐small cell lung cancer[J].J Thorac Oncol,2008,3(10):1153‐1158.
[13]Yamada K,Ichiki M,Takahashi K,et al.A multicenter phaseⅡtrial of S‐1 combined with bevacizumab after platinum‐based chemo‐therapy in patients with advanced non‐squamous non‐small cell lung cancer[J].Cancer Chemother Pharmcol,2016,78(3):501‐507.
[14]Nishino K,Imamura F,Kumagai T,et al.A randomized phaseⅡstudy of bevacizumab in combination with docetaxel or S‐1 in pa‐tients with non‐squamous non‐small‐cell lung cancer previously treated with platinum based chemotherapy(HANSHIN oncology group 0110)[J].Lung Cancer,2015,89(2):146‐153.
[15]郑静娴,张晶,林晶,等.贝伐珠单抗联合化疗治疗复治晚期非鳞非小细胞肺癌的疗效及安全性观察[J].临床肿瘤学杂志,2015,2015(7):633‐636.
[16]Quan R,Huang J,Chen N,et al.A retrospective analysis of efficacy and safety of adding bevacizumab to chemotherapy as first‐and second‐line therapy in advanced non‐small‐cell lung cancer(NSCLC)[J].Tumor Biol,2016,37(8):11479‐11484.
[17]Assoun S,Brosseau S,Steinmetz C,et al.Bevacizumab in advanced lung cancer:state of the art[J].Future Oncol,2017,13(28):2515‐2535.
[18]Cortot A,Audigier‐Valette C,Molinier O,et al.Weekly paclitaxel plus bevacizumab versus docetaxel as second or third‐line treat‐ment in advanced non‐squamous non‐small cell lung cancer[J].J Clin Oncol,2016,34(Suppl 15):9005.
[19]Liu KJ,Ding LY,Wu HY.Bevacizumab in combination with anticancer drugs for previously treated advanced non‐small cell lung cancer[J].Tumor Biol,2015,36(3):1323‐1327.
[20]秦叔逵,邓艳红,毕锋,等.贝伐珠单抗联合含氟尿嘧啶类化疗方案治疗晚期转移性结直肠癌的前瞻性、非干预性、全国多中心临床研究(REACT)[J].临床肿瘤学杂志,2016,21(10):865‐873.
[21]Ahmadizar F,Onland‐Moret NC,de Boer A,et al.Efficacy and safety assessment of the addition of bevacizumab to adjuvant therapy agents in cancer patients:a systematic review and meta‐analysis of randomized controlled trials[J].PLoS One,2015,10(9):e136324.
[22]Muto S,Takagi H,Owada Y,et al.Serum nitric oxide as a predictive biomarker for bevacizumab in non‐small cell lung cancer patients[J].Anticancer Res,2017,37(6):3169‐3174.

