一种篮式生物反应器内Vero细胞计数方法的建立
周 蕾, 陈 建 民, 王 鑫, 宋 云 增, 张 春 枝
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.大连雅立峰生物制药有限公司, 辽宁 大连 116620 )
0 引 言
生物反应器微载体细胞培养技术已广泛应用于生物制药业,它实现了动物细胞的大规模、高密度培养。此技术培养的细胞种类越来越多,规模越来越大,生产产品的种类也越来越多。例如,Celltech公司建立了10 000 L的细胞生物反应器,培养杂交瘤细胞生产单克隆抗体[1-2]。应用培养杂交瘤细胞生产多克隆抗体[3-4],培养Vero细胞制造病毒产品。巴斯德研究所曾对用生物反应器培养Vero细胞制备狂犬病疫苗做过详细的报道[6]。我国目前生物反应器的应用越来越广泛,技术也逐渐成熟,尤其在人用疫苗生产方面应用较多[6-7]。
载体按外形可分为片状载体和球状载体两大类,虽然Hassanzadeh等[8]研究证明了FibraCel disks片状载体培养Vero细胞制备狂犬病疫苗的产量高于Cytodex-1球状载体,但因片状载体被固定在反应器的篮筐内无法取样,使得细胞计数成为一大难题,从而导致片状载体的应用受到一定的影响。为了解决这一问题,推广片状载体的应用,本实验建立了一种简单快捷的用于篮式生物反应器(片状载体)内的细胞计数方法,以期为片状载体工艺中的细胞计数提供参考依据。
1 材料与方法
1.1 材 料
1.1.1 原料与试剂
Vero细胞,原始细胞株来源于美国菌种保藏中心,实验用细胞为大连雅立峰生物制药有限公司提供的工作细胞库细胞。
含4%胎牛血清、终浓度4 mmol/L谷氨酰胺的细胞生长液,M199培养基,含胰蛋白酶和EDTA 的细胞消化液,PBS(酚红)溶液。所有溶液均经过0.22 μm除菌过滤。
1.1.2 主要设备
BioFlo310型篮式生物反应器,美国NBS公司;SF系列活细胞在线分析仪,德国ABER公司;SBA-40E型生物传感分析仪,山东省科学院生物研究所;SHXJ-Ⅷ型生物细胞菌苗培养机,兰州飞控仪器总厂生化设备制造厂;XIT4S0001型完整性检测仪,默克化工技术(上海)有限公司;筒式除菌滤器,赛多利斯公司。
1.2 方 法
1.2.1 Vero细胞浓度与电容对应关系的确定
利用德国ABER活细胞在线分析仪监测反应器内Vero细胞所释放的电容计算细胞数量,但因不同细胞所释放的电容不同,故先用已知浓度的Vero细胞校准ABER活细胞在线分析仪的电容电极,求得校准系数(K)。
取细胞冻存管1支,经细胞复苏及传代扩增后制成10瓶T25方瓶Vero细胞,消化后将细胞悬液收集在1个方瓶内。取1 mL细胞悬液先进行人工计数,用ABER活细胞计数仪测量方瓶内的电容。每次测量后将方瓶内的细胞悬液进行稀释,进行人工计数和电容测量,反复12次。用Excel绘制电容与细胞数线性关系图,得到一次线性方程,求得K,即1 F电容相当于多少个Vero 细胞数。
1.2.2 生物反应器内细胞培养阶段葡萄糖消耗量与细胞数量关系的建立
将ABER活细胞计数仪的检测探头插入生物反应器罐体内,连续测量反应器内各个阶段Vero细胞所释放的电容。同时,在Vero细胞生长过程中间歇性取出反应器内培养液样品,用SBA-40E型生物传感分析仪检测培养液中的葡萄糖含量和乳酸含量。
当反应器内培养液的葡萄糖质量浓度下降至1.2 g/L时,向反应器内注入新鲜的细胞生长液,并维持葡萄糖质量浓度不低于0.8 g/L。记录连续监测到的葡萄糖质量浓度、乳酸质量浓度、电容,根据K,将电容折算为Vero细胞数,用Excel绘制细胞数与葡萄糖消耗量的线性关系图,建立葡萄糖消耗量与Vero细胞数之间的关系。
2 结果与讨论
2.1 标准系数(K)的确定
将12次测量所得的细胞浓度与电容统计于表1中。根据表1数据,利用Excel表格绘制Vero 细胞浓度与电容的线性关系,得到一次线性方程:y=299 011x-86 490,R2=0.980 1。实际上当x=0时,y也应为0,考虑到在细胞计数过程中存在一定的偏差,因此方程中的常数忽略不计,得到细胞浓度与电容之间的关系:y=299 011x,即K=2.99×105个/(mL·F)。
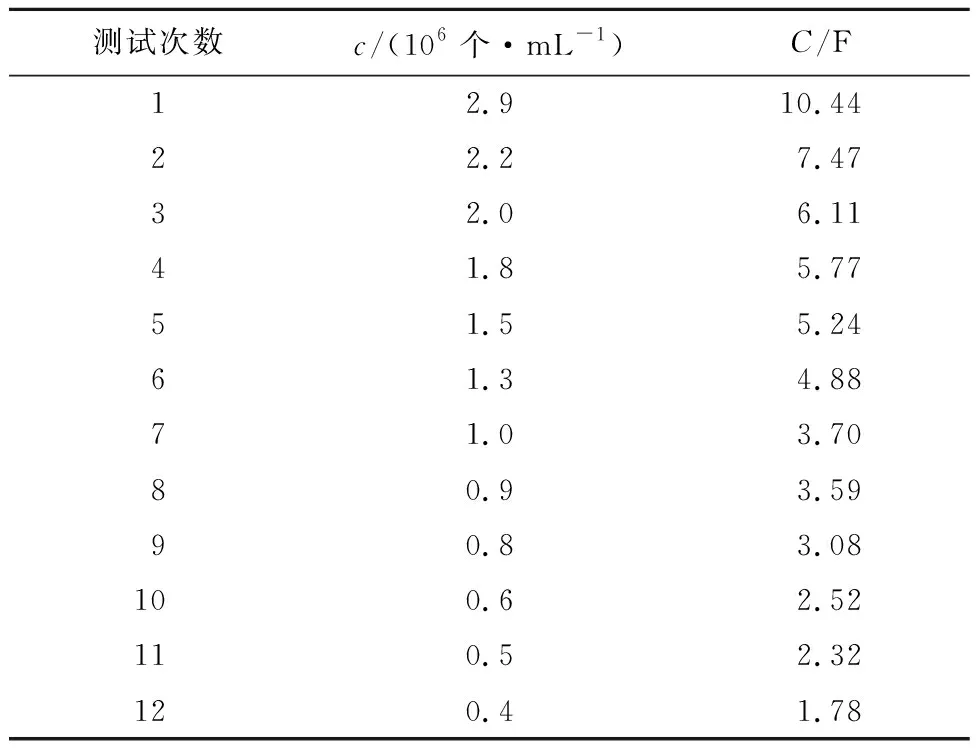
表1 不同细胞浓度下的电容
2.2 反应器内葡萄糖消耗量与细胞数的关系
根据“2.1”所得K,将不同时间点所监测的电容转化为Vero细胞数,根据葡萄糖消耗量,得到Vero细胞数与葡萄糖消耗量的线性方程y=0.534 5×109x。当x=1时,y=5.345×108,即每消耗1 g葡萄糖可供5.345×108个Vero细胞生长繁殖。Vero细胞数与葡萄糖消耗量关系公式为
N=5.345×108×m
式中:N为Vero细胞数,个;m为葡萄糖消耗量,g;5.345×108为系数,个/g。
史秀山[9]研究发现,每生长繁殖106个Vero消耗7.2×10-3mmol葡萄糖,即每消耗1 g葡萄糖可供7.71×108个Vero细胞生长繁殖。实验结果与文献[9]结果略有差异,在正常范围。
2.3 Vero细胞在生物反应器内的生长周期
Vero细胞在前36 h生长缓慢,处于停滞期,此阶段细胞在逐渐适应新的生长环境,并不断地合成前体,为细胞的增殖做准备。36 h后,细胞进入对数生长期,葡萄糖消耗量开始不断增加,在96~120 h达到生长的最高峰,而后处于平衡期。对于需要接种病毒的细胞来说,此时接种最佳。生物反应器为Vero细胞培养阶段的生长曲线见图1。
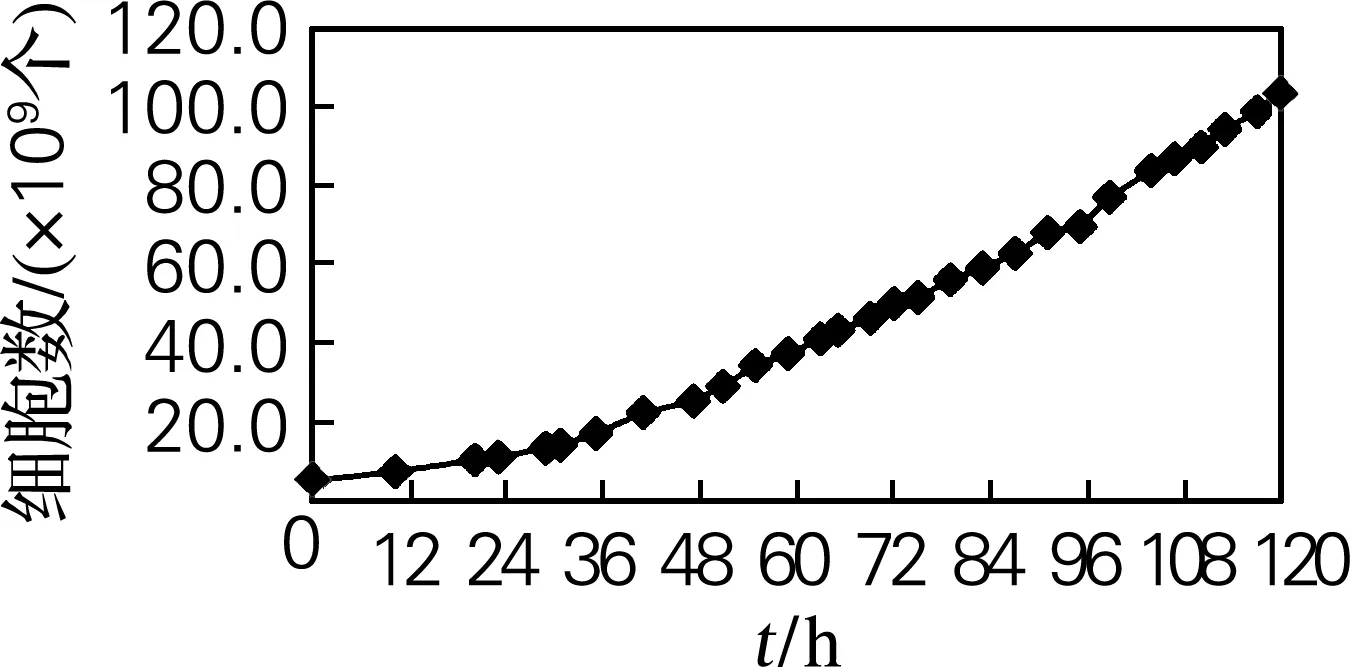
图1 生物反应器内Vero细胞的生长曲线
2.4 生物反应器中Vero细胞培养阶段葡萄糖的代谢
在Vero细胞培养的120 h内,葡萄糖消耗总量累计约230 g。在培养前30 h,耗糖量21~26 g,平均葡萄糖消耗速率约为0.8 g/h;48~65 h,平均葡萄糖消耗速率上升为1.5 g/h;84~120 h时葡萄糖消耗速率最快,为3.0~3.5 g/h。
随着培养时间的延长,细胞数量不断增加,葡萄糖的消耗速率也随之增加,为保证罐体内培养环境的相对稳定,培养期间不断增加灌流速度,将罐体内葡萄糖质量浓度控制在(1.0±0.2) g/L,既保证为细胞生长繁殖提供充足的营养物质,使细胞保持良好的生理状态,又能最大限度地利用培养基,节约培养基成本。
Vero细胞培养阶段罐内葡萄糖剩余质量浓度及消耗情况见图2、图3。

图2 不同培养阶段葡萄糖的剩余量
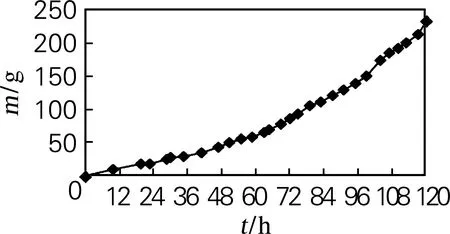
图3 不同培养阶段葡萄糖的消耗量
2.5 葡萄糖消耗与乳酸生成的关系
Vero细胞生长所消耗的葡萄糖,绝大多数通过糖酵解途径生成乳酸,许多研究表明乳酸对细胞生长具有毒性,且不同细胞的耐受能力不同。乳酸浓度低于24.8 mmol/L时,对细胞生长的影响较小;乳酸浓度高于30 mmol/L时,对细胞的影响较大,细胞存活率在培养过程中快速下降。
图4为反应器细胞Vero培养阶段罐内乳酸含量水平,整个细胞培养阶段仅个别时间点的乳酸质量浓度最高,达到了2.5 g/L(27.8 mmol/L),其他绝大多数时间内,乳酸质量浓度均在2.2 g/L(24.4 mmol/L)以下,对细胞生长影响较小。

图4 不同培养阶段产生乳酸的质量浓度
随着葡萄糖消耗量及消耗速率的增加,乳酸的生成量也随之上升,在12次平行实验中,获得反应器Vero细胞培养前30 h的葡萄糖消耗和乳酸生成数据,结果如表3所示。由表3可知,每消耗1 mmol葡萄糖约生成1.71 mmol乳酸,这与史秀山[9]研究的每消耗1 mmol葡萄糖约生成1.66 mmol 乳酸结果基本一致。
表3 细胞培养前30 h的葡萄糖消耗量和乳酸生成量关系
Tab.3 The relationship between glucose consumption and lactic acid generation in the first 30 h of cell culture stage

实验次数c/(mmol·L-1)葡萄糖乳酸cL/cG1127.8221.71.732133.3198.31.493127.8221.71.734116.7198.31.705116.7198.31.706144.4245.01.707138.9256.71.858144.4256.71.789138.9233.31.6810138.9233.31.6811133.3233.31.7512116.7198.31.70平均值131.5224.61.71注:cL/cG表示乳酸生成量和葡萄糖消耗量的比值。
3 结 论
通过采用ABER活细胞计数仪在线监测和葡萄糖质量浓度离线检测相结合的方法,建立了葡萄糖消耗量和Vero细胞数之间的计算关系。5 d累积消耗葡萄糖230 g,获得Vero细胞1.2×1011~1.3×1011个,即每消耗1 g葡萄糖可供5.345×108个细胞生长,为BioFlo310型篮式生物反应器Vero细胞培养提供一种计数方法。实验也对生物反应器内Vero细胞不同培养阶段的生长周期、葡萄糖代谢情况及葡萄糖消耗与乳酸生成的关系等进行了研究,对优化培养工艺、确定培养过程关键控制指标等提供参考依据。
[1] WANG G Z, ZHANG W Y, JACKLIN C, et al. Modified CelliGen-packed bed bioreactors for hybridoma cell cultures[J]. Cytotechnolgy, 1992, 9(1/2/3): 41-49.
[2] DENKBAS E B, HOFFMAN A S, PISKIN E. Silicone-based microcarriers preparation and BHK cell culture[J]. The Chemical Engineering Journal, 1995, 58(1): 65-70.
[3] WANG G Z, ZHANG W Y, JACKLIN C, et al. High cell density perfusion culture of hybridoma cells for production of monoclonal antibodies in the Celligen packed bed reactor[J]. Animal Cell Technology: Basic and Applied Aspects, 1993, 5: 463-469.
[4] VOIGT A, ZINTL F. Hybridoma cell growth and anti-neuroblastoma monoclonal antibody production in spinner flasks using a protein-free medium with microcarriers[J]. Journal of Biotechnology, 1999, 68(2/3): 213-226.
[5] ROUROU S, ARK A V D, VELDEN T V D, et al. A microcarrier cell culture process for propagating rabies virus in Vero cells grown in a stirred bioreactor under fully animal component free conditions[J]. Vaccine, 2007, 25(19): 3879-3889.
[6] 查力,高军,侯剑英,等.生物反应器细胞培养制备人用狂犬病疫苗[J].中国生物制品学杂志,2006,19(3):288-290.
[7] 乐威,叶林柏,张捷,等.微载体灌注培养制备Vero细胞狂犬病疫苗[J].中国病毒学,2004,19(4):373-375.
[8] HASSANZADEH S M, ZAVAREH A, SHOKRGOZAR M A, et al. High Vero cell density and rabies virus proliferation on fibracel disks versus cytodex-1 in spinner flask[J]. Pakistan Journal of Biological Sciences, 2011, 14(7): 441-448.
[9] 史秀山.生物反应器培养Vero细胞的生长代谢与限制因素研究[J].中国热带医学,2006,6(1):13-15.

