花青素加工贮藏稳定性的改善及应用研究进展
曾茜茜,雷 琳,赵国华,2,叶发银,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715;3.西南大学 食品科学与工程国家级实验教学示范中心,重庆 400715)
花青素是水溶性类黄酮色素,广泛存在于植物的果实、叶片和花中。花青素水溶液的颜色具有pH值依赖性,一般地,在酸性条件下呈红色或紫色,在碱性条件下呈蓝色[1]。花青素不仅赋予食品丰富的颜色,而且呈现出抗氧化[2]、抗炎、抗肿瘤、预防糖尿病和保护心脏[3]等多种生理保健功能,在食品饮料、医药和化妆品工业具有广阔的应用前景。然而,由于花青素天然的不稳定性,其应用受到限制。研究并改善花青素在食品加工贮藏过程中的稳定性,对于深入研究其功能特性以及拓宽其在食品饮料工业中的应用具有非常重要的意义[4]。本文重点就近年来国内外学者对花青素在加工贮藏过程中稳定性保持或提升的方法和技术进行分析和总结,以期为花青素进一步研究与开发提供参考。
1 花青素的结构
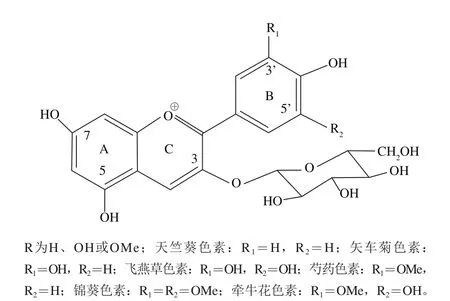
图1 花青素结构[5]Fig. 1 Structure of anthocyanins[5]
花青素属于类黄酮化合物,具有典型的C6-C3-C6碳骨架结构(图1),含有A、B两个苯甲酰环和含氧六元杂环(C),且C环上带有阳离子,极性较强,在不同pH值条件下化学结构会发生变化。自然界中游离态的花青素极少见,一般以糖苷形式存在,常与一个或多个葡萄糖、鼠李糖、半乳糖、阿拉伯糖等通过糖苷键形成花色苷。糖苷可取代3、5、7位,其中3-糖苷最为常见。自然界已知有22 类花青素,而在食品中主要为天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、锦葵色素和牵牛花色素6 类。
2 花青素的稳定性
花青素的稳定性较差,其降解不仅发生在从植物组织提取纯化的过程中,而且存在于食品的加工贮藏过程中[2]。影响花青素降解的主要因素是花青素的结构、外界温度、pH值和氧浓度,一些次要因素通常为水分活度、光、还原/氧化剂、酶等[6]。目前提高花青素稳定性的方法主要包括共色作用、复合作用、载体包埋等。
2.1 通过共色作用改善花青素的稳定性
花青素的共色作用指溶液中的花青素与无色或颜色很浅的有机化合物形成分子间缔合体,从而使得花青素颜色更深、更稳定[7]。这些有机化合物被称作共色素。共色素种类繁多,主要包括黄酮、酚酸、氨基酸、有机酸、生物碱、单宁等,甚至可以是花青素本身。共色作用存在多种机制,现已阐明的机制包括分子内或分子间相互作用以及自缔合作用[8]。当共色素通过共价作用(一般通过糖基化或酰基化进行)成为花青素分子的一部分时,称为分子内共色。共色素通过非共价作用(氢键、疏水力等)与花青素形成“花青素-共色素”复合物,加强花青素的呈色,称为分子间共色。一些花青素自身可作为共色素通过非共价作用互相缔合在一起,得到消光系数更高的复合体,称为自缔合作用[9]。因此,自缔合作用可视为分子间共色的一种特殊形式。
2.1.1 分子内共色作用
在GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中列出的花青素类着色剂(黑豆红、黑加仑红、红米红、落葵红、玫瑰茄红、葡萄皮红、桑椹红、杨梅红、越橘红、紫甘薯色素和萝卜红等),其着色稳定的原因在于这些色素提取物中主要为糖基化和酰基化的花青素[10]。一方面,通过分子内共色作用,糖单元上的羟基与通过氢键作用或酰化结合上去的芳环通过疏水作用与花青素母环进行复合,使其不易受到水的攻击,难以形成无色假碱和查耳酮[11-12]。另一方面,糖基化和酰基化的花青素更适宜与共色素发生分子间共色作用[13-14]。
就糖基化而言,花色苷的稳定性受糖基的类型、数量及结合位点的影响[15]。Rubinskiene等[16]研究发现:75 ℃处理黑加仑水提液150 min,对其中的4 种主要花色苷的稳定性和保留率无显著性影响;95 ℃处理150 min的结果表明,黑加仑中的4 种花色苷热稳定顺序为:矢车菊素-3-芸香糖苷>花翠素-3-芸香糖苷≈矢车菊素-3-葡萄糖苷(cyanidin-3-O-glucoside,C3G)>花翠素-3-葡萄糖苷。Reque等[17]研究了冻藏(-18 ℃、6 个月)条件下蓝莓中花色苷的保留情况,结果表明:蓝莓中飞燕草素-3-葡萄糖苷(80%降解)稳定性最差,天竺葵素-3-葡萄糖苷(9%降解)稳定性最好;此外,C3G(31%降解)的稳定性强于矢车菊素-3,5-双葡糖苷(55%降解)。
花色苷通过酰基化修饰(一般发生在糖单元的羟基上),得到的酰化花青素往往具有更高的加工贮藏稳定性。研究发现,与花青素共价结合的有机酸包括乙酸、草酸、L-乳酸、丙二酸、琥珀酸、苹果酸、酒石酸、戊二酸、芥酸等脂肪酸,以及对羟基苯甲酸、没食子酸、(E)-p-香豆酸、(E)-咖啡酸、(E)-3,5-二羟基肉桂酸、(E)-阿魏酸等芳香酸。酰化对花青素的稳定效应决定于酰基的种类、结合位点和数目[13]。一般地,带有芳香酰基的酰化花青素比带有脂肪酰基的酰化花青素稳定[18],多酰化花青素比单酰化花青素稳定[15]。此领域研究报道极多,具体可参考云南农业大学赵昶灵教授课题组的相关研究[19]。
2.1.2 分子间共色作用
2.1.2.1 自缔合效应
花青素自身作为共色素,通过自缔合效应使溶液颜色加深,稳定性增强。这类共色作用主要通过芳香母核之间的疏水相互作用实现垂直堆叠的分子复合物的形成及稳定化。花青素结构与浓度、溶液pH值、温度及溶剂对自缔合作用有重要影响。González-Manzano等[20]研究发现自聚合作用随着花青素B环上甲氧基数目增加而增强。Asen等[21]发现随着花青素浓度增加,花青素分子间以甲醇假碱或醌型碱的形式缔合,使其溶液吸光度剧增并出现蓝移。位佳静[22]研究发现,相比于水溶液,刺葡萄花青素在模拟葡萄酒醇系溶液中的自缔合强度更大。
2.1.2.2 花青素-共色素相互作用
在酚类和花青素的分子间共色作用中,花青素与酚类芳香环之间的π—π堆积是主要共色驱动力,电子从电子云密度较高的酚类转移到电子云密度较低的花青素[23]。电离电位是影响酚类共色效果的决定性因素,电离电位越负,给电子能力越强,稳定效果越好[24]。Dariasmartin等[25]将咖啡酸、(+)-儿茶素添加到葡萄酒中,结果发现30 d后20 mg/L咖啡酸(电离电位-8.31 eV)使葡萄酒颜色增强60%,而相同条件下(+)-儿茶素(电离电位-8.09 eV)仅增强13%。Cruz等[26]认为酚类提升稳定性的效果还与其立体结构有关,共平面的酚类(槲皮素、杨梅苷、芦丁)的共色效果优于不共平面的酚类(儿茶素、表儿茶素、表没食子儿茶素没食子酸酯)。Xu Honggao等[27]研究发现槲皮素对葡萄皮花青素稳定性的改善效果最好,在pH 3、90 ℃的条件下花青素的半衰期从495 min延长到1 386 min,其次是杨梅苷(693 min)、表没食子儿茶素没食子酸酯(577 min)和芦丁(503 min)。芦丁提升花色苷半衰期能力有限,可能的原因在于其较低的电离电位(-7.28 eV)。
有机酸作为共色素时,其酸度系数(pKa)是影响共色效果的重要因素。随着pKa值的增加,酸的解离速率降低,花青素与水分子溶剂化能力减弱,花青素水合作用减慢,因此,pKa值大的有机酸稳定作用更好。Hubbermann等[28]报道,在pH 3.9下,有机酸提高接骨木花青素稳定性的顺序为乙酸(pKa=4.76)>己二酸(pKa=4.43)>柠檬酸(pKa=3.09~5.41)≥酒石酸(pKa=2.98~4.34)。
氨基酸或多肽对花青素也具有共色效应,从而能够提升花青素的稳定性。研究发现,L-苯丙氨酸、L-酪氨酸、ε-聚-L-赖氨酸能将含抗坏血酸体系中花青素的半衰期延长1.15~1.39 d;而L-色氨酸通过氢键和疏水相互作用可使其延长3.91 d[29]。
2.2 通过复合作用改善花青素的稳定性
复合作用的定义非常广泛,一般指2 种及以上能独立存在的化合物通过共价或非共价作用形成有序分子聚集体的现象。花青素共色作用可以看作是花青素与自身及共色素分子间发生复合作用的特殊形式。共色素以外的食品成分(环糊精(cyclodextrin,CD)、多糖、蛋白质以及矿物质等)能与花青素形成复合物,从而提高花青素在食品加工贮藏过程中的稳定性。
2.2.1 CD包结作用
CD是一系列由α-D-葡萄糖单元以α-1,4-糖苷键首尾连接而成的环状低聚糖,常见的α-CD、β-CD和γ-CD分别由6、7、8 个α-D-葡萄糖单元组成。CD具有“外壁亲水、内腔疏水”的圆台形结构,其疏水内腔能与花青素分子作用,形成CD-花青素包结物。添加CD对花青素溶液将产生颜色增强、颜色减褪和无影响3 种效应,目前尚无规律可循。Yamada等[30]研究发现:添加β-CD会减褪天竺葵色素-3-葡萄糖苷和C3G溶液的颜色,且褪色程度随β-CD添加量的增加而加强;添加α-CD对C3G溶液颜色无影响,但对天竺葵色素-3-葡萄糖苷溶液颜色有较弱但显著的减褪作用;研究认为,β-CD对花青素颜色的减褪分为2 步,首先是二者形成包结物,然后是花青素黄烊盐正离子在β-CD的催化下转变为无色假碱。Tamura等[31]的研究发现γ-CD能与锦葵色素-3-(6”-对-香豆酰)-葡萄糖苷形成包结物且能稳定溶液颜色,而对另外3 种锦葵色素类花青素(锦葵色素-3-葡萄糖苷、锦葵色素-3,5-葡萄糖苷和锦葵色素-3,5-(6”-对-香豆酰)-葡萄糖苷)的溶液颜色缺乏稳定能力,可能的原因是锦葵色素-3-(6”-对-香豆酰)-葡萄糖苷分子的香豆酰基和A、C母环与γ-CD的疏水内腔恰好匹配。Mourtzinos等[32]采用差示扫描量热分析发现:β-CD与玫瑰茄花青素形成的复合物在固态时的抗氧化稳定性显著高于游离的玫瑰茄花青素;同时,添加β-CD可显著减缓玫瑰茄花青素在pH 4.0柠檬酸缓冲溶液中的热降解速率,在90 ℃热处理条件下,β-CD可使其半衰期延长近1 倍。Howard等[33]的研究认为:β-CD对野樱莓花青素贮藏稳定性的影响程度与β-CD添加量和溶液pH值有关;pH 3.6及3%(质量分数,下同)的β-CD添加量效果最好,降低pH值或减少添加量均会减弱β-CD对野樱莓花青素贮藏稳定性的提升效果。推测其可能的原因是β-CD与花青素的复合存在最优条件,此时二者间的氢键、疏水相互作用和位阻效应协同作用正好阻抑了水分子对花青素黄烊盐正离子的进攻。Fernandes等[34]的研究表明:β-CD对C3G溶液颜色具有减褪作用,且这种作用随pH值升高变得明显;而α-CD对C3G溶液颜色无显著影响,其可能的原因在于α-CD疏水腔较小,不利于花青素与内腔的包结作用。Fernandes等[35]进一步研究发现,C3G以半酮缩醇形式与β-CD按1∶1形成包结物,C3G的C环深埋于β-CD内腔,B环则位于β-CD腔体的边沿上。Flores等[36]的研究也表明添加β-CD导致C3G溶液的颜色减褪且与添加量呈正相关,但是包合物的形成提升了C3G的结构稳定性,而且β-CD可作为C3G向结肠运输的载体,增加其生物利用率。
2.2.2 多糖-花青素复合作用
与CD的情形类似,多糖对花青素稳定性的影响同样分为促进、基本无影响和降低3 种情况。至于其中的原因,目前尚未有清晰的认识。Lewis等[37]报道了直链淀粉和支链淀粉对花青素溶液颜色的减弱作用,这种作用在pH 4时比pH 2时更加明显。添加果胶对pH 2时花青素溶液颜色无影响,果胶对pH 4的飞燕草色素溶液颜色有减弱作用,而对pH 4的天竺葵色素和锦葵色素溶液的颜色有增强作用。相比之下,聚葡萄糖对上述2 个pH值的花青素溶液颜色无显著影响。
研究认为,多糖主要依靠氢键、疏水相互作用和静电相互作用与花青素形成复合物。Chung等[38]研究发现:添加阿拉伯胶可显著提升模拟饮料中紫胡萝卜花青素的稳定性;他们认为花青素通过与阿拉伯胶上的糖蛋白发生氢键作用形成复合物,从而抑制了抗坏血酸对花青素的降解。Guan Yongguang等[39]报道:添加阿拉伯胶(10 mg/mL)可使花青素(pH 5.0)在80 ℃和126 ℃的热稳定性分别提高2.0 倍和1.8 倍;他们认为二者主要通过疏水相互作用形成纳米尺度的复合物。对于阳离子型多糖(如壳聚糖),由于其荷电基团与花青素黄烊盐正离子之间的排斥作用,几乎不能与花青素形成非特异性吸附。利用这一性质,有学者采用壳聚糖来脱除胭脂萝卜(富含花青素)的异味[40]。与之相反,阴离子型多糖则能与花青素通过静电相互作用结合,如卡拉胶能与花青素形成稳定的复合物。Navikaite等[41]报道ι-卡拉胶对花青素的吸附作用比κ-卡拉胶高1.3~1.7 倍,原因在于ι-卡拉胶有2 个硫酸基团,而κ-卡拉胶只有一个。Klimaviciute等[42]将葡聚糖硫酸酯和花青素以质量比1∶1.7加入溶液中,室温下贮藏12 d,花青素损失率从35%降低到了12%。必须指出,静电相互作用不是唯一的阴离子型多糖与花青素之间的作用力[43]。对于硫酸软骨素这种兼具硫酸基团和N-乙酰基的阴离子型多糖,其与花青素的相互作用就包含静电相互作用和疏水相互作用,同时这2 种作用力能促进花青素的分子间堆积,围绕硫酸软骨素分子形成稳定的纳米尺度的复合物,甚至在高pH值(pH>9)环境下花青素可保持稳定。对于同是阴离子型多糖的果胶,其对花青素的改善程度与果胶来源、结构特征(甲酯化度、酰胺化度、链结构)以及非花青素类多酚共存物有关。对于果胶-花青素复合物而言,其形成主要依靠氢键作用和弱的疏水相互作用[44],当然还包括果胶羧基与花青素黄烊盐正离子之间的静电相互作用。与硫酸软骨素类似,花青素与果胶之间的疏水相互作用及静电相互作用促进了花青素的层状堆叠[45]。Buchweitz等[46]研究了不同类型果胶对黑加仑花青素贮藏(20 ℃避光18 周)稳定性的提升效果,结果表明:所有果胶样品均使其稳定性增加,其中低酯酰胺化果胶效果最好(质量分数1%、20 ℃,半衰期从22 d延长至80 d),低甲氧基果胶和高甲氧基果胶次之;当酰胺化度及酯化度近似时,柑橘果胶的效果优于苹果果胶,而甜菜果胶对其稳定性的提升能力有限,可能的原因在于花翠素葡萄糖苷与柑橘果胶发生了强烈的氢键相互作用;当与非花青素类多酚共存时,果胶的来源(而不是果胶结构特征)成为决定改善程度更为主要的因素。
2.2.3 蛋白质-花青素复合作用
蛋白质可与花青素形成复合物提升其热稳定性和贮藏稳定性。二者复合物的形成主要依靠氢键、静电相互作用和疏水相互作用。Tang Lin等[47]的研究表明,矢车菊色素-3-葡萄糖苷和牛血清白蛋白之间的复合作用,氢键是主要结合力。当溶液pH值大于蛋白质等电点,蛋白质带负电,这时多肽或蛋白质与花青素间还存在静电相互作用[29]。Wu Jine等[48]从酵母细胞壁中提取出甘露糖蛋白,研究发现甘露糖蛋白能将花青素的热稳定性(pH 7.0、80 ℃或126 ℃处理30 min)提高4~5 倍。光谱分析及ζ电位结果显示甘露糖蛋白与花青素通过疏水相互作用形成了复合物。对于牛奶蛋白质,其对花青素的稳定效果取决于蛋白质种类和热变性程度,乳清蛋白(β-乳球蛋白)稳定效果优于酪蛋白(α-酪蛋白、β-酪蛋白),热变性蛋白质优于天然未变性蛋白质[49]。Chung等[50]的研究结果表明热变性乳清蛋白的改善效果与其变性程度有关:适度热处理可增加乳清蛋白疏水基团的暴露程度,增强其与花青素之间的复合作用,有利于改善花青素稳定性;但是乳清蛋白一旦完全解折叠,热处理将不再提升其稳定效果。
2.3 通过载体包埋改善花青素的稳定性
包埋是一种将活性成分封装在固体颗粒或液体囊泡中以实现其稳定化和控制释放的技术。根据包埋体系的尺寸,可简单分为微胶囊(1.0~100.0 μm)和纳米颗粒(0.01~1.00 μm)2 类。采用载体材料对花青素进行包埋可有效降低花青素与外界环境的接触,提高花青素对热、光和pH值等环境因子的稳定性。
2.3.1 微胶囊化包埋
微胶囊技术是将固体、液体或气体包埋封存在聚合物壁的微型容器内成为固体微粒产品的一种技术。尽管微胶囊造粒方法多样,但目前仅有少数几种用于制备花青素微胶囊,主要包括离子交联法、乳化-热胶凝法、喷雾干燥法以及冷冻干燥法等。
离子交联法是指带相反电荷的壁材芯材相互交联或通过交联剂相连,形成致密的网络结构包裹花青素,以提高包埋率和保留率的方法。Wang Wenjie等[51]用2 种不同的阴离子交联剂(三聚磷酸钠、纤维素纳米晶)通过离子交联法与壳聚糖作用包裹花青素发现:以纤维素纳米晶为交联剂制备的微胶囊具有更高的花青素回收率,荷载的花青素中,27%分布于内核,12%与基质结合,61%分布于外层;而采用三聚磷酸钠为交联剂制备的微胶囊,不仅花青素的回收率下降了61%,而且99%的花青素分布在外层。钱明雪等[52]以果胶和海藻酸钠作壁材、CaCl2作为交联剂制备微胶囊包埋花青素,包埋率为87.5%。
乳化-热凝胶法是指将花青素与壁材组成的混合溶液在植物油中乳化成微粒,再通过壁材的热胶凝作用,形成在常温下呈固态的花青素微胶囊的方法。Bilek等[53]以乳清蛋白作为胶凝剂包埋黑胡萝卜花青素,通过热凝胶法得到直径小于100 μm的粉红色微胶囊,该微胶囊添加到酸奶中能赋予酸奶不同色度的粉红色。Betz等[54]研究了乳化-热胶凝法制备覆盆子提取物(富含花青素)微胶囊的工艺,首先使花青素与乳清分离蛋白充分作用形成复合物,然后以葵花籽油为分散相,加入乳化剂形成W/O型乳状液,接着以80 ℃热胶凝10 min制得微凝胶。乳清分离蛋白及微凝胶结构对pH 6.8条件下的花青素降解有明显的抑制作用。
喷雾干燥是最常用的制备花青素微胶囊的方法,所采用的壁材包括麦芽糊精、变性淀粉、海藻酸钠、CD、阿拉伯胶、葡聚糖、乳清蛋白等。这些壁材可与花青素相互作用形成复合物。通常将多种壁材联用以改善包埋和稳定效果[55]。Mahdavi等[56]的实验也证实阿拉伯树胶和麦芽糊精共同使用时的包埋效果优于单独使用麦芽糊精,将喷雾干燥的花青素粉末添加到果冻中,其质构及感官指标甚至优于市售果冻。
冷冻干燥被认为是干燥热不稳定物质的最适方法,可以降低高温对热敏物质的损害。Laokuldilok等[57]用麦芽糖糊精包埋花青素,并对2 种干燥方法进行了比较,发现冷冻干燥(保留率72%)的保留率远高于喷雾干燥(保留率48%~72%),且产率也更高。Lu Meiling等[58]以Fe3+为交联剂,通过乳化-交联法制备负电荷的氧化魔芋葡甘聚糖微球,冷冻干燥后的微球重新分散到溶液中吸附紫薯花青素。光学显微镜和激光共聚焦显微镜的观察结果表明,氧化魔芋葡甘聚糖微球对紫薯花青素具有良好的吸附能力。Wang Yuntao等[59]通过溶胶-凝胶法制得甲壳素多孔微球,将其反复洗涤后冻干,接着对葡萄籽花青素进行吸附,在pH 4的最佳条件下基于Langmuir等温线预测该微球对花青素的负载量达2 718 mg/g,静电相互作用、氢键和疏水相互作用为吸附过程的主要驱动力。
2.3.2 纳米化包埋
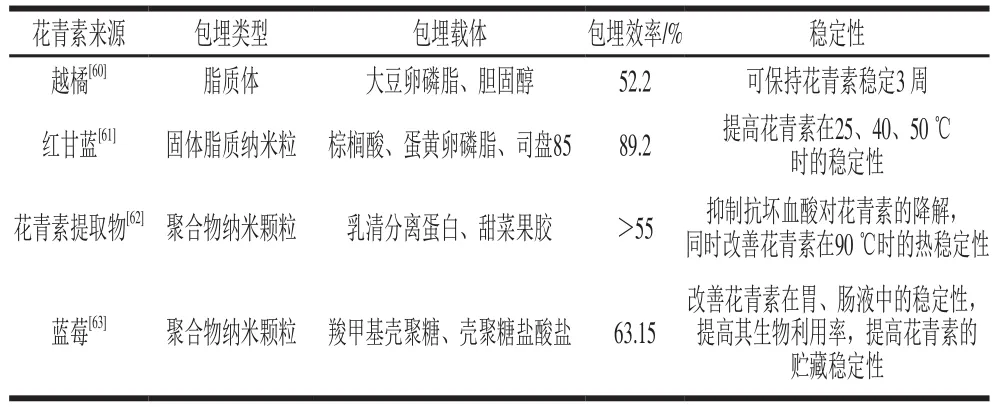
表1 花青素的纳米化包埋Table 1 Nanoencapsulation of anthocyanins
近年来,纳米化包埋在对食品活性成分的稳定化及生物利用率提升方面表现出了巨大的潜力。尽管纳米化载体体系及其构建方法多样,但是目前用于花青素纳米化包埋的体系主要有3 类,即脂质体、固体脂质纳米粒和聚合物纳米颗粒(表1)。Zhao Lisha等[60]采用大豆磷脂、胆固醇为包埋材料,通过二氧化碳超临界流体技术制备出平均粒径160 nm的越橘花青素脂质体,其多分散性指数仅为0.26,在氮气氛存放3 周脂质体结构稳定。Ravanfar等[61]以棕榈酸为固体脂质,以司盘85、卵磷脂为乳化剂,采用微乳液稀释法制备出红甘蓝花青素固体脂质纳米粒,并通过响应面法对制备工艺进行优化。固体脂质纳米粒呈球形,平均粒径455 nm,包埋后的红甘蓝花青素的热稳定性显著提升,且热处理温度越高效果越明显。Arroyo-Maya等[62]研究了热处理-离子交联法制备乳清分离蛋白-甜菜果胶纳米颗粒的工艺,并评价了所制备纳米颗粒包埋花青素的效果。研究发现,尽管乳清分离蛋白-甜菜果胶颗粒不能有效抑制添加抗坏血酸对花青素的降解作用,但包埋提升了花青素在无抗坏血酸的条件下的稳定性。He Bo等[63]研究了壳聚糖纳米颗粒对蓝莓花青素的包埋性能。结果表明,荷载蓝莓花青素的纳米颗粒平均粒径为219 nm,相比于游离花青素,包埋的花青素在模拟胃、肠液中降解缓慢,在模拟饮料中的贮藏稳定性也明显提升。
3 结 语
尽管花青素具有较差的稳定性,但是通过与食品成分间的共色作用、复合作用以及对花青素进行包埋处理,可显著提升花青素在加工贮藏过程中的稳定性,改善其贮藏性能,延长产品货架期。其中花青素-共色素共色作用、花青素-CD复合作用以及酰化提升稳定性的作用机制报道较多,而多糖及蛋白质通过复合作用及包埋作用提升花青素稳定性的机制有待进一步研究。另一方面,目前国内外研究侧重于花青素贮藏稳定性的改善,而较少涉及加工稳定性,后者包含更多稳定性破坏因子如酶、氧气、pH值和温度等,因此今后的研究宜着眼于花青素在各类加工条件下稳定性的改善。
[1] CAVALCANTI R N, SANTOS D T, MEIRELES M A A. Nonthermal stabilization mechanisms of anthocyanins in model and food systems: an overview[J]. Food Research International, 2011, 44(2):499-509. DOI:10.1016/j.foodres.2010.12.007.
[2] HURTADO N H, MORALES A L, GONZALEZ-MIRET M L,et al. Colour, pH stability and antioxidant activity of anthocyanin rutinosides isolated from tamarillo fruit (Solanum betaceum Cav.)[J]. Food Chemistry, 2009, 117(1): 88-93. DOI:10.1016/j.foodchem.2009.03.081.
[3] LIOBIKAS J, SKEMIENE K, TRUMBECKAITE S, et al. Anthocyanins in cardioprotection: a path through mitochondria[J]. Pharmacological Research, 2016, 113: 808-815. DOI:10.1016/j.phrs.2016.03.036.
[4] CORTEZ R, LUNA-VITAL D A, MARGULIS D, et al. Natural pigments: stabilization methods of anthocyanins for food applications[J]. Comprehensive Reviews in Food Science and Food Safety, 2017, 16(1): 180-198. DOI:10.1111/1541-4337.12244.
[5] WROLSTAD R E, DURST R W, LEE J. Tracking color and pigment changes in anthocyanin products[J]. Trends in Food Science and Technology, 2005, 16(9): 423-428. DOI:10.1016/j.tifs.2005.03.019.
[6] FISCHER U A, CARLE R, KAMMERER D R, et al. Thermal stability of anthocyanins and colourless phenolics in pomegranate (Punica granatum L.) juices and model solutions[J]. Food Chemistry, 2013,138(2/3): 1800-1809. DOI:10.1016/j.foodchem.2012.10.072.
[7] MAZZA G, BROUILLARD R. The mechanism of co-pigmentation of anthocyanins in aqueous solutions[J]. Phytochemistry, 1990, 29(4):1097-1102. DOI:10.1016/0031-9422(90)85411-8.
[8] TROUILLAS P, SANCHO-GARCÍA J C, DE FREITAS V, et al.Stabilizing and modulating color by copigmentation: insights from theory and experiment[J]. Chemical Reviews, 2016, 116(9): 4937-4982. DOI:10.1021/acs.chemrev.5b00507.
[9] GOTO T, KONDO T. Structure and molecular stacking of anthocyanins:flower color variation[J]. Angewandte Chemie International Edition in English, 1991, 30(1): 17-33. DOI:10.1002/anie.199100171.
[10] GIUSTI M M, WROLSTAD R E. Acylated anthocyanins from edible sources and their applications in food systems[J]. Biochemical Engineering Journal, 2003, 14(3): 217-225. DOI:10.1016/S1369-703X(02)00221-8.
[11] BORKOWSKI T, SZYMUSIAK H, GLISZCZYŃSKA-SWIGŁO A,et al. The effect of 3-O-β-glucosylation on structural transformations of anthocyanidins[J]. Food Research International, 2005, 38(8/9):1031-1037. DOI:10.1016/j.foodres.2005.02.020.
[12] FIGUEIREDO P, GEORGE F, TATSUZAWA F, et al. New features of intramolecular copigmentation by acylated anthocyanins[J].Phytochemistry, 1999, 51(1): 125-132. DOI:10.1016/S0031-9422(98)00685-2.
[13] EIRO M J, HEINONEN M. Anthocyanin color behavior and stability during storage: effect of intermolecular copigmentation[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7461-7466.DOI:10.1021/jf0258306.
[14] SUN J, CAO X, BAI W B, et al. Comparative analyses of copigmentation of cyanidin 3-glucoside and cyanidin 3-sophoroside from red raspberry fruits[J]. Food Chemistry, 2010, 120(4): 1131-1137. DOI:10.1016/j.foodchem.2009.11.031.
[15] PATRAS A, BRUNTON N P, O’DONNELL C, et al. Effect of thermal processing on anthocyanin stability in foods; mechanisms and kinetics of degradation[J]. Trends in Food Science &Technology,2010, 21(1): 3-11. DOI:10.1016/j.tifs.2009.07.004.
[16] RUBINSKIENE M, VISKELIS P, JASUTIENE I, et al. Impact of various factors on the composition and stability of black currant anthocyanins[J]. Food Research International, 2005, 38(8): 867-871.DOI:10.1016/j.foodres.2005.02.027.
[17] REQUE P M, STEFFENS R S, JABLONSKI A, et al. Cold storage of blueberry (Vaccinium spp.) fruits and juice: anthocyanin stability and antioxidant activity[J]. Journal of Food Composition and Analysis,2014, 33(1): 111-116. DOI:10.1016/j.jfca.2013.11.007.
[18] BĄKOWSKA-BARCZAK A. Acylated anthocyanins as stable, natural food colorants-a review[J]. Polish Journal of Food and Nutrition Sciences, 2005, 11(3): 201-247.
[19] ZHAO Changling, YU Yuqi, CHEN Zhongjian, et al. Stability-increasing effects of anthocyanin glycosyl acylation[J]. Food Chemistry, 2017, 214:119-128. DOI:10.1016/j.foodchem.2016.07.073.
[20] GONZÁLEZ-MANZANO S, SANTOS-BUELGA C, DUEÑAS M, et al. Colour implications of self-association processes of wine anthocyanins[J]. European Food Research and Technology, 2008,226(3): 483-490. DOI:10.1007/s00217-007-0560-9.
[21] ASEN S, STEWART R N, NORRIS K H. Copigmentation of anthocyanins in plant tissues and its effect on color[J]. Phytochemistry,1972, 11(3): 1139-1144. DOI:10.1016/S0031-9422(00)88467-8.
[22] 位佳静. 刺葡萄花色苷自聚合作用条件及效果研究[D]. 长沙: 湖南农业大学, 2013: 14-16.
[23] ARACELI C, MADELOURDES P H, MAELENA P, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4):859-871. DOI:10.1016/j.foodchem.2008.09.001.
[24] FERREIRA DA SILVA P, LIMA J C, FREITAS A A, et al. Chargetransfer complexation as a general phenomenon in the copigmentation of anthocyanins[J]. Journal of Physical Chemistry A, 2005, 109(32):7329-7338. DOI:10.1021/jp052106s.
[25] DARIASMARTIN J, CARRILLO M, DÍAZ E, et al. Enhancement of red wine colour by pre-fermentation addition of copigments[J].Food Chemistry, 2001, 73(2): 217-220. DOI:10.1016/S0308-8146(00)00286-7.
[26] CRUZ L, BRÁS N F, TEIXEIRA N, et al. Vinylcatechin dimers are much better copigments for anthocyanins than catechin dimer procyanidin B3[J]. Journal of Agricultural and Food Chemistry, 2010,58(5): 3159-3166. DOI:10.1021/jf9037419.
[27] XU Honggao, LIU Xuan, YAN Qiuli, et al. A novel copigment of quercetagetin for stabilization of grape skin anthocyanins[J]. Food Chemistry, 2015, 166: 50-55. DOI:10.1016/j.foodchem.2014.05.125.
[28] HUBBERMANN E M, HEINS A, STÖCKMANN H, et al. Influence of acids, salt, sugars and hydrocolloids on the colour stability of anthocyanin rich black currant and elderberry concentrates[J]. European Food Research and Technology, 2006, 223(1): 83-90. DOI:10.1007/s00217-005-0139-2.
[29] CHUNG C, ROJANASASITHARA T, MUTILANGI W, et al.Stability improvement of natural food colors: impact of amino acid and peptide addition on anthocyanin stability in model beverages[J]. Food Chemistry, 2017, 218: 277-284. DOI:10.1016/j.foodchem.2016.09.087.
[30] YAMADA T, KOMIYA T, AKAKI M, et al. Formation of an inclusion complex of anthocyanin with cyclodextrin[J]. Agricultural and Biological Chemistry, 1980, 44(6): 1411-1413. DOI:10.1271/bbb1961.44.1411.
[31] TAMURA H, TAKADA M, YAMAGAMI A, et al. The color stability and antioxidative activity of an anthocyanin and γ-cyclodextrin complex[J]. ACS Symposium Series, Functional Foods for Disease Prevention I, 1998, 701: 157-171. DOI:10.1021/bk-1998-0701.ch016.
[32] MOURTZINOS I, MAKRIS D P, YANNAKOPOULOU K, et al.Thermal stability of anthocyanin extract of Hibiscus sabdariあa L. in the presence of β-cyclodextrin[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 10303-10310. DOI:10.1021/jf801389j.
[33] HOWARD L R, BROWNMILLER C, PRIOR R L, et al. Improved stability of chokeberry juice anthocyanins by β-cyclodextrin addition and refrigeration[J]. Journal of Agricultural and Food Chemistry,2013, 61(3): 693-699. DOI:10.1021/jf3038314.
[34] FERNANDES A, SOUSA A, AZEVEDO J, et al. Effect of cyclodextrins on the thermodynamic and kinetic properties of cyanidin-3-O-glucoside[J]. Food Research International, 2013, 51(2):748-755. DOI:10.1016/j.carbpol.2013.11.037.
[35] FERNANDES A, LVANOVA G, BRÁS N F, et al. Structural characterization of inclusion complexes between cyanidin-3-O-glucoside and β-cyclodextrin[J]. Carbohydrate Polymers, 2014, 102:269-277. DOI:10.1016/j.carbpol.2013.11.037.
[36] FLORES G, CASTILLO M L R D, COSTABILE A, et al. In vitro fermentation of anthocyanins encapsulated with cyclodextrins: release,metabolism and influence on gut microbiota growth[J]. Journal of Functional Foods, 2015, 16: 50-57. DOI:10.1016/j.jff.2015.04.022.
[37] LEWIS C E, WALKER J R L, LANCASTER J E. Effect of polysaccharides on the colour of anthocyanins[J]. Food Chemistry,1995, 54(3): 315-319. DOI:10.1016/0308-8146(95)00026-F.
[38] CHUNG C, ROJANASASITHARA T, MUTILANGI W, et al.Enhancement of colour stability of anthocyanins in model beverages by gum arabic addition[J]. Food Chemistry, 2016, 201: 14-22.DOI:10.1016/j.foodchem.2016.01.051.
[39] GUAN Yongguang, ZHONG Qixin. The improved thermal stability of anthocyanins at pH 5.0 by gum arabic[J]. LWT-Food Science and Technology, 2015, 64(2): 706-712. DOI:10.1016/j.lwt.2015.06.018.
[40] GAO R, JING P, RUAN S, et al. Removal of off-flavours from radish(Raphanus sativus L.) anthocyanin-rich pigments using chitosan and its mechanism(s)[J]. Food Chemistry, 2014, 146: 423-428. DOI:10.1016/j.foodchem.2013.09.107.
[41] NAVIKAITE V, SIMANAVICIUTE D, KLIMAVICIUTE R, et al.Interaction between κ- and ι- carrageenan and anthocyanins from Vaccinium myrtillus[J]. Carbohydrate Polymers, 2016, 148: 36-44.DOI:10.1016/j.carbpol.2016.04.059.
[42] KLIMAVICIUTE R, NAVIKAITE V, JAKSTAS V, et al. Complexes of dextran sulfate and anthocyanins from Vaccinium myrtillus:formation and stability[J]. Carbohydrate Polymers, 2015, 129: 70-78.DOI:10.1016/j.carbpol.2015.04.038.
[43] JEONG D, NA K. Chondroitin sulfate based nanocomplex for enhancing the stability and activity of anthocyanin[J]. Carbohydrate Polymers, 2012, 90(1): 507-515. DOI:10.1016/j.carbpol.2012.05.072.
[44] MAZZARACCHIO P, PIFFERI P, KINDT M, et al. Interactions between anthocyanins and organic food molecules in model systems[J]. International Journal of Food Science & Technology,2004, 39(1): 53-59. DOI:10.1002/bio.2524.
[45] LIN Z, FISCHER J, WICKER L. Intermolecular binding of blueberry pectin-rich fractions and anthocyanin[J]. Food Chemistry, 2016, 194:986-993. DOI:10.1016/j.foodchem.2015.08.113.
[46] BUCHWEITZ M, SPETH M, KAMMERER D R, et al. Impact of pectin type on the storage stability of black currant (Ribes nigrum L.)anthocyanins in pectic model solutions[J]. Food Chemistry, 2013, 139:1168-1178. DOI:10.1111/j.1365-2621.2004.00747.x.
[47] TANG Lin, ZHANG Dong, XU Shanhua, et al. Different spectroscopic and molecular modeling studies on the interaction between cyanidin-3-O-glucoside and bovine serum albumin[J]. Luminescence,2014, 29(2): 168-175. DOI:10.1002/bio.2524.
[48] WU Jine, GUAN Yongguang, ZHONG Qixin. Yeast mannoproteins improve thermal stability of anthocyanins at pH 7.0[J]. Food Chemistry, 2015, 172(1): 121-128. DOI:10.1016/j.foodchem.2014.09.059.
[49] JING P, GIUSTI M M. Characterization of anthocyanin-rich waste from purple corncobs (Zea may L.) and its application to colour milk[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22):8775-8781. DOI:10.1021/jf051247.
[50] CHUNG C, ROJANASASITHARA T, MUTILANGI W, et al.Enhanced stability of anthocyanin-based color in model beverage systems through whey protein isolate complexation[J]. Food Research International, 2015, 76: 761-768.
[51] WANG Wenjie, JUNG J, ZHAO Yanyun. Chitosan-cellulose nanocrystal microencapsulation to improve encapsulation efficiency and stability of entrapped fruit anthocyanins[J]. Carbohydrate Polymers, 2017, 157: 1246-1253. DOI:10.1016/j.carbpol.2016.11.005.
[52] 钱明雪, 潘利华, 樊基胜, 等. 蓝莓花青素微胶囊的包埋工艺[J].食品研究与开发, 2013, 34(24): 166-169. DOI:10.3969/j.issn.1005-6521.2013.24.046.
[53] BILEK S E, YILMAZ F M, ÖZKAN G. The effects of industrial production on black carrot concentrate quality and encapsulation of anthocyanins in whey protein hydrogels[J]. Food and Bioproducts Processing, 2017, 102: 72-80. DOI:10.1016/j.fbp.2016.12.001.
[54] BETZ M, STEINER B, SCHANTZ M, et al. Antioxidant capacity of bilberry extract microencapsulated in whey protein hydrogels[J]. Food Research International, 2012, 47(1): 51-57. DOI:10.1016/j.foodres.2012.01.010.
[55] GHARSALLAOUI A, ROUDAUT G, CHAMBIN O, et al.Applications of spray-drying in microencapsulation of food ingredients: an overview[J]. Food Research International, 2007, 40(9):1107-1121. DOI:10.1016/j.foodres.2007.07.004.
[56] MAHDAVI S A, JAFARI S M, Assadpour E, et al. Storage stability of encapsulated barberry’s anthocyanin and its application in jelly formulation[J]. Journal of Food Engineering, 2016, 181: 59-66.DOI:10.1016/j.jfoodeng.2016.03.003.
[57] LAOKULDILOK T, KANHA N. Effects of processing conditions on powder properties of black glutinous rice (Oryza sativa L.)bran anthocyanins produced by spray drying and freeze drying[J].LWT-Food Science and Technology, 2015, 64(1): 405-411.DOI:10.1016/j.lwt.2015.05.015.
[58] LU Meiling, LI Zhengjun, LIANG Hao, et al. Controlled release of anthocyanins from oxidized konjac glucomannan microspheres stabilized by chitosan oligosaccharides[J]. Food Hydrocolloids, 2015,51: 476-485. DOI:10.1016/j.foodhyd.2015.05.036.
[59] WANG Yuntao, LI Jing, LI Bin. Chitin microspheres: a fascinating material with high loading capacity of anthocyanins for colon specific delivery[J]. Food Hydrocolloids, 2017, 63: 293-300. DOI:10.1016/j.foodhyd.2016.09.003.
[60] ZHAO Lisha, TEMELLI F. Preparation of anthocyanin-loaded liposomes using an improved supercritical carbon dioxide method[J].Innovative Food Science and Emerging Technologies, 2017, 39: 119-128. DOI:10.1016/j.ifset.2016.11.013.
[61] RAVANFAR R, TAMADDON A M, NIAKOUSARI M, et al.Preservation of anthocyanins in solid lipid nanoparticles: optimization of a microemulsion dilution method using the Placket-Burman and Box-Behnken designs[J]. Food Chemistry, 2016, 199: 573-580.DOI:10.1016/j.foodchem.2015.12.061.
[62] ARROYO-MAYA I J, MCCLEMENTS D J. Biopolymer nanoparticles as potential delivery systems for anthocyanins:fabrication and properties[J]. Food Research International, 2015, 69:1-8. DOI:10.1016/j.foodres.2014.12.005.
[63] HE Bo, GE Jiao, YUE Pengxiang, et al. Loading of anthocyanins on chitosan nanoparticles influences anthocyanin degradation in gastrointestinal fluids and stability in a beverage[J]. Food Chemistry,2017, 221: 1671-1677. DOI:10.1016/j.foodchem.2016.10.120.

