羊主效多胎基因的研究现状
李 闯, 柳海星, 高见红, 乔佳琦
(延边大学农学院,吉林 延吉 133002)
肉羊生产最重要的基础是繁殖和育种,羊的繁殖性能对养殖场能否盈利有重要的影响[1]。繁殖性能可以通过羊的生育率、多产性和繁殖力来判断。生育率是母羊每年妊娠的次数,多产性是每窝仔数,繁殖力是每年生产的羔羊数量。繁殖性状通常具有低至中等遗传力,基于表型数据的传统育种方法会非常耗时,因为它们需要通过几代的选择来进行遗传改良。因此,分子遗传学和分子标记辅助育种(MAS)对于繁殖效力的改良具有很重要的作用[2]。繁殖是一个复杂的过程,排卵数和每窝仔数等特征会受许多次要基因和一些主要基因的影响,这些基因被称为繁殖力(Fec)基因[3]。此外,有必要对骨形态发生蛋白(BMP)系统对卵泡生长发育以及排卵数的影响进行研究与了解。在种群中,主效基因对繁殖力的影响具有高变异性与高重复性。这些主效基因可以通过对高产羊的基因组扫描定位来进行检测。现阶段已检测出多个主要多产基因,如骨形态发生蛋白受体1B (BMPR1B),骨形态发生蛋白15(BMP15),生长分化因子9(GDF9)和β-1,4-N-乙酰-基半乳糖胺基转移酶2(B4GALNT2)分别位于羊的染色体6,X,5和11上[4]。以上基因对羊的繁殖性能有重要的影响。欧美的一些科学家已经在研究把以上基因导入到其他绵羊品种中以提高这些绵羊品种的繁殖力[5]。
1 国内外研究现状
1.1 生长分化因子9
生长分化因子9(GDF9)及FecG基因是另一个影响繁殖力的常染色体主基因,对卵泡的正常发育起至关重要的作用[6]。该基因能够编译tgf-β超家族的成员。而编译的前原蛋白得以被加工成卵巢卵泡发育所需的因子。该因子能够促进原始卵泡发育,并模拟颗粒细胞增殖的过程。GDF9羊基因主要位于5号染色体-41841034-41843517上并带有2个外显子。此外,该基因能够注释5个域和功能,并与24种突变的产生密切相关。研究人员还表明,一些突变的GDF9等位基因(表1)与动物排卵数的增加有关[7]。
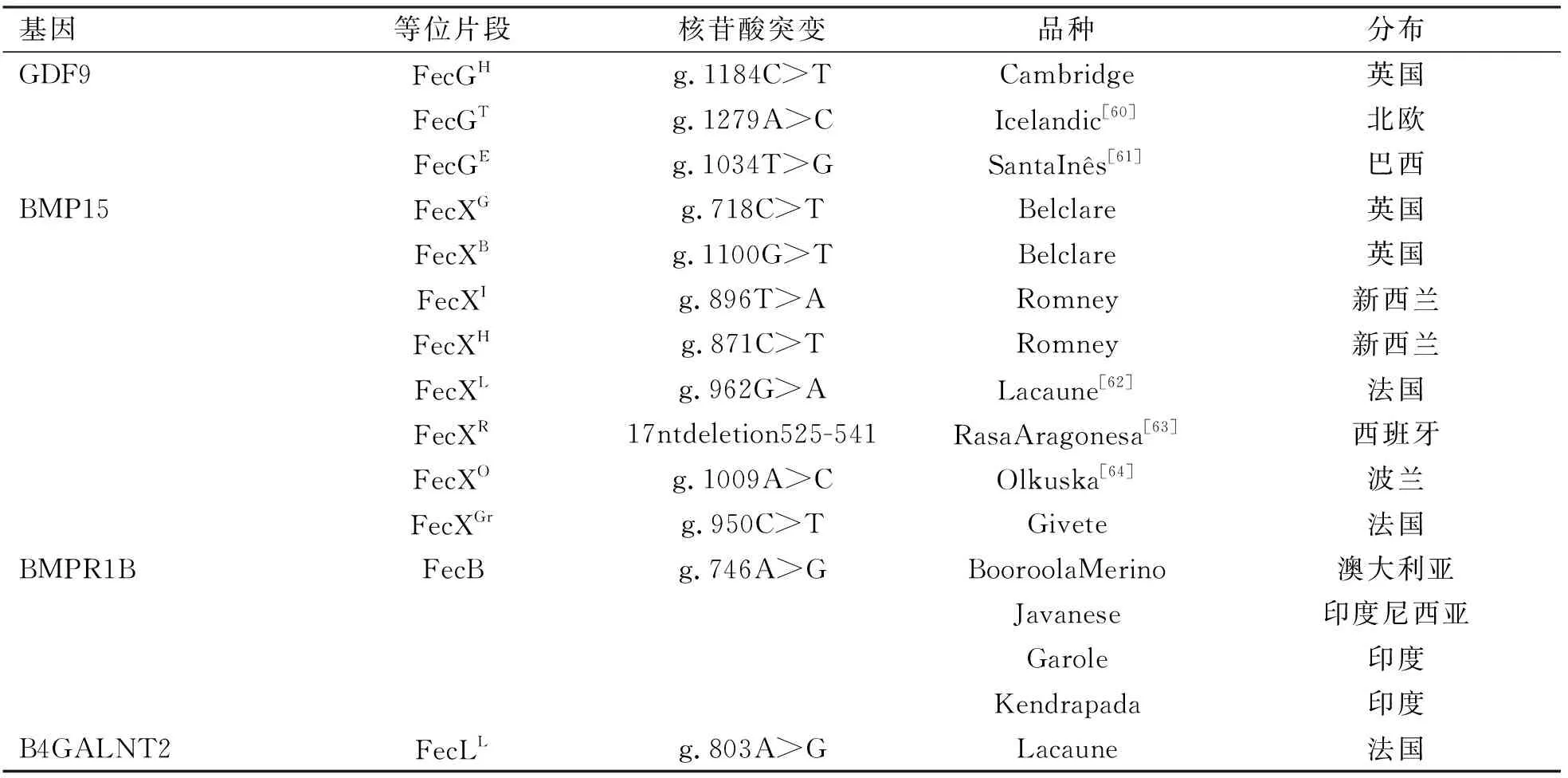
表1 多胎基因的突变和世界多产羊品种的分布
Hanrahan等人[8]指出,Cambridge和Belcare羊(G1-G8)的GDF9基因中存在8个突变。其中,仅有G8/FecGH会对繁殖力产生加性效应。另一方面,第1个突变(G1)与伊朗Moghani和Ghezel羊排卵数的增加相关联[9]。所有伊朗品种羊的相关研究均表明,基因的过渡路径为:G → GDF9的第1外显子中的A[10]。报道也表明,印度高产品种-Garole羊中也存在这种突变[11]。同样,研究也发现智利羊品种中也存在G1突变,但这种突变会对杂合动物的产仔数产生加性效应[12]。事实上,等位基因的表型表现在一定程度上取决于其他等位基因,因此可能会在A羊品种中观察到等位基因的表型表现,而在B品种中却观察不到。正因为如此,应将更多的精力投注到多胎羊品种的进一步研究上。Albarella等人[13](2015)在当地Laticauda羊品种和Bagnolese羊品种的GDF9基因中检测到5个新的SNPs(单核苷酸多态性)。与此同时,也发现这些突变(c.750G>A)与产仔数有较大的关联。但这些突变属于沉默突变,与Zamani、Nadri等人(2015)提出的突变类似。而这一关联性则可能与连锁不平衡密切相关。此外,除FecXG之外,研究还发现Lleyn品种是Belclare品种和Cambridge品种FecGH突变最可能的来源。因此,品种间遗传距离的相关研究能够进一步阐述突变是否是分开产生或突变间是否存在相互作用。
在国内,小尾寒羊也具有多态性状,初产母羊产羔率在200%以上,经产母羊在250%以上[14],许斌等人在2010年对小尾寒羊的BMP15基因和GDF9基因进行多态性研究的结果表明,GDF9基因可能是控制小尾寒羊多胎性能的一个主效基因或是与之存在紧密遗传连锁的分子标记[15]。王百川等人在2013年的研究表明,GDF9基因也可能是控制济宁青山羊多胎性能的一个主效基因或是与之存在紧密遗传连锁的分子标记[16]。杜智勇等人的研究可推测GDF9基因中的G1189A突变可能与贵州白山羊的高繁殖力有关[17]。白杰等人的研究结果表明,策勒黑羊,多浪羊上都没有GDF9基因突变,策勒黑羊和多浪羊的多胎机制与GDF9基因无关[18]。
1.2 骨形态发生蛋白15
骨形态发生蛋白15(BMP15)或FecX基因是另外一种能够影响繁殖力的重要基因,尤其在卵母细胞内表达时极其显著。该蛋白由BMP15基因编码,它是骨形态发生蛋白家族及转化生长因子β超家族的成员之一,β-TGF超家族主要包括大量生长及分化因子。BMP15基因能调节粒膜细胞增殖及分化,对卵泡早期生长具有重要作用,同时还与动物单排卵或多排卵有关[19]。BMP15基因位于羊染色体X:50970938-50977454,存在2个外显子,有7个结构域及特点,并且与10种突变有关。BMP15基因上有几种点突变(表1),可以发生在不同品种的羊体内[20]。
BMP15基因会发生8种不同的突变(已知的SNPs),会影响不同品种羊排卵数[21]。但是针对英国及爱尔兰羊的调查研究发现,Lleyn羊(来自Lleyn半岛的羊品种,位于Gwynedd西北地区)是Belclare和Cambridge 2种羊产生FecXG突变的源头。FecXG突变一般发生在肥沃地区,大多发生在19世纪60年代的爱尔兰羊身上,是Belclare羊的祖先[22]。事实上,BMP15基因是影响繁殖能力基因中的多型性位点。研究发现在2种伊朗羊体内(Mehraban和Lori羊),BMP15基因外显子2发生的新突变与繁殖率增加相关。但是,研究发现等位基因发生的是同义突变,氨基酸序列并没有变化[23]。多数突变都发生在外显子上,尤其是密码子的第3个位点,发生同义突变并不会影响氨基酸序列,因此也称为沉默突变。但是,这些突变却能影响转录、剪接和mRNA运输与翻译,它们都会影响基因表达,从而影响表型。其他重要突变还会影响连锁不平衡,例如FecXI,FecXH或其他非同义突变与同义突变都会显著影响羊表型。
BMP15基因不同的基因位点突变对羊繁殖力有不同的影响。储明星等人研究表明,BMP15的B2突变对小尾寒羊高繁殖力影响作用十分明显[24]。而杨晶等人(2006)的研究结果表明,BMP15基因的CTT缺失突变对小尾寒羊的高繁殖力没有显著影响[25]。BMP15的B1突变有可能是控制蒙古羊多胎性能的主效基因[26]。方鸿滨等人的研究说明了BMP15基因的FecXH突变不能作为乐至黑山羊多胎性状的候选基因,其原因有待进一步研究和探索[27]。同样的,BMP15基因的B4突变(G→T)和在滩羊上也不表现多态性,因此排除了BMP15基因的B4突变是影响滩羊繁殖性能的可能性[28]。
1.3 骨形态形成蛋白受体1B
骨形态形成蛋白受体1B属于跨膜丝氨酸/苏氨酸激酶家系的骨形态发生蛋白(BMP)受体家族成员。这些受体的配体是BMPs,它们都是转化生长因子-β(TGF-β)超家族的成员。BMPs参与软骨内形成与胚胎发育过程。骨形态形成蛋白受体1B基因(BMPR1B)突变称为FecB,经过每窝仔数的分离研究发现,它与排卵数增加有关。FecB等位基因是决定羊繁殖率的主要基因[29]。这种基因会影响布鲁拉美利奴羊的排卵数及每窝仔数,因此也称为布鲁拉(Booroola)基因[30]。BMPR1B基因位于染色体6:29361947-29448079上,也称为激活素受体样激酶(6ALK6),它有12个外显子和15个结构域及特征,同时与23种变异有关。
高精度标记测试能检验布鲁拉突变[31],研究发现,这种突变还可以发生在印度羊(Garole和Kendrapada)[32]、日本羊[33]以及印度尼西亚羊上(表1)。在印度、法国和以色列羊群体内进行杂交育种和渐渗杂交,成功发现布鲁拉突变。但是,在澳大利亚及美国羊品种中,却没有成功诱导布鲁拉突变[34]。在亚洲以外地区,由于缺乏布鲁拉基因,因此1次羊存活率、出生重量级生长速率都比较低[31]。在Kalehkoohi羊(一种伊朗品种)体内也发现了FecB(布鲁拉)突变,同时发现这种突变与每窝仔数有关,这一研究结果也证明,BMPR-IB能够显著影响窝仔数。一项涉及Garole×Malpura杂交羊的精子运动能力发现,携带FecB基因的Garole×Malpura公羊在半干旱热带气候条件下能够生成高质量精子[35]。
樊庆灿等人在2011年选取小尾寒羊做为研究对象,运用PCR-RFLP方法,分析 BMPR-ⅠB基因突变位点,得出结论:FecB基因可以作为小尾寒羊多胎性选育的分子遗传标记,FecB基因能够有效的提高小尾寒羊个体平均产羔数,对产羔数影响呈加性作用[36]。邵勇钢等人在2012年以BMPR-IB基因为策勒黑羊多羔性状的候选基因,采用PCR-RFLP方法对策勒黑羊BMPR-IB基因的多态性进行分析,BMPR-IB基因可以作为分子遗传标记之一用于对策勒黑羊产羔数的选择[37]。BMPR-ⅠB中的C40G突变也可能影响黔北麻羊的繁殖性状[38],FecB基因纯合也可作为湖羊多胎的分子标记[39]。
1.4 β-1、乙酰氨基-氨基半乳糖基转移酶2
研究发现,Lacaune羊中的β-1、乙酰氨基-氨基半乳糖基转移酶2(B4GALNT2)主要表现出高繁殖力性状[40]。事实上,对卵泡发育具有重要意义的B4GALNT2转移酶活性主要在卵巢颗粒细胞中产生,但其产生却与BMP家族无关。这一事实进一步证实了本段段首所提出的理论[41]。B4GALNT2位于11号染色体:36929322-36992982中并带有11个外显子。该基因注释5个域和功能,并与21种突变密切相关。
研究表明,常染色体FecLL突变(g.803A>G)对排卵数的影响主要是加性影响。同时,FecL轨迹也会对卵巢活动和内分泌系统产生一定的作用[3]。基于卵巢表型和内分泌系统,FecLL突变被认为会以不同于其他骨形态发生蛋白信号系统、BMP15、GDF9和BMPR1B中已知高繁殖力相关突变的方式影响卵巢功能。此外,研究发现FecL基因具有2个等位基因。与野生型等位基因相比,突变等位基因能够提高排卵数(提高至1.5个卵)。Martin等人[42](2014)还提出,如果在对繁殖性状进行遗传评估时忽略了主基因B4GALNT2/FecL,那么评估结果可能会高估多基因育种值。
国内对于羊B4GALNT2基因的研究报道较少,李晓霞等人在2015年采用混合DNA池法,对湖羊、小尾寒羊和杜泊羊B4GALNT2全基因进行扫描,未发现任何变异,说明该基因在动物进化中比较保守,与山羊多羔性状的相关性有待进一步研究[43]。
1.5 其他相关基因
除了前文所述的影响绵羊多产性的基因以外,还发现其他多态基因对繁殖性状具有实质性影响。例如,雌激素受体1(ESR1)基因,该基因是配体激活转录因子核受体超家族的成员[44]。ESR1基因位于绵羊染色体8:75431114-75705536,具有8个外显子。该基因编码的雌激素受体,对于激素的结合,DNA的结合以及转录的激活具有重要的作用。此外,雌激素及其受体不仅对于性发育和生殖功能至关重要,在其他组织如骨骼的生长、成熟以及成年骨转换的调节中也起着重要的作用。现阶段已经在不同的绵羊品种(土耳其羊[45],伊朗羊[23])中发现了几个ESR1基因的突变。
转移抑制基因(KISS1)被认为是动物青春期开始的关键调节剂和催化剂,对哺乳动物的性成熟起关键作用[46]。KiSS1基因的基因组区域位于染色体12:1310663-1316843,具有3个外显子。该基因编码kisspeptin多肽类家族,它们是GPR54的内源受体,并刺激促性腺激素释放激素(GnRH)诱导的促性腺激素分泌,并调节GnRH神经元的激活(Kotani等,2001; Ohtakietal 2001)。朱广琴等人2013年的研究表明,KISS1基因可以作为黄淮山羊多胎性状的有效分子标记[47]。安小鹏也在西农萨能奶山羊、关中奶山羊及布尔山羊中发现了KISS1基因突变,且该基因能够作为产羔数的候选基因用于山羊育种[48]。
G蛋白偶联受体54(GPR54)基因是视紫红质家族的成员[46]。在人类中,GPR54基因具有5个外显子,位于染色体19上。GPR54基因具有6个外显子,位于山羊7号染色体上。羊中GPR54基因的基因组区域是未知的。GPR54由该基因编码,是KISS1蛋白的受体。GPR54基因参与调节内分泌功能,是动物青春期启动的催化剂[49]。据报道,中国羊种中GPR54基因的几个突变对繁殖力有显着影响[46]。
垂体特异性转录因子(POU1F1)基因位于羊染色体1:153853076-153870283,具有6个外显子。该基因编码垂体特异性转录因子,这种蛋白质是生长激素、催乳素和促甲状腺激素的组织特异性转录因子,调节几个影响垂体发育和激素分泌的基因的表达[50]。POU1F1基因对生长激素细胞,促乳素细胞和促甲状腺细胞的存活、分化和增殖起关键作用。 葡萄牙羊中已经发现了POU1F1基因的几个突变点[51]。
催乳素受体(PRLR)基因编码垂体前叶激素、催乳素的受体,属于Ⅰ型细胞因子受体家族。在人类中,PRLR基因具有15个外显子,位于染色体5上,羊中有11个外显子,位于染色体20上,但羊PRLR基因的基因组区域是未知的。目前在小尾寒羊[52]和土耳其羊中[53]发现了PRLR基因的几个突变。
卵泡刺激素受体(FSHR)基因是由颗粒细胞表达的G蛋白偶联受体家族的成员[54],位于羊染色体3:75132595-75328743,具有10个外显子。该基因编码的卵泡刺激素受体属于G蛋白偶联受体的家族1,在性腺发育中起重要作用。 已在小尾寒羊中发现FSHR基因的几个突变[55]。
NR5A1基因位于绵羊染色体3:11224715-11245277,具有9个外显子。NR5A1,又名SF-1和Ad4BP[56],是核受体 NR5A 家族中第 1个被发现的成员,是一种重要的转录因子,与哺乳动物雌性生殖、卵泡发育、类固醇生成等有着密切的关系。李隐侠等人2017年发现,NR5A1基因对湖羊产羔数有一定的影响,g.6052A/G位点、g.3362G/C和g.6052A/G连锁可作为湖羊繁殖性能的有效遗传标记,用于湖羊的分子选育[57]。
2 讨论与展望
生殖能力在羊生产的利润方面具有重要作用。在不同基因中存在的突变对生殖性能性状具有主要影响。排卵率和每窝仔数以及它们所涉及基因的知识为这些性状的育种和选择提供了重要的信息。此外,影响排卵率的突变鉴定为卵巢功能的控制提供了新的思路。因此,有必要寻找新的突变,这对不同品种和种群的多产有积极的影响。 其他主要基因的鉴定可以确认BMP系统的特殊作用或可以指向独立于BMP信号的基因,主要影响卵巢或中枢神经系统水平。另一方面,类固醇激素及其受体是性发育和生殖功能所必需的,在几种生殖途径中具有重要作用,并可以直接增加卵泡的数量和大小[58]。在一些研究中,发现了一些没有任何主效基因的多态性基因,这些基因对每窝仔数具有累加效应。例如,Chu,Guo[59-62]等人在2012年研究了小尾寒羊中的KISS1或GPR54基因。影响羊生殖性能的许多其它主要基因尚未明确,必须加以鉴定。
所以,仍需要更多的研究来评价其他品种和种群中主要基因或其他相关基因片段的突变。 此外,如SNP芯片,全基因组测序和全转录组谱分析这些新技术,也是整个基因组和转录组以及识别选择和涉及这些性状的基因通路的标记所必需的。GWAS和基因组最佳线性无偏预测(GBLUP)的育种值也可能是遗传改良羊繁殖性能性状的有效工具。
参考文献:
[1] 李军民.提高肉羊繁殖能力的综合措施[J].河南科技学院学报(自然科学版),2005(02):38-39.
[2] Abdoli R,Zamani P,Deljou A,et al.Association of BMPR-1B and GDF9 genes polymorphisms and 3 secondary protein structure changes with reproduction traits in Mehraban ewes[J].Gene,2013,524:296-303.
[3] Drouilhet L,Lecerf F,Bodin L,et al.Fine mapping of the FecL locus in fluencing prolificacy in Lacaune sheep[J].Animal Genetics,2009,40,804-812.
[4] Souza C J L,MacDougall C,Campbell B K,et al.The Booroola(FecB)phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B (BMPR1B)gene[J].Journal of Endocrinology,2001,169:1-6.
[5] 刘胜军,鞠春伟.主效基因在畜牧生产上的应用[J].黑龙江八一农垦大学学报,2004(03):57-60.
[6] Vage D I,Husdal M,Mathew P K,et al.A missense mutation in growth differentation factor 9(GDF9)is strongly associated with liter size in sheep[J].BMC Genetics,2013,14:1.
[7] Hanrahan J P,Gregan S M,Mulsant P,et al.Mutations in the genes for oocyte derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovis aries)[J].Biology of Reproduction,2004,70:900-909.
[8] Barzegari A,Atashpaz S,Ghabili K,et al.Polymorphisms in GDF9 and BMP15 associated with fertility and ovulation rate in Moghani and Ghezel sheep in Iran[J].Reproduction in Domestic Animals,2010,45:666-669.
[9] Ghaderi A,Beigi-Nasiri M T,Mirzadeh K H,et al.Identfication of the GDF9 mutation in two sheep breeds by using polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP)technique[J].African Journal of Biotechnology,2010(9):8020-8022.
[10] Kasiriyan M M,Hafezian S H,Hassani N.Genetic polymorphism BMP15 and GDF9 genes in Sangsari sheep of Iran[J].International Journal of Genetics and Molecular Biology,2010(3):31-34
[11] Moradband F,Rahimi G,Gholizadeh M.Association of polymorphism in fecundity genes of GDF9,BMP15 and BMPR-1B with liter size in Iranian Baluchi sheep[J].Asian Australasian Journal of Animal Sciences,2011,9:1179-1183.
[12] Polley S,De S,Brahma B,et al.Polymorphism of BMPR1B,BMP15 and GDF9 fecundity genes in prolific Garole sheep[J].Tropical Animal Health and Production,2010,42:985-993.
[13] Paz E,Quińones J,Bravo S,et al.Genotyping of BMPR1B, BMP15 and GDF9 genes in Chilean sheep breeds and association with prolificacy[J].Animal Genetics,2015,46:98-99.
[14] 岳文斌,常红,贾兆玺,等.小尾寒羊的品种特性及利用途径[J].山西农业大学学报,2001(03):209-211.
[15] 许斌,顾亚玲,李继伟.宁夏滩羊·小尾寒羊及滩寒杂交群体BMP15基因和GDF9基因多态性研究[J].安徽农业科学,2010(19):10084-10087.
[16] 王百川,李桢,潘庆杰.济宁青山羊GDF9基因外显子2多态性检测[J].青岛农业大学学报(自然科学版),2013(04):247-251,257.
[17] 杜智勇,林尖兵,覃成,等.贵州白山羊GDF9基因外显子2的多态性研究[J].畜牧与兽医,2008(04):46-48.
[18] 白杰,史洪才,刘明军,等.BMP15和GDF9基因作为策勒黑羊和多浪羊的多胎主效候选基因的研究[J].草食家畜,2007(02):1-4.
[19] Moore R K,Shimasaki S.Molecular biology and physiological role of the oocyte factor,BMP15[J].Molecular and Cellular Endocrinology,2005,234:67-73.
[20] Galloway S M,McNaty K P,Cambridge L M,et al.Mutations in an oocyte derived growth factor gene(BMP15)cause increased ovulation rate and infertility in a dosage sensitive manner[J]. Nature Genetics,2000,25:279-283.
[21] 周泽晓.影响猪、羊繁殖性状主效基因的研究进展[J].农技服务,2012(05):627-628.
[22] Mullen M P,Hanrahan J P,Howard D J,et al.Investigation of prolific sheep from UK and Ireland for evidence on origin of the mutations in BMP15(FecXG,FecXB)and GDF9 (FecGH)in Belclare and Cambridge sheep[J].PLoS ONE,2013(8):e53172.
[23] Zamani P,Nadri S,Saffaripour R,et al.A new mutation in exon 2 of the bone morphogenetic protein 15 gene is associated with increase in prolificacy of Mehraban and Lori sheep[J].Tropical Animal Health and Production,2015,47:855-860.
[24] 储明星,桑林华,王金玉,等.小尾寒羊高繁殖力候选基因BMP15和GDF9的研究[J].遗传学报,2005(01):38-45.
[25] 杨晶,储明星,方丽,等.小尾寒羊BMP15基因多态性及其与高繁殖力关系的研究[J].农业生物技术学报,2006(06):870-874.
[26] 杨燕燕,邵凯,达来,等.BMP15基因作为影响蒙古羊双羔性状候选基因的研究[J].华北农学报,2010(01):44-49.
[27] 方鸿滨,王永,字向东,等.BMP15基因和BMPR-IB基因与乐至黑山羊繁殖性状之间关系的初步研究[J].西南民族大学学报(自然科学版),2010(02):206-209.
[28] 孙红霞,田秀娥,王永军.BMPR-IB、BMP15和GDF9基因作为滩羊繁殖性状主效候选基因的研究[J].西北农业学报,2009(05):17-21,70.
[29] Wilson T,Wu X Y,Juengel J L,et al.Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of Bone Morphogenetic Protein IB Receptor(Alk-6)that is expressed in both oocytes and granulosa cells[J].Biology of Reproduction,2001,64:1225-1235.
[30] Smith P,Hudson N L,Corrigan K A,et al.Effects of Booroola gene(FecB)on body mass, tests development and hormone concentrations during fetal life[J].Journal of Reproduction and Fertility,1996,108:253-261.
[31] Walkden-Brown S W,Van Der Werf J H J,et al.Use of the FecB(Booroola)gene in sheep breeding programs.Proceedings of the Helen Newton Turner Memorial International Workshop[C].India:Australian Centre for International Agricultural Research10-12 November,2008.
[32] Fogarty N M.A review of the effects of the Booroola gene(FecB)on sheep production[J].Small Ruminant Research,2009,85:75-84.
[33] Davis G H,Balakrishnan L,Ross I K,et al.Investigation of the Booroola (FecB)and Inverdale(FecXI)mutations in 21 prolific breeds and strains of sheep sampled in 13 countries[J].Animal Reproduction Science,2006,92:87-96.
[34] Mulsant P,Lecerf F,Fabre S,et al.Prolificacy genes in sheep:The French genetic programmes[J].Reproduction Supplement,2003,61:353-359.
[35] Kumar D,Joshi A,Naqvi S M K,et al.Sperm motion characteristics of Garole×Malpura sheep evolved in a semi-arid tropical environment through introgression of FecB gene[J].Animal Reproduction Science,2007,100:51-60.
[36] 樊庆灿,叶禄林,柳楠,等.小尾寒羊FecB基因型与产羔数相关的研究[J].安徽农业科学,2011(20):12216-12218.
[37] 邵勇钢,米日尼萨汗·库尔班,刘武军.策勒黑羊BMPR-IB基因多态性与产羔数的相关性研究[J].中国畜牧兽医,2012(06):221-223.
[38] 孙振梅,李鹏程,许厚强,等.黔北麻羊BMPR-ⅠB第9外显子C40G位点多态性及组织差异表达[J].农业生物技术学报,2016(12):1801-1809.
[39] 祝振硕.湖羊多胎性状候选基因BMPR-IB多态性研究及检测技术优化[D].咸阳:西北农林科技大学,2016.
[40] Bodin L,SanCristobal M,Lecerf F,et al.Segregation of a major gene in fluencing ovulation in progeny of Lacaune meat sheep[J].Genetics Selection Evolution.2002,34:447-464.
[41] Drouilhet L,Mansanet C,Sarry J,et al.The highly prolific phenotype of Lacaune sheep is associated with an ectopic expression of the B4GALNT2 gene within the ovary[J].PLoS Genetics,2013(9):e1003809.
[42] Martin P,Raoul J,Bodin,L.Effects of the FecL major gene in the Lacaune meat sheep population[J].Genetics Selection Evolution,2014,46:48
[43] 李晓雯.绵羊多胎性状候选基因群及其互作效应的研究[D].郑州:河南农业大学,2015.
[44] Metivier R,Petit F G,Valotaire Y,et al.Function of N-terminal transactivation domain of the estrogen receptor requires a potential a-helical structure and is negatively regulated by the domain[J].Journal of Molecular Endocrinology,2012,14:1849-1871.
[45] Ozmen O,Seker I,Cinar Kul B,et al.Haplotype variation of estrogen receptor α(erα)gene exon 4 in Turkish sheep breeds[J].Russian Journal of Genetics(Translation of Genetika(Moscow,Russian Federation)),2012,48:1015-1019.
[46] Chu M H,Xiao C,Feng T,et al.Polymorphisms of KISS-1 and GPR54 genes and their relationships with litter size in sheep[J].Molecular Biology Reports,2012,39:3291-3297.
[47] 安小鹏.山羊产羔性状候选基因的筛选及其多基因聚合效应的研究[D].咸阳:西北农林科技大学,2013.
[48] 朱广琴,王庆林,康永刚,等.GnRHR、GDF9、KISS1基因多态性与黄淮山羊产羔性状相关性的研究[J].黑龙江畜牧兽医,2013(11):58-61.
[49] 冯涛,储明星,张英杰.KISS-1/GPR54基因及其在生殖中的作用[J].遗传,2008(04):419-425.
[50] 胡志焕.牛、羊POU1F1基因的研究进展[J].中国牛业科学,2008(04):56-60.
[51] Bastos E,Avila S,Cravador A,et al.Identification and characterization of four splicing variants of ovine POU1F1 gene[J].Gene,2006,382:12-19.
[52] 陈勇.8个绵羊品种(品系)多羔性候选基因多态性的研究[D].乌鲁木齐:新疆农业大学,2009.
[53] Ozmen O,Seker I,Ertugrul O,et al.Prolactin receptor(PRLR)gene polymorphism in Chios,White Karaman and Awassi sheep breeds[J].Archiv für Tierzucht,2011,54:381-390.
[54] 梁天宇,李键,曹冶.金堂黑山羊FSHR启动子克隆及转录活性分析[J].安徽农业科学,2010(09):4610-4613.
[55] Chu M X,Guo X H,Feng C J,et al.Polymorphism of 5’regulatory region of ovine FSHR gene and its association with litter size in Small Tail Han sheep[J].Molecular Biology Reports,2012,39:3721-3725.
[56] 李隐侠,张俊,钱勇,等.湖羊NR5A1基因SNPs筛选及其与产羔数的关联分析[J].江苏农业学报,2017(01):124-132.
[57] Ikeda Y,Lala D,Luo X,et al.Characterization of the mouse FTZ-F1 gene,which encodes a key regulator of steroid hydroxylase gene expression[J].Molecular and Cellular Endocrinology.1993,7(7):852.
[58] 胡亮,字向东,卢建远,等.多胎和单胎山羊品种促性腺素基因及其受体基因的克隆、序列分析及组织表达研究[J].西南民族大学学报(自然科学版),2015,41(02):138-143.
[59] Chu M X,Guo X H,Feng C J,et al.Polymorphism of 5’ regulatory region of ovine FSHR gene and its association with litter size in Small Tail Han sheep[J].Molecular Biology Reports,2012,39:3721-3725.
[60] Nicol L,Bishop S C,Pong-Wong R,et al.Homozygosity for a single base-pair mutation in the oocyte specific GDF9 gene results in sterility in Thoka sheep[J].Reproduction,2009,138:921-933.
[61] Silva B D,Castro E A,Souza C J,et al.A new polymorphism in the Growth and Differentation Factor 9(GDF9)gene is associated with increased ovulation rate and prolificacy in homozygous sheep[J].Animal Genetics,2011,42:89-92.
[62] Bodin L,Di Pasquale E,Fabre S,et al.A novel mutation in the bone morphogenetic protein 15 gene causing defective protein secretion is associated with both increased ovulation rate and sterility in Lacaune sheep[J].Endocrinology,2007,148:393-400.

