铵态氮和硝态氮浓度对金线莲丛生芽中活性物质积累的影响
罗雯月, 杨 帆, 金美玉, 廉美兰, 朴炫春*
(1.延边大学农学院,吉林 延吉 133002;2.南京农业大学,江苏 南京 210095)
金线莲(Anoectochilusroxburghii),又名金线兰,为兰科开唇兰多年生草本植物[1-2]。金线莲含有许多化学成分,如生物碱、氨基酸、有机酸、甾醇、三萜类、黄酮类、苷类等,可治疗糖尿病、急慢性肝炎、消炎止痛,且无任何毒副作用,在民间拥有“药王”、“金草”的美称[3-4]。但是由于金线莲对生长条件的要求较为严格,种子不具胚乳,在自然条件下发芽率很低,而环境的破坏和人为肆意采挖,致使金线莲出现资源紧缺、供不应求的现象[5-6]。因此,利用植物细胞、组织和器官生产代谢产物对珍稀植物种质资源的保存及利用具有重要意义。
MS培养基是植物组织中最常用的一种基本培养基,适合于多种植物的离体培养。在MS培养基中含氮量多,总氮浓度为60 mmol/L,主要包括硝态氮和铵态氮,其中,铵态氮为20 mmol/L,而硝态氮为40 mmol/L。在植物细胞、组织和器官培养过程中,不同植物和不同代谢物的合成对MS培养基中硝态氮和铵态氮的浓度比的要求有所不同,Wu等[7]在培养紫锥菊不定根时发现,当硝态氮和铵态氮的浓度比为25/5 mmol/L 时,最有利于黄酮和总酚的积累。对于青钱柳的细胞悬浮培养,Yin等[8]发现,当培养基中硝态氮和铵态氮的浓度比为40/20 mmol/L时,最有利于青钱柳三萜化合物的积累。
黑色素广泛存在于动植物中,具有抵抗紫外线的辐射、决定人体皮肤颜色的作用。酪氨酸酶(EC1.14.18.1)是黑色素生成的主要限速酶,其活性越高,黑色素生成数量越多。蔡建秀等[9]研究发现,当桐花树根中性多糖、碱性多糖浓度小于0.4 mg/mL时,对酪氨酸酶活性具有明显的抑制作用。因此,抑制酪氨酸酶活性对调节人体色素积累、色斑沉着具有重要意义,将其应用于化妆品生产中,不仅无毒副作用,且可以达到美白的效果。
本研究通过调节硝态氮与铵态氮浓度比,探究其对悬浮培养金线莲丛生芽生物量及多糖和金线莲苷积累的影响,并初步探明了金线莲丛生芽提取物对酪氨酸酶活性的影响,为今后大量生产金线莲丛生芽,并将其应用于相关美白产品生产,为其提供原材料。
1 材料与方法
1.1 试验设计
将福建金线莲 [Anoectochilusroxburghii(Wall.)Lindl]接种到MS+6-苄氨基嘌呤(BA)3.0 mg/L+激动素(KT)0.3 mg/L+萘乙酸(NAA)0.3 mg/L+蔗糖30 g/L+琼脂7 g/L(pH值5.8)的培养基上诱导丛生芽,培养30 d后,将获得的丛生芽切成0.5 cm左右作为试验材料。
将MS培养基中总氮浓度设定为45 mmol/L,用KNO3和(NH4)2SO4分别调节NO3-和NH4+浓度比为45/0、37.5/7.5、30/15、22.5/22.5、15/30、7.5/37.5和0/45,并加入0.2 mg/L KT ,2.5 mg/L BA,0.5 mg/L NAA和35 g/L蔗糖,pH值为5.8。在250 mL三角瓶中加入100 mL培养基,每个瓶中接入3 g(鲜物重)丛生芽外植体后放置于振幅为121 r/min的振荡器上,在温度为(25±2) ℃,湿度70 %,光照强度1 600 lx,每天光照16 h条件下进行悬浮培养。30 d后调查丛生芽鲜物重和干物重,测定金线莲丛生芽中多糖和金线莲苷含量,并计算多糖和金线莲苷的生产量。
多糖和金线莲苷生产量/(g/L)=[丛生芽干重/(mg/L)×多糖和金线莲苷含量/(g/g DW)]/1 000
将悬浮培养的金线莲丛生芽和1年生金线莲植株分别称取定量干粉10 g于三角瓶中,加入2倍80%的甲醇、80%乙醇,37 ℃超声提取1 h后过滤,滤渣重复上述步骤2次后,滤液合并,37 ℃减压干燥,得到甲醇提取物、乙醇提取物,测定提取物对酪氨酸酶活性的抑制率。
酪氨酸酶抑制率/%=1-酪氨酸酶活性%。
1.2 方法
1.2.1 鲜物重和干物重的测定
将悬浮培养的金线莲从培养基中取出,用自来水冲洗干净,除去表面水分后称取鲜物重,放入45 ℃恒温干燥箱(YHW1103,天津市华北实验仪器有限公司,中国)中烘干48 h后,精密称取干物重。
1.2.2 多糖含量测定
参照Dubois等[10]方法提取和测定多糖的含量。称取丛生芽干燥粉末100 mg,在90%乙醇中浸泡2次,每次6 h,上层液弃掉后,在通风橱内滤渣挥干,之后加入20 mL的蒸馏水,在45 ℃条件下超声提取30 min,过滤;超声提取重复3次后合并滤液,定容至100 mL,在490 nm处测定吸光值。
1.2.3 金线莲苷含量的测定
参照张锦文等[11]方法测定金线莲苷的含量。称取0.2 g金线莲丛生芽粉末,加入甲醇15 mL制备提取液,利用超声波(TH-100QX,济宁天华超声电子仪器有限公司,中国)提取60 min,室温放置过夜后,过滤,旋转蒸干。用5 mL去离子水溶解,用氯仿萃取脱脂,加入去离子水并定容至25 mL,用0.22 μm过滤器过滤,利用高效液相色谱(HPLC)(LC-15C,日本岛津公司,日本)进行检测,HPLC使用C18色谱柱(4.6 mm×250 mm,5 μm,Thermo Scientific,美国),波长设置为215 nm,流动相为水和甲醇,比例为90∶10,流速1.0 mL/min,进样量10 μL,温度30 ℃,金线莲苷保留时间4 min(图1)。
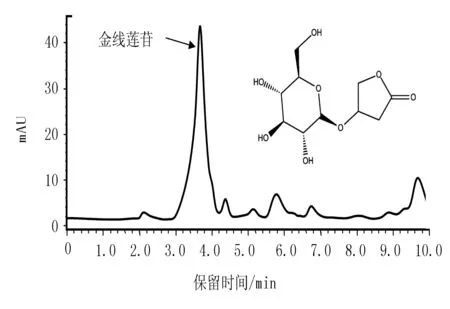
图1 金线莲不定芽样品的HPLC色谱图
1.2.4 酪氨酸酶活性的测定
参照李红艳等[12]方法检测丛生芽甲醇、乙醇提取物对酪氨酸酶酶活反应的影响。96孔板中每孔依次加入50 μL酪氨酸酶(50 U/mL),50 μL根状茎提取物和100 μL 0.1 M磷酸缓冲液(pH值6.8)放置10 min后,加入100 μL L-DOPA(1 mmol/L)反应5 min,在酶标仪(475 nm)下测OD值。
1.2.5 数据整理及软件分析
试验中每个处理接种3瓶作为重复,利用SPSS 11.5(Statistical Product and Service Solutions 11.5)程序对试验数据进行方差分析,采用邓肯氏新复极差法进行比较,显著水平为0.05。
2 结果与分析
2.1 MS培养基中NO3-和NH4+浓度比对金线莲丛生芽鲜物重和干物重的影响
将MS培养基中总氮浓度设为45 mmol/L,调节NO3-和NH4+浓度,探究不同NO3-和NH4+对金线莲从生芽生物量的影响。由表1可知,在硝态氮和铵态氮浓度比为30/15 mmol/L时,金线莲丛生芽的鲜物重和干物重达到最高,分别为17.52和1.91 g,而当培养基中不含硝态氮时,金线莲丛生芽生物量最低,分别为4.22和0.29 g。
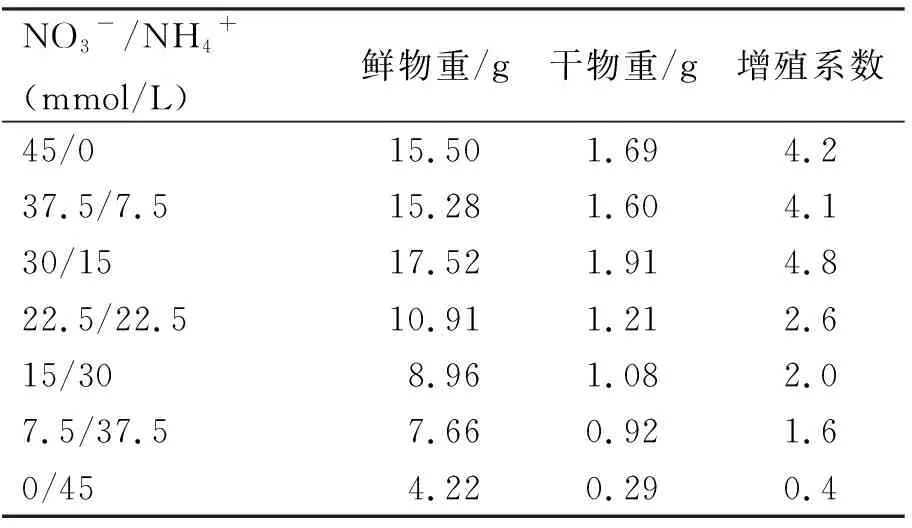
表1 不同NO3-和NH4+浓度比的MS培养基中金线莲丛生芽的生物量Table 1 The biomass of the Anoectochilus roxburghiiadventitious buds in the MS medium with differentNO3- and NH4+ concentration ratios
在硝态氮和铵态氮浓度比为30/15 mmol/L时,金线莲丛生芽生长旺盛,颜色为翠绿色,而单独使用铵态氮时,明显看出丛生芽生长受到严重抑制,丛生芽变软,颜色为褐色(图2)。

图2 金线莲丛生芽在不同NO3-和NH4+浓度比的MS培养基中的生长情况
2.2 MS培养基中NO3-和NH4+浓度比对金线莲丛生芽多糖积累的影响
随着MS培养基中硝态氮和铵态氮浓度比的减少,金线莲丛生芽中多糖的积累呈先上升后下降的趋势(图3),即多糖的积累随着硝态氮浓度减少和铵态氮浓度增加而增加。在硝态氮和铵态氮浓度比为30/15 mmol/L时,多糖的含量和生产量均达到最高,分别为388.42 mg/g和7.42 g/L。因此,培养基中NO3-和NH4+浓度为30和15 mmol/L时,最适宜金线莲丛生多糖的积累。
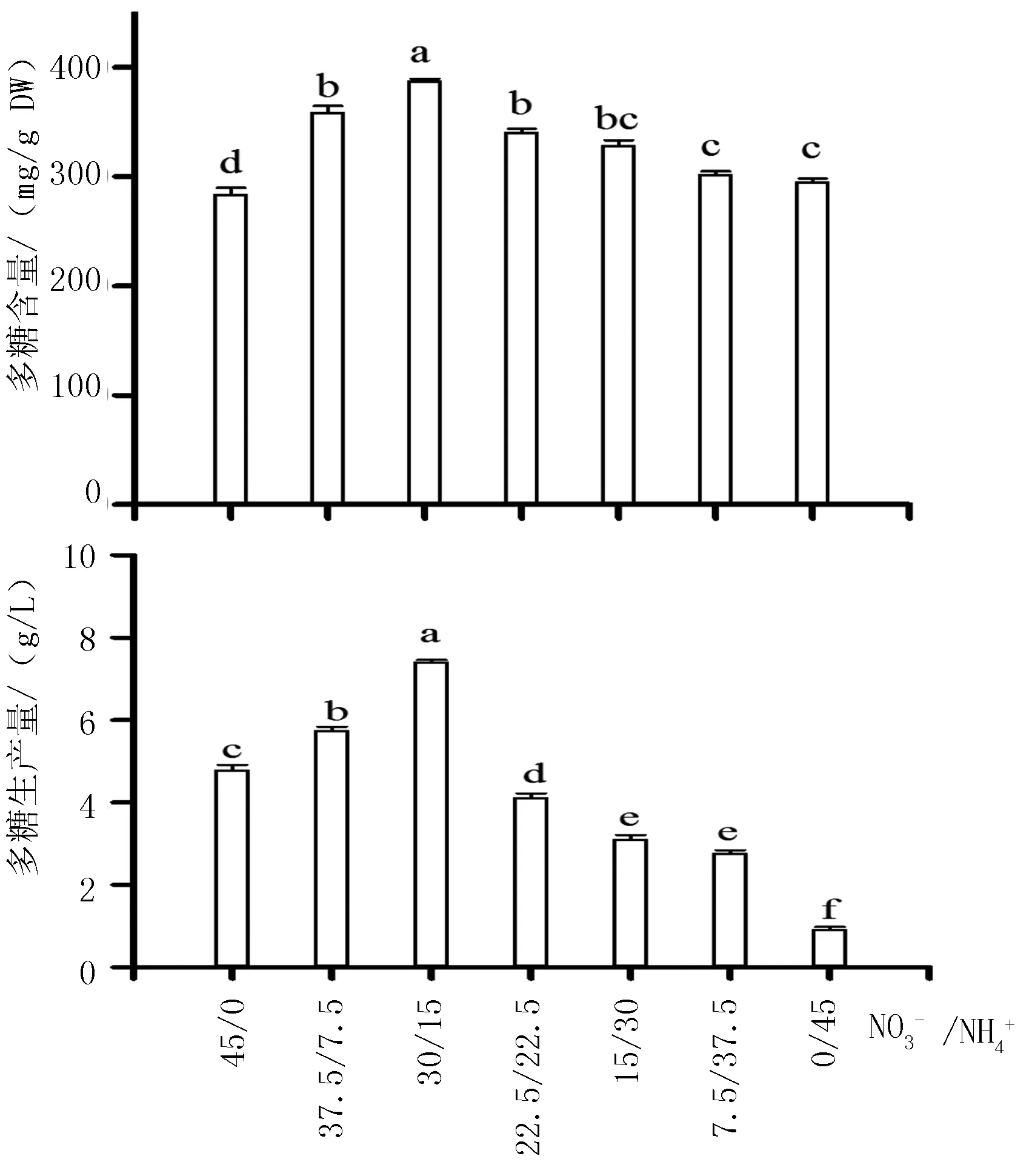
注:不同字母表示在0.05水平上差异显著,下同。
图3MS培养基中NO3-和NH4+浓度比对悬浮培养金线莲丛生芽中多糖积累的影响
Fig.3EffectofratioofNO3-andNH4+concentrationinMSculturemediumonpolysaccharideaccumulationofsuspensionculturedadventitiousbudsinA.roxburghii
2.3 MS培养基中NO3-和NH4+浓度比对金线莲丛生芽金线莲苷积累的影响
金线莲丛生芽中金线莲苷积累的变化趋势与多糖积累的变化趋势相同,均随硝态氮和铵态氮浓度比的减少呈先上升后下降的趋势,并且在硝态氮和铵态氮浓度比为30/15 mmol/L时,金线莲苷含量(190.22 mg/g)和生产量(1.33 g/L)达到最大(图4)。
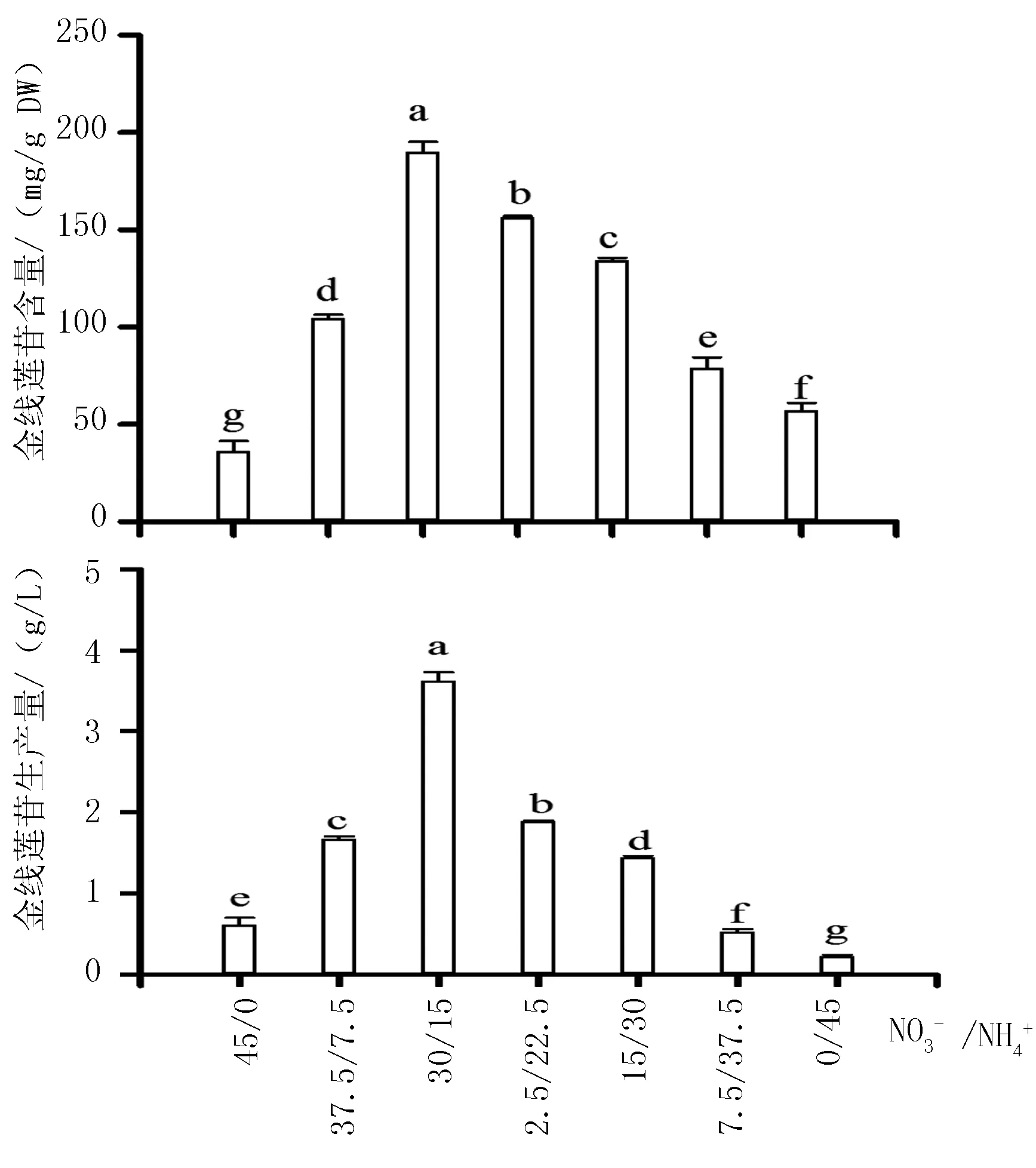
图4 MS培养基中NO3-和NH4+浓度比对悬浮培养金线莲丛生芽中金线莲苷积累的影响
2.4 金线莲丛生芽提取物对酪氨酸酶活性的影响
金线莲丛生芽提取物对酪氨酸酶活性的抑制率比室外栽培的金线莲植株高(表2),并且乙醇提取物对酪氨酸酶活性的抑制率更高,达到59%,而甲醇则为54%。因此,选择金线莲丛生芽乙醇提取物更有利于抑制酪氨酸酶活性,防止黑色素积累过多。
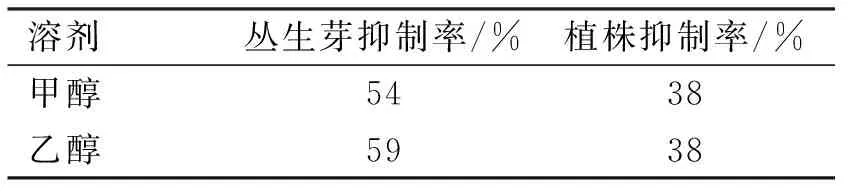
表2 金线莲提取物对酪氨酸酶活性的抑制率Table 2 Inhibition rate of tyrosinase activity byextracts from the extract of A. roxburghii
3 讨论
氮素既是植物最重要的结构物质,又是植物生理代谢中最活跃部分—酶的主要成分,所以氮素对植物生理代谢和生长发育有重要作用[13-14]。植物生长的主要氮源是硝态氮和铵态氮,不同氮源也会影响植物碳水化合物的代谢,以硝态氮为氮源时,利于植物蔗糖积累, 反之利于植物积累淀粉[15-16]。而硝态氮和铵态氮的浓度比同样影响植物次生代谢物的产生。Yang等[17]对铁皮石斛进行组织培养时发现,将铁皮石斛接种到1/2MS培养基中,培养基总氮浓度为30 m mol/L ,硝态氮浓度为30 m mol/L,铁皮石斛的生物量、黄酮产量、生物碱生产量均达到最高。Cui等[18]研究表明,硝态氮和铵态氮的浓度比为25/5 m mol/L 时,贯叶连翘的黄酮和总酚含量较高。范秀艳等[19]发现,葡萄试管苗培养基中,硝酸还原酶活性(NR)随着培养基中硝态氮和铵态氮比例的增加而升高。植物多糖作为一类重要的天然活性物质,其最大优点是毒副作用小,来源广泛,可治疗糖尿病、心血管疾病等,多糖和金线莲苷为金线莲的主要活性成分[20-21]。本研究中发现,当培养基中硝态氮和铵态氮浓度比为30/15 m mol/L时,最利于金线莲多糖和金线莲苷的积累。因此,合理调节硝态氮和铵态氮的浓度比可以促进金线莲丛生芽中代谢物的积累。
皮肤的美白机制即是黑色素的抑制机制,当前大多数美白化妆品是以酪氨酸酶为作用靶点,通过抑制酪氨酸酶的活性或者阻断酪氨酸生成黑色素的氧化途径,以减少黑色素的生成,从而达到美白皮肤的效果。陈美君等[22]对白芨不同提取物的抗氧化活性和对酪氨酸酶的抑制作用进行考察,发现白芨具有一定的美白功效。近10年来,随着人们生活水平和审美标准的提高,越来越多的人追求皮肤白皙与润泽,因此,本研究对于开发具有防止色斑、色素沉着的美白化妆品及皮肤美白制剂的产品具有重要作用,本试验通过丛生芽培养生产金线莲多糖和金线莲苷的方法对于金线莲产品的工业化生产具有参考的价值。
4 结论
本试验结果表明,适宜的硝态氮和铵态氮浓度配比对金线莲外植体丛生芽的生物量和有效物质的积累有促进作用,在硝态氮和铵态氮浓度为30和15 mmol/L时,可生产7.42 g/L多糖和1.33 g/L金线莲苷,并且用金线莲丛生芽的乙醇提取物时,酪氨酸酶抑制率为59%。
参考文献:
[1] 全国中草药汇编编写组.全国中草药汇编下册[M].北京:人民卫生出版社,1996.
[2] 陈裕,林坤瑞,官其宽,等.金线莲的开花特性[J].亚热带植物通讯,1996,25(1):35-37.
[3] 刘知远,沈廷明,吴仲玉.RP-HPLC法同时测定福建产金线莲中槲皮素、山柰素、异鼠李素的量[J].中草药,2015,46(3):432-434.
[4] Zhang Y H,Cai J Y,Ruan H L,et al.Antihyperglycemic activity of kinsenoside,a high yielding constituent fromAnoectochilusroxburghiiin streptozotocin diabetic rats[J].J Ethnopharmacol,2007,114(2):141.
[5] 孔祥海.“药王”金线莲的自然资源初步研究[J].中草药,2001,32(2):155-157.
[6] 张军成,张超,陈强,等.金线莲产业化现状及发展对策[J].福建林业科技,2014,41(4):220-224.
[7] Wu C H,Dewir Y H,Hahn E J,et al.Optimization of culturing conditions for the production of biomass and phenolics from adventitious roots ofEchinaceaangustifolia[J]. J Plant Biol,2006,49:193-199.
[8] Yin S S,Liang Y Y,Gao W Y,et al.Influence of medium salt strength and nitrogen source on biomass and metabolite accumulation in adventitious root cultures ofPseudostellariaheterophylla[J].Acta Physiol Plant,2013,35:2623-2628.
[][]
[9] 蔡建秀,董文云,黄晓冬,等.桐花树根多糖的提取、理化性质及其抗酪氨酸酶活性研究[J].中国农学通报,2015(31):12-18.
[10] Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method of determination of sugars and related substances[J].Anal Chem,1956,28:350-356.
[11] 张锦文,唐菲,张小琼,等.高效液相色谱法测定金线莲中金线莲苷的含量[J].中国医院药学杂志,2011,31(4):261-263.
[12] 李红艳,刘艳杰,王倩,等.红花中酪氨酸酶抑制成分的快速筛选和分析[J].现代药物与临床,2013,28(2):170-174.
[13] 荣秀连,王梅农,宋采博,等.不同铵态氮/硝态氮配比对白菜叶绿素含量的影响[J].江苏农业科学,2010(01):298-300.
[14] 贺楠楠,焦瑞峰,张力浩,等.不同空心菜对氮素吸附特征的初步研究[J].河南科技学院学报,2014,42(6):12-15.
[15] 刘艳菊,朱永官,丁辉,等.不同氮肥水平下SPAD读数与菠菜硝态氮含量关系的初步研究[J].农业环境科学学报,2004,23(3):484-487.
[16] 李生秀,付会芳,袁虎林,等.几种反映旱地土壤供氮能力方法的比较[J].土壤,1990,22(4):194-197.
[17] Yang Fan,Wei Nan-Nan,Gao Ri.Effect of several medium factors on polysaccharide and alkaloid accumulation in protocorm-like bodies ofDendrobiumcandidumduring bioreactor culture[J].Acta Physiol Plant,2015,37:94.
[18] Cui X H,Chakrabarty D,Lee E J,et al.Production of adventitious roots and secondary metabolites byHypericumperforatumL.in a bioreactor[J].Bioresour Technol,2010,101:4708-4716.
[19] 范秀艳,韩彦辉,杜晓燕.氮素形态、配比对葡萄试管苗氮素代谢的影响[J].内蒙古民族大学学报,2011,26(1):33-35
[20] 金迪,梁英,孙工兵,等.植物多糖提取技术的研究进展[J].黑龙江八一农垦大学学报,2011,23(5):76-79.
[21] 王凤杰,刘锦红,王丽芳,等.黄芪多糖对实验性糖尿病大鼠心肌损伤的保护作用[J].湖北民族学院学报,2012,29(4):16-19.
[22] 陈美君,刘珈羽,李峰庆,等.中药白及抑制酪氨酸酶及清除DPPH自由基的有效部位筛选及其制备工艺考察[J].成都中医药大学学报,2017,40(2):15-19.

