A—PRF与I—PRF在前牙位点保存中应用效果的初步研究
谢慧 朱万权 解永富 吴海燕 刘勤
[摘要]目的:研究A-PRF与I-PRF在前牙位点保存中的应用效果。方法:选取笔者医院2015年1月-2016年1月单颗前牙需要拔除的患者63例,随机分为三组,进行微创拔牙,常规清理拔牙窝。Ⅰ组:拔牙窝内填博纳人工骨粉与A-PRF + I-PRF混合物,表面覆盖A-PRF膜;Ⅱ组:拔牙窝内仅填塞博纳人工骨粉;Ⅲ组:拔牙窝内填塞明胶海绵。分别于术前、术后3个月进行CBCT检查,比较三组牙槽骨高度、宽度的变化。采用视觉模拟量表(VAS)评价患者術后24h、术后3d的疼痛情况。结果:拔牙术后24h,术后3dⅠ组疼痛轻于Ⅱ组、Ⅲ组(P<0.05);拔牙3个月后,Ⅰ组的牙槽骨高度及宽度恢复情况显著优于Ⅱ组和Ⅲ组(P<0.05)。结论:A-PRF与I-PRF在前牙位点保存中可以减轻术后反应,促进骨组织再生,保存剩余牙槽骨,为后期进行修复提供有利条件。
[关键词] A-PRF;I-PRF;博纳骨;骨再生;位点保存
[中图分类号]R782.12 [文献标志码]A [文章编号]1008-6455(2018)04-0088-03
A Pilot Study on the Application Effect of A-PRF and I-PRF in Anterior Teeth Extraction on Site Preservation
XIE Hui1, ZHU Wan-quan2, XIE Yong-fu1, WU Hai-yan1,LIU Qin1
(1.Department of Implantology; 2. Department of Periodontology, Changzhou Stomatological Hospital, Changzhou 213003,Jiangsu, China)
Abstract: Objective To investigate the effect of advanced-platelet rich fibrin (A-PRF) and injected-platelet rich fibrin (I-PRF) on site preservation of anterior teeth. Methods A total of 63 cases with single anterior teeth needed extraction from January 2015 to January 2016 in our hospital were randomly divided into 3 groups. Minimally invasive extraction was administered; the sockets were then curetted, cleaned. Group I: The sockets were filled with Bona Graft and A-PRF+I-PRF mixture, covering with A-PRF membrane on the surface; Group II: The sockets were filled with Bona Graft only; Group Ⅲ: The sockets were filled with gelatin sponge. CBCT were operated pre and 3 months after the surgery to measure the weight and height of the bone.The pain was measured by VAS 24 hours and 3 days postoperatively. Results The pain in group I was less than that in the other 2 groups 24 hours and 3 days postoperatively. The bone height and width 3 months after surgery in group I was significantly higher than that in the other 2 groups (P<0.05). Conclusion A-PRF and I-PRF can reduce the postoperative reaction, protecting the residual alveolar bone and making a better condition for the further restoration.
Key words: A-PRF; I-PRF; Bona Graft; bone regeneration; Site Preservation
牙齿缺失后骨组织的吸收、改建常导致牙槽嵴的萎缩[1]。有研究显示,拔牙后6个月水平骨丧失29%~63%,垂直骨丧失11%~22%,对于前牙骨组织的这种三维方向的吸收直接导致骨组织唇颊侧及垂直向的轴线偏移,从而影响将来种植体正确位置的植入甚至可能导致无法种植[2-3]。最新的研究显示,采用微创的方式拔除患牙并进行彻底的清创,在拔牙窝内填塞骨代用品的方式可以减少拔牙后牙槽嵴的吸收[4]。填充拔牙窝并保存牙槽嵴的方式包括使用各种骨代用品,屏障膜及生物活性材料等。本研究通过观察A-PRF(Advanced-platelet-rich fibrin,A-PRF)与I-PRF(Injectable-platelet-rich fibrin,I-PRF)联合博纳骨粉在前牙位点保存中的作用,旨在研究这种位点保存方案的临床效果。
1 资料和方法
1.1 研究对象:选择笔者医院2015年1月-2016年1月前牙因牙周病、外伤、炎症等需要拔除的患者63例为研究对象,其中男36例,女27例,年龄23~65岁,平均年龄(48.6±2.8)岁,随机分为三组。Ⅰ组:男12例,女9例,年龄23~62岁,平均年龄(47.5±2.6)岁;Ⅱ组:男11例,女10例,年龄26~65岁,平均年龄(48.9±3.0)岁;Ⅲ组:男13例,女8例,年龄23~65岁,平均年龄(46.8±2.7)岁。各组的基线数据资料比较无统计学差异(P>0.05),具有可比性。患者签署知情同意书,并经过本院伦理委员会审核批准。
1.2 纳入标准:①前牙因牙周病、外伤、炎症等需要拔除;②年龄>20岁;③身体健康,无拔牙禁忌证;④术前血常规检测正常,无血液病、糖尿病等系统性疾病。
1.3 A-PRF与I-PRF制备:拔牙前采集患者静脉血9ml×4置入离心机(1 500rpm,14min),离心结束取出A-PRF凝块静置10min并压膜,其中A-PRF×2剪碎后与0.5g博纳人工骨粉混合备用。随后采集静脉血7ml×2,置入离心机(800rpm,3min),離心结束使用5ml注射器吸取I-PRF注入A-PRF与博纳骨粉的混合物备用。
1.4 方法:所有的病例均由同一术者完成,拔牙均采用微创方式进行,并彻底清理拔牙窝。Ⅰ组:拔牙窝内填博纳人工骨粉与A-PRF+I-PRF混合物,表面覆盖A-PRF膜×2并缝合;Ⅱ组:拔牙窝内仅填塞博纳人工骨粉并缝合;Ⅲ组:填塞明胶海绵并缝合。
1.5 观察指标:采用视觉模拟量表(visual analog scale,VAS)记录拔牙术后24h的疼痛情况,0:无疼痛,Ⅰ(轻度):1~3分(不干扰睡眠的轻度疼痛),Ⅱ中度计4~6分(干扰睡眠的明显疼痛,要求镇痛),Ⅲ重度计7~10分(引起血压及脉搏的变化的无法忍受的严重疼痛)。
分别于拔牙前、拔牙后3个月,进行CBCT(Newtom)检查,通过NNT软件对拔牙前后牙槽骨的高度、宽度进行统计,比较三组牙槽骨高度、宽度的变化。牙槽骨高度自缺牙区中心点的牙槽嵴顶至鼻底进行测量,宽度测量牙槽嵴顶中心点的颊侧至舌侧进行测量,每组重复3次,取平均值。
1.6 统计学分析:运用SPSS19.0统计软件进行处理。计量资料采用均数±标准差(x?+s),组间比较采用单因素方差分析,P<0.05差异有统计学意义。
2 结果
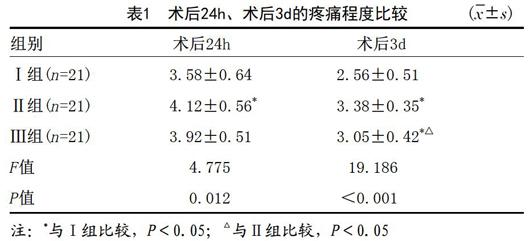
2.1 术后24h,术后3d疼痛情况:采用方差分析比较各组患者术后疼痛程度,结果显示三组患者在术后24h、术后3d的差异均有统计学意义,两两比较显示术后24hⅠ组疼痛程度小于Ⅱ组、Ⅲ组,术后3dⅠ组的疼痛程度小于Ⅱ组和Ⅲ组,见表1。
表1 术后24h、术后3d的疼痛程度比较 (x?±s)
组别 术后24h 术后3d
Ⅰ组(n=21) 3.58±0.64 2.56±0.51
Ⅱ组(n=21) 4.12±0.56* 3.38±0.35*
Ⅲ组(n=21) 3.92±0.51 3.05±0.42*△
F值 4.775 19.186
P值 0.012 <0.001
注:*与Ⅰ组比较,P<0.05;△与Ⅱ组比较,P<0.05
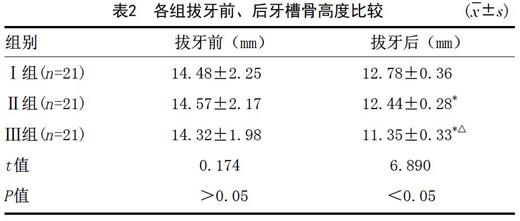
2.2 术前、术后牙槽骨高度情况:采用方差分析比较各组拔牙前、后牙槽骨高度,结果显示三组拔牙后3个月牙槽骨高度变化差异有统计学意义,两两比较显示:Ⅰ组的牙槽骨高度大于Ⅱ组和Ⅲ组,Ⅱ组的牙槽骨高度大于Ⅲ组,见表2。
表2 各组拔牙前、后牙槽骨高度比较 (x?±s)
组别 拔牙前(mm) 拔牙后(mm)
Ⅰ组(n=21) 14.48±2.25 12.78±0.36
Ⅱ组(n=21) 14.57±2.17 12.44±0.28*
Ⅲ组(n=21) 14.32±1.98 11.35±0.33*△
t值 0.174 6.890
P值 >0.05 <0.05
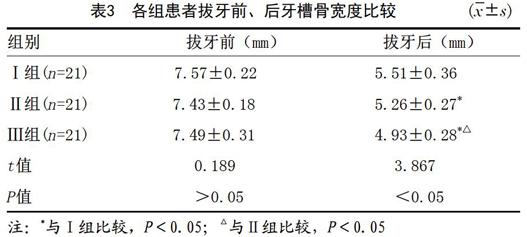
2.3 术前、术后3个月牙槽骨宽度情况:采用方差分析比较各组拔牙前、拔牙后3个月牙槽骨宽度差异,结果显示三组拔牙后3个月牙槽骨宽度变化差异均有统计学意义,两两比较显示Ⅰ组的牙槽骨宽度大于Ⅱ组和Ⅲ组,Ⅱ组的牙槽骨宽度大于Ⅲ组,见表3。
表3 各组患者拔牙前、后牙槽骨宽度比较 (x?±s)
组别 拔牙前(mm) 拔牙后(mm)
Ⅰ组(n=21) 7.57±0.22 5.51±0.36
Ⅱ组(n=21) 7.43±0.18 5.26±0.27*
Ⅲ组(n=21) 7.49±0.31 4.93±0.28*△
t值 0.189 3.867
P值 >0.05 <0.05
注:*与Ⅰ组比较,P<0.05;△与Ⅱ组比较,P<0.05
3 讨论
A-PRF是2013年Choukmun教授在S-PRF(2700rpm,12min)基础上研发的新型改良型富血小板纤维蛋白,A-PRF提取物包含兼容更高水平的血小板和血小板源生长因子。有研究显示[5],在细胞增殖测定中,A-PRF提取物包含大量的刺激骨膜细胞增殖的能力的生长因子,包括TGF-β1,PDGF-BB,VEGF,IL-1β,IL-6等,证明A-PRF不仅作为支架材料,同时作为一种释放特定生长因子和促炎细胞因子的储蓄池。另有研究表明[6],A-PRF制剂在体外使用人类骨膜细胞进行研究,发现刺激成骨细胞再生并参与的牙周骨组织的再生。Chenchev[7]对上前牙拔除后部分骨折的患者,使用A-PRF与骨移植材料修复骨缺损,4个月后复查并植入种植体,获得了满意的效果。研究证实[8],PRF的使用允许临床医师通过局部递送生长因子和蛋白质来优化组织重塑,伤口愈合和血管生成。此外,PRF可显著刺激间充质干细胞(MSC)体外和体内增殖和成骨[9]。
I-PRF是2014年Choukmun教授在A-PRF基础上研制开发的一种液体形式的不添加抗凝剂的富血小板纤维蛋白,称为注射型PRF[10],利用较慢的离心速度和更短的离心时间,制备的含有更高浓度的生长因子和白细胞的液体制剂[11],它可以在约15min的时间内与骨代用品结合并形成团块状凝胶状的移植物[12]。Choukmun认为[13],低速离心(LSCC)可选择性地富集PRF基质中的白细胞,血小板和生长因子。研究显示[14],与其他血小板浓缩物相比,I-PRF具有更大的抗微生物效力和更高的血小板计数,表明其具有更好的再生潜能。与传统PRP相比,I-PRF可显著诱导成骨细胞分化,增加钙沉积[15]。
博納骨粉由60%的羟基磷灰石(HA)和40%的β-磷酸三钙(β-TCP)组成,与骨骼内的无机矿物质近似,具有较高的生物相容性及良好的骨引导性。术后24h、术后3d,Ⅰ组的疼痛轻于Ⅱ、Ⅲ组,可能是由于A-PRF、I-PRF填入拔牙窝后,早期释放的生长因子激活了白细胞,使得疼痛反应轻于其他两组。在拔牙后3个月时,Ⅰ组的牙槽骨宽度及高度恢复明显优于Ⅱ、Ⅲ两组,提示将A-PRF、I-PRF及博纳骨粉联合应用对拔牙位点的保存效果好。在拔牙位点保存中,将A-PRF、I-PRF与博纳骨粉混用,可以有效发挥A-PRF、I-PRF的生物学作用,缓慢释放生长因子,形成优势互补,更利于拔牙位点的保存。本研究亦存在一定的缺陷与不足,如样本量较少,得到的结论仍需大样本量进一步验证。
综上所述,A-PRF与I-PRF联合博纳骨粉在前牙位点保存中可以显著促进骨组织再生,保存剩余牙槽骨,为后期进行修复提供有利条件。
[参考文献]
[1]Araújo MG,da Silva JC.Ridge alterations following grafting of fresh extraction sockets in man.A randomized clinical trial [J].Clin Oral Implants Res,2015, 26(4):407-412.
[2]Horowitz R,Holtzclaw D.A review on alveolar ridge preservation followingtooth extraction[J].J Evid Based Dent Pract,2012,12(3):149-160.
[3]Tan WL,Wong TL.A systematic review of post-extractional alveolar hard and soft tissue dimensional changes in humans [J].Clin Oral Implants Res,2012,23(5):1-21.
[4]LeventisMD,Fairbairn.Minimally Invasive Alveolar Ridge Preservation Utilizing an In Situ Hardening β-Tricalcium Phosphate Bone Substitute:A Multicenter Case Series [J].Int J Dent,2016,2016:5406736.
[5]Ghanaati S,Booms P.Advanced platelet-rich fibrin: a new concept for cell-based tissue engineering by means of inflammatory cells [J].J Oral Implantol,2014, 40(6):679-689.
[6]Nishiyama K,Okudera T.Basic characteristics of plasma rich in growth factors (PRGF): blood cell components and biological effects [J].Clin Exp Dent Res,2016, 2(2):96-103.
[7]Chenchev IL,Ivanova VV1.Application of Platelet-Rich Fibrin and Injectable Platelet-Rich Fibrin in combination of Bone Substitute Material for Alveolar Ridge Augmentation-a Case Report [J].Folia Med (Plovdiv),2017,59(3):362-366.
[8]Goyal L.Clinical effectiveness of combining platelet rich fibrin with alloplastic bone substitute for the management of combined endodontic periodontal lesion[J].Restor Dent Endod,2014,39(1):51-55.
[9]Wang Z,Weng Y. Osteoblastic mesenchymal stem cell sheet combined with Choukroun platelet-rich fibrin induced bone formation at an ectopic site [J].J Biomed Mater Res B Appl Biomater,2015,103(6):1204-1216.
[10]Miron RJ. Injectable platelet rich fibrin(I-PRF): opportunities in regenerative dentistry[J].Clin Oral Investig,2017,2(2):1-9.
[11] Fujioka-Kobayashi M, Miron RJ. Optimized platelet rich fibrin with the low speed concept: growth factor release,biocompatibility and cellular response [J].J Periodontol,2017,88(1):112-121.
[12]Wang X,Zhang Y.Behavior of Gingival Fibroblasts on Titanium Implant Surfaces in Combination with eithern Injectable-PRF or PRP [J].Int J Mol Sci,2017,18(2): 331.
[13]Choukroun J,Ghanaati S.Reduction of relative centrifugation force within injectable platelet-rich-fibrin (PRF) concentrates advances patients' owninflammatory cells, platelets and growth factors: the first introduction to the low speed centrifugation concept [J].Eur J Trauma Emerg Surg,2018,44(1):87-95.
[14]KardePA,SethiKS.Comparative evaluation of platelet count and antimicrobial efficacy ofinjectable platelet-richfibrin with other platelet concentrates:An in vitro study [J].J Indian Soc Periodontol,2017,21(2):97-101.
[15]Wang X,Zhang Y.Effects of an injectable platelet-rich fibrinon osteoblast behavior and bone tissue formation in comparison to platelet-rich plasma [J].Platelets,2018,29(1):48-55.

