血浆内脂素与多囊卵巢综合征患者糖脂代谢的相关性研究
刘聪,殷秀荣,李丽玮,董丽霞
(河北省秦皇岛市妇幼保健院生殖医学科,秦皇岛 066000)
多囊卵巢综合征(PCOS)是妇科常见的内分泌紊乱疾病,临床表现为月经稀发、闭经、不孕、肥胖等,严重影响着育龄期女性的身心健康,且远期并发症如子宫内膜癌、妊娠期糖尿病、高脂血症等的风险增高[1]。PCOS患者除性激素代谢紊乱外,大部分患者还存在糖脂代谢紊乱。机体中的脂肪组织不仅是一种能量储存组织,还是重要的内分泌器官,部分脂肪因子参与糖脂代谢及女性生殖系统的调节,如内脂素(visfatin)、趋化素(chemerin)、网膜素(omentin)等[2]。内脂素是一种脂肪因子,由内脏脂肪组织分泌。动物实验证实在高脂饮食诱导的胰岛素抵抗(IR)大鼠中,内脂素能改善胰岛素敏感性,降低大鼠血糖,表明其参与糖脂代谢,在糖脂代谢紊乱性疾病中扮演重要角色[3]。因此,本研究通过比较内脂素在不同体重指数(BMI)PCOS患者及对照组中的表达,分析其与PCOS临床指标的相关性。
一、资料与方法
1.研究对象:选取2016年3月至2017年10月在秦皇岛市妇幼保健院生殖科就诊的PCOS患者120例为研究对象,年龄20~35岁。PCOS的诊断参照美国生殖医学学会和欧洲人类生殖与胚胎学学会鹿特丹工作组修正的诊断标准[4]。将入选的PCOS患者按照WHO肥胖分类标准分组:体重指数(BMI)≥25 kg/m2为超重组(1组,62例),BMI介于18.5~24.9 kg/m2为正常体重组(2组,58例)。选取同期来我院体检中心进行体检的正常健康女性60例为对照组(3组),年龄20~35岁。
2.研究方法:测量所有研究对象的一般参数:身高(cm)、体重(kg)、血压(mmHg,记录患者安静状态下右上臂连续3次测量的平均值)、腰围(记录腋中线肋骨下缘与髂嵴连线中点水平周径,cm)、臀围(记录臀部最大周径,cm)。计算BMI=体重(kg)/身高2(m2)、腰臀比(WHR)=腰围(cm)/臀围(cm)。
受试者禁食12 h,在月经第2~4天(闭经者任意一天)晨空腹抽取外周静脉血,采用化学发光免疫法检测胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、空腹血糖(FBG)、空腹胰岛素(FIns)、性激素水平。备存血浆用酶联免疫吸附法在中心试验室检测脂肪因子内脂素水平,并计算稳态模型胰岛素抵抗指数(HOMA-IR)=FBG×FIns/22.5。

二、结果
1.一般资料比较:1组、2组和3组的年龄、身高、血压比较差异均无统计学意义(P0.05);1组的体重、BMI、腰围、WHR均显著高于3组(P<0.01);2组的WHR显著高于3组(P<0.05)(表1)。
2.各组糖脂代谢指标及内脂素水平比较:1组和3组比较,1组的TC、TG、FBG、FIns、HOMA-IR和内脂素水平均显著升高(P<0.05),HDL浓度则显著降低(P<0.05),LDL浓度组间比较无显著性差异(P0.05);2组和3组比较,2组的TC、TG、LDL、FBG、FIns、HOMA-IR、内脂素均显著升高(P<0.05),HDL显著降低(P<0.05);1组较2组的TG显著升高(P<0.05),内脂素有升高趋势,但无显著性差异(P0.05)(表2)。

表1 各组一般临床资料比较(-±s)
注:与3组比较,*P<0.05,#P<0.01

表2 各组糖脂肪代谢指标及内脂素水平比较(-±s)
注:与3组比较,*P<0.05;与2组比较,#P<0.05
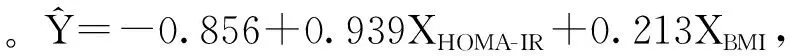
三、讨论
PCOS是育龄期女性常见的伴随有生殖功能障碍和糖代谢异常的内分泌紊乱综合征,其主要病理生理环节是IR和高雄激素血症[5]。机体内胰岛素代偿性的升高会刺激卵巢和肾上腺分泌雄激素,同时降低了肝脏性激素结合球蛋白的合成,继而导致游离睾酮的生物利用度升高。而且,IR和高雄激素血症引起了PCOS的主要临床表现。约85%的PCOS患者伴随有IR,IR也被认为是PCOS患者的主要病因学特征[6]。有研究报道,PCOS患者(包括非肥胖PCOS患者)脂肪组织功能失调是导致IR的主要原因[7]。
内脂素是一种与机体糖脂代谢密切相关的脂肪细胞因子,由脂肪组织分泌,能与胰岛素受体相结合,具有类似胰岛素的作用。有学者在动物实验中将重组内脂素注入IR的肥胖KKAy大鼠体内,通过研究发现内脂素可以激活胰岛素信号转导通路,改善大鼠体内的胰岛素敏感性,最终降低大鼠的血糖水平[3]。在多种代谢性疾病中均发现血浆内脂素的升高,如肥胖代谢综合征、2型糖尿病、妊娠期糖尿病、非酒精性脂肪肝、冠心病[8-11]。近期研究发现,内脂素作为脂肪组织功能生理调控因子,与多个脏器的胰岛素敏感性有关,有望成为与肥胖相关的多器官IR的治疗靶点[12]。
本研究提示在PCOS患者中血浆内脂素较正常人群升高,血浆内脂素与HOMA-IR和BMI正相关。Kiyak Caglayan等[13]和Sun等[14]研究发现,PCOS患者血浆内脂素较对照组显著升高,并且在肥胖患者中增高更为明显,与本研究结果一致。Ozkaya等[15]在研究中对PCOS患者使用二甲双胍治疗3个月,发现血浆内脂素、BMI、HOMA-IR、Fins均显著降低,推测其主要机制可能是通过二甲双胍改善胰岛素敏感性,进一步降低了血浆内脂素水平。这些研究提示PCOS患者体内内脂素水平升高可能是出现IR时机体为了增强胰岛素敏感性的代偿现象,但持续的IR会使氧化应激、脂质过氧化等不断加重,细胞的功能和完整性遭到破坏,内脂素虽然可以代偿性升高,但仍然无法阻止疾病的进展。
在本研究中,PCOS患者无论肥胖与否都具有不同程度的IR及高胰岛素血症,FIns及HOMA-IR均较对照组显著升高,在BMI正常的PCOS患者中,血浆内脂素也较对照组显著升高,说明对于血浆内脂素在PCOS患者中的升高来说,IR是独立于肥胖的危险因素。并且通过Pearson相关分析发现,内脂素与FIns、HOMA-IR正相关,这表明内脂素是PCOS患者或者说是有IR患者的一种内在特性。也有研究发现PCOS患者的血浆内脂素与对照组比较无统计学差异[16]。存在这些结论差异的原因也许与研究对象的样本量、种族、基因的差异有关。因此,对于PCOS患者的血浆内脂素变化需要进行更深入的探讨。
综上所述,内脂素是一个能够改善胰岛素敏感性的脂肪细胞因子,目前的研究表明其在PCOS的发生发展中起到一定作用,但其具体的作用机制有待进一步研究探讨。
【参 考 文 献】
[1] Lindholm A,Andersson L,Eliassam M,et al. Prevalence of symptoms associated with polycystic ovary syndrome[J].Int J Gynaecol Obstet,2008,102:39-43.
[2] Chen X,Jia X,Qiao J,et al. Adipokines in reproductive function:a link between obesity and polycystic ovary syndrome[J].J Mol Endocrinol,2013,50:R21-37.
[3] Fukuhara A,Matsuda M,Nishizawa M,et al. Visfatin:a protein secreted by visceral fat that mimics the effects of insulin[J].Science,2005,307:426-430.
[4] Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnosis criteria and long-term health risks related to polycystic ovary syndrome(PCOS)[J].Hum Repord,2004,19:41-47.
[5] 赵鸿娟,王煜,王丽岩,等.多囊卵巢综合征患者卵泡液中分子异常的研究进展[J].生殖医学杂志,2015,24:166-169.
[6] Ozegowska KE,Pawelczyk LA. The role of insulin and selected adipocytokines in patients with polycystic ovary syndrome(PCOS)-a literature review[J].Ginekol Pol,2015,86:300-304.
[7] Stepto NK,Cassar S,Joham AE,et al. Women with polycystic ovary syndrome have intrinsic insulin resistance on euglycaemic-hyperinsulaemic clamp[J].Hum Reprod,2013,28:777-784.
[8] Scherer PE. The multifaceted roles of adipose tissue-therapeutic targets for diabetes and beyond:the 2015 banting lecture[J].Diabetes,2016,65:1452-1461.
[9] Liang Z,Wu Y,Xu J,et al. Correlations of serum visfatin and metabolisms of glucose and lipid in women with gestational diabetes mellitus[J].J Diabetes Investig,2016,7:247-252.
[10] Yamaguchi S,Yoshino J. Adipose tissue NAD+ biology in obesity and insulin resistance:From mechanism to therapy[J].Bioessays,2017,39. doi:10.1002/bies.201600227.
[11] Kong Q,Xia M,Liang R,et al. Increased serum visfatin as a risk factor for atherosclerosis in patients with ischaemic cerebrovascular disease[J].Singapore Med J,2014,55:383-387.
[12] Stromsdorfer KL,Yamaguchi S,Yoon MJ,et al. NAMPT-mediated NAD(+)biosynthesis in adipocytes regulates adipose tissue function and multi-organ insulin sensitivity in mice[J].Cell Rep,2016,16:1851-1860.
[13] Kiyak Caglayan E,Engin-Üstun Y,Sari N,et al. Is there association between vitamin D levels,apelin 36,and visfatin in PCOS?[J].Gynecol Endocrinol,2016,32,386-389.
[14] Sun Y,Wu Z,Wei L,et al. High-visfatin levels in women with polycystic ovary syndrome:evidence from a meta-analysis[J].Gynecol Endocrinol,2015,31:808-814.
[15] Ozkaya M,Cakal E,Ustun Y,et al. Effect of metformin on serum visfatin levels in patients with polycystic ovary syndrome[J].Fertil Steril,2010,93:880-884.
[16] Farshchian F,Ramezani Tehrani F,Amirrasouli H,et al. Visfatin and resistin serum levels in normal-weight and obese women with polycystic ovary syndrome[J].Int J Endocrinol Metab,2014,12:e15503.

