激光辅助孵化技术在透明带异常患者新鲜移植周期中的应用及安全性分析
倪晓蓓,王珊珊,陈林君,徐志鹏,孙海翔,张宁媛
(南京大学医学院附属鼓楼医院生殖医学中心,南京 210008)
在哺乳动物中,随着胚胎的发育,透明带(zona pellucida)逐渐变薄,胚胎穿出透明带的过程称为孵出。胚胎顺利孵出是成功植入的先决条件。孵出的过程包括囊胚腔不断地扩张,透明带因囊胚腔的压力开始变薄,胚胎通过最薄弱的地方挤出,留下完整的透明带[1]。在辅助生殖技术中,体外的各种操作可能会使胚胎的透明带发生硬化[2],使得胚胎的孵出和植入受到影响。辅助孵化(AH)是对胚胎透明带进行削薄、打洞或者进行部分切割处理,帮助胚胎从透明带中孵出,从而提高种植率的技术,常用的方法主要有化学法、机械法或者激光法[3]。激光AH技术使用非接触式红外二极管激光器,通过显微镜物镜传递方式作用于靶区域,使得透明带被快速、可控地显微切割,该技术操作简易且精准,已被广泛用于临床[4]。在行辅助生殖技术的过程中会出现特征明显的透明带异常的卵母细胞,在光学显微镜下主要表现为透明带外观透亮而且致密,边缘犹如锯齿状,伴形状不规则,同时卵周隙表现为小或者未见卵周隙[5]。本研究旨在探讨激光AH技术是否可以改善这部分具有优质胚胎的透明带异常患者的妊娠结局,并随访流产率、畸形率、多胎率,评估AH应用的可行性,从而为指导临床实践提供依据。
资料和方法
一、研究对象
回顾性分析2013年1月至2016年12月在鼓楼医院生殖医学中心行辅助生殖治疗的透明带异常患者的临床资料。透明带异常诊断标准:透明带外观在光学显微镜下表现为透亮而且致密,边缘犹如锯齿状,伴形状不规则,同时卵周隙表现为小或者未见卵周隙。共有154例透明带异常患者,为了进一步分析激光AH在该类患者中的作用,将第3天(D3)新鲜周期双胚胎移植的透明带异常患者进行再次筛选。纳入标准:(1)常规长方案促排卵;(2)年龄≤35岁;(3)夫妻双方染色体核型分析正常;(4)第3天新鲜周期双胚胎移植,且至少1个为优质胚胎,细胞数在7~9个,碎片在5%~10%,细胞大小均一;(5)排除合并子宫畸形或病变的患者,如中重度子宫内膜异位症、多发性息肉等。共筛选到符合要求的透明带异常患者48例,均行激光AH,设为AH组;随机筛选透明带正常未行激光AH且满足以上5条筛选标准的290例患者设为对照组。所有患者均知情同意并签署知情同意书。
二、研究方法
1.促排卵方案:进行常规方案促排卵,B超下行卵泡监测,待主导卵泡直径达18~20 mm当晚注射HCG,HCG注射36 h左右后取卵。
2. IVF:取卵后,将卵丘复合物置于IVF培养液(Vitrolife,瑞典)中预培养3 h,按1×104/卵的密度加入精子,通过观察第二极体的排出情况判断是否受精。
3. ICSI:将卵丘复合物在IVF培养液中预培养3 h,用透明质酸酶消化卵母细胞周围的颗粒细胞,将卵母细胞置于IVF 培养液中培养1 h左右后行ICSI。
4.妊娠的判断:胚胎移植后14 d检测血HCG值,如阳性则为生化妊娠;4~6周后行B超检查,如见孕囊及胎心搏动者为临床妊娠。
三、统计学分析

结 果
一、透明带异常患者的临床妊娠情况
共发现透明带异常的患者154例,其中由于胚胎发育差无可用胚胎的33例,可用胚胎少D2提前移植的6例,D3移植的115例。在D3移植的患者中新鲜周期移植的为81例,其中单胚胎移植(ET1)者10例,双胚胎移植(ET2)者71例。各患者的妊娠情况见表1。
二、AH组与对照组患者一般情况比较
为了分析激光AH技术在透明带异常患者中的作用,我们设置了AH组和随机对照组进行比较,两组患者的一般资料如年龄、FSH水平、体重指数(BMI)、内膜厚度比较差异均无统计学意义(P0.05)(表2)。
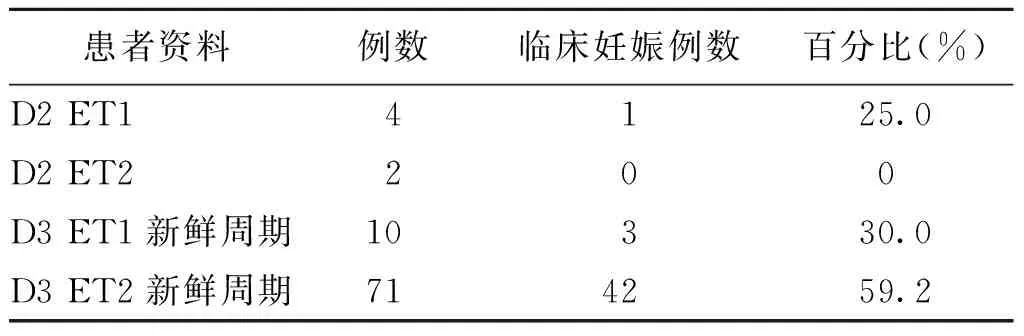
表1 透明带异常患者的临床妊娠情况
三、两组临床妊娠结局比较
AH组患者临床妊娠34例,临床妊娠率70.83%;对照组患者临床妊娠219例,临床妊娠率75.52%,两组临床妊娠率比较无统计学差异(P0.05),且多胎率、活产率、早产率、流产率及异位妊娠率比较差异均无统计学意义(P0.05)。

表2 AH组与对照组患者一般情况比较(-±s)
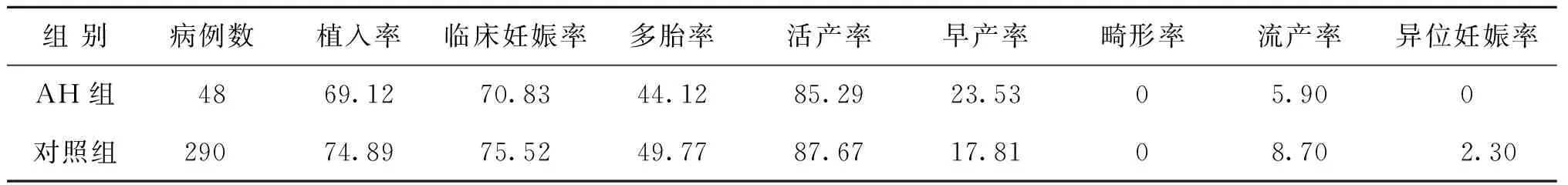
表3 AH组与对照组患者妊娠结局比较(%)
讨 论
胚胎顺利孵出是成功植入的先决条件。Cohen等[6]科学家首先对分裂期胚胎运用了AH技术,AH的临床实践正是基于此而开展的。目前AH的方法主要有机械法、化学法和激光法,近年来使用非接触式红外二极管激光器已经日益广泛[7]。
研究表明,AH技术的运用显著提高了临床妊娠率[8]和活产率[9]。据报道,高龄、胚胎透明带异常、高FSH、冻融复苏周期是AH的常见适应证[10-13],AH增加了IVF-ET周期中这部分预后不良患者的妊娠结局[14-16]。彭姝明等[17]报道激光AH技术显著提高了高龄患者的种植率,但同时也增加了多胎率。赵芳等[18]报道该技术提高了玻璃化囊胚冻融周期的胚胎种植率,但并未增加流产率、异位妊娠率。
人类卵母细胞透明带异常的发生率在2%~5%[19]。在本中心的临床实践中也的确发现了特征性透明带异常[5]的卵母细胞和胚胎,该类患者的透明带形态与临床使用的方案无相关性,激素水平也未表现出异常[20],在临床诊断过程中该现象较难预测。但透明带在卵母细胞受精和后续胚胎发育中发挥了重要作用,在受精时可以阻止多精受精,在孵化之前对胚胎具有保护作用,如果透明带异常,在早期会影响受精[5],后期可能会影响胚胎植入[20]。Sauerbrun-Cutler等[20]报道透明带形态异常的卵母细胞组行ICSI后临床妊娠率和种植率均较正常组显著下降,这可能是由于这部分患者可用卵母细胞及胚胎少。在研究中我们也发现了类似的规律,154例透明带异常患者中由于胚胎发育差无可用胚胎的共33例,可用胚胎少D2提前移植的6例,D3移植的无论是冻胚移植还是鲜胚移植临床妊娠率均较低。
本研究旨在探讨移植前行激光AH技术是否可以改善透明带异常患者的妊娠结局。为了排除胚胎冻融、胚胎等级、胚胎移植数目、年龄因素、促排方案等的影响,我们进一步对这部分患者进行了筛选,将符合纳入标准的患者纳入研究,同时随机筛选符合同等条件的290例透明带正常、未行激光AH的患者为对照,结果显示两组患者的一般情况如年龄、BMI、激素水平和内膜厚度等差异均无统计学意义(P0.05)。对于虽然透明带异常但是有优质胚胎的患者,在行激光AH技术后获得了与对照组相似的植入率、临床妊娠率、活产率,且并未增加流产率、畸形率、多胎率等不良结局风险。
综上所述,对透明带异常患者移植前行激光AH后,可以提高胚胎的利用率,改善患者的妊娠结局。但是本研究仍存在一定的局限性。为了维护患者的最大利益,对照组是透明带正常且不行激光AH的患者,因此文章显示了一个多因素的结局:一方面说明该技术是有效的,另一方面也说明这些透明带异常的部分胚胎是有一定发育潜能的。此外导致这部分透明带异常患者的机制还需进一步探索。
【参 考 文 献】
[1] Kirkegaard K,Hindkjaer JJ,Ingerslev HJ. Hatching of in vitro fertilized human embryos is influenced by fertilization method[J].Fertil Steril,2013,100:1277-1282.
[2] Nada AM,El-Noury A,Al-Inany H,et al. Effect of laser-assisted zona thinning,during assisted reproduction,on pregnancy outcome in women with endometriosis:randomized controlled trial[J].Arch Gynecol Obstet,2018,297:521-528.
[3] 陈曦,梁蓉,石程,等. 透明带薄化法激光辅助孵化对慢速冷冻和玻璃化冷冻卵裂期胚胎临床结局的影响[J].生殖与避孕,2011,31:671-675.
[4] Wong BC,Boyd CA,Lanzendorf SE. Randomized controlled study of human zona pellucida dissection using the zona infrared laser optical system:evaluation of blastomere damage,embryo development,and subsequent hatching[J].Fertil Steril,2003,80:1249-1254.
[5] 赵静,张宁媛,徐志鹏,等. 体外受精-胚胎移植周期透明带透亮致密患者的受精与临床结局[J].生殖与避孕,2013,33:743-748.
[6] Cohen J,Alikani M,Trowbridge J,et al. Implantation enhancement by selective assisted hatching using zona drilling of human embryos with poor prognosis[J].Hum Reprod,1992, 7:685-691.
[7] Primi MP,Senn A,Montag M,et al. A European multicentre prospective randomized study to assess the use of assisted hatching with a diode laser and the benefit of an immunosuppressive/antibiotic treatment in different patient populations[J].Hum Reprod,2004,19:2325-2333.
[8] Zeng M,Su S,Li L. The effect of laser-assisted hatching on pregnancy outcomes of cryopreserved-thawed embryo transfer:a meta-analysis of randomized controlled trials[J].Lasers Med Sci,2018,33:655-666.
[9] Zhou H,Zao W,Zhang W,et al. No adverse effects were identified on the perinatal outcomes after laser-assisted hatching treatment[J/OL]. Reprod Biomed Online,2014,29:692-698.
[10] Lewis EI,Farhadifar R,Farland LV,et al. Use of imaging software for assessment of the associations among zona pellucida thickness variation,assisted hatching,and implantation of day 3 embryos[J].J Assist Reprod Genet,2017,34:1261-1269.
[11] 丁锦丽,杨菁,李风和,等. 移植胚胎数量和辅助孵化对高龄不孕症患者助孕临床结局的影响[J].生殖医学杂志,2016,25:16-21.
[12] 王秀霞,李达. 辅助孵化技术新证据[J].生殖医学杂志,2017,26:627-629.
[13] 李脉,周黎明,孙亦婷,等. 激光透明带削薄技术对冻融胚胎移植临床结局的影响[J].生殖医学杂志,2013,22:658-662.
[14] Wan CY,Song C,Diao LH,et al. Laser-assisted hatching improves clinical outcomes of vitrified-warmed blastocysts developed from low-grade cleavage-stage embryos:a prospective randomized study[J/OL]. Reprod Biomed Online,2014,28:582-589.
[15] Carney SK,Das S,Blake D,et al. Assisted hatching on assisted conception(in vitro fertilisation(IVF)and intracytoplasmic sperm injection(ICSI)[DB/OL].Cochrane Database Syst Rev,2012,(12):CD001894.
[16] Padula F,Capriglione S,Iaconianni P,et al. Laser-assisted hatching of human embryos:may two alternative approaches(thinning versus drilling)impact on implant rate?[J].Lasers Med Sci,2017,32:1663-1666.
[17] 彭姝明,刘海鹏,陈艺,等. 激光辅助孵化对多囊卵巢综合征患者体外受精-胚胎移植治疗结局的影响分析[J].生殖医学杂志,2016,25:429-433.
[18] 赵芳,吕玉珍,王娟,等. 激光辅助孵化在玻璃化冻融胚胎移植周期中的应用[J].生殖医学杂志,2015,24:718-721.
[19] Rienzi L,Vajta G,Ubaldi F. Predictive value of oocyte morphology in human IVF:a systematic review of the literature[J].Hum Reprod Update,2011,17:34-45.
[20] Sauerbrun-Cutler MT,Vega M,Breborowicz A,et al. Oocyte zona pellucida dysmorphology is associated with diminished in-vitro fertilization success[J].J Ovarian Res,2015,8:5.

