miR-195-5p在结直肠癌和肺癌细胞中的功能差异性研究
汪楚翔,刘涵,张函槊
1.北京市第十五中学 高二七班,北京 100054;2.首都医科大学附属复兴医院 肿瘤科,北京100038;3.北京基石生命科技有限公司,北京 100195
微小RNA(microRNA,miRNA)是一类非编码小RNA,约22个核苷酸,通过碱基互补配对(完全配对或不完全配对)靶向mRNA的3′非翻译区(3′-UTR),直接降解mRNA或抑制翻译,从而完成对靶基因的转录后调控。,miRNA序列数据库22.0(miRBase)目前收集到发夹前体序列38589条,成熟miRNA和miRNA*产物共48885条,形成了巨大的调控网络。miRNA与许多生理病理过程密切相关,如生长发育、细胞分化、细胞凋亡、脂类代谢、激素分泌、肿瘤形成和病毒感染等。
miR-195序列首先发现于鼠基因,后经同源序列预测在人类基因中得以验证。hsa-miR-195位于染色体17pl3.1区,由7017615~7017701的碱基对构成。miR-195是miR-15/16/195/424/497家族的重要成员,在多种疾病如癌症、心力衰竭和精神分裂症中发挥重要作用[1-2]。近年的靶标预测及实验研究表明,miR-195可通过CCND3、FLT3、WEE1[3]、E2F2[4]、Bcl-2、BNDF[5]、Arl2[6]等靶点发挥作用。研究表明,miR-195具有抑制细胞周期转换,促进细胞凋亡的普遍作用,所以miR-195容易被简单地概括为一种抑癌因子,但事实可能并非如此。我们采用生物信息学和实验生物学方法,比较了miR-195在结直肠癌和肺癌组织、细胞中的表达差异,并初步探讨了miR-195在人结直肠癌和肺癌细胞中的功能差异。
1 材料与方法
1.1 材料
人结直肠癌细胞系SW620、人肺癌细胞系A549、小鼠肺癌细胞系344SQ、小鼠结直肠癌细胞系MC38(中国医学科学院基础医学研究所细胞资源中心);RMPI-1640培养基、胎牛血清、Lipo⁃fectAMINE2000(Invitrogen公司);miR-195-5p模拟物(广州锐博公司);Transwell小室、Matrigel基质胶(康宁公司);CCK-8试剂盒(上海碧云天公司);All-in-OnemiRNAqRT-PCR检测试剂盒(GeneCopoeia,公司)。
1.2 miRNA肿瘤组织表达分析
利用starBase泛癌分析平台(http://starbase.sy⁃su.edu.cn/panCancer.php)挖掘来自癌症基因组图谱(TCGA)的不同癌症类型的miRNA表达谱。
1.3 细胞总RNA提取
细胞用1×PBS缓冲液漂洗2次,每孔加入1 mLTRIzol试剂,室温裂解至细胞裂解物清亮;加入200μL氯仿,剧烈振荡10s,室温静置5min;4℃、12000r/min离心15min;小心吸取上层水相移至新管,加等体积异丙醇,颠倒混匀后室温静置30min;4℃,12000r/min离心15min后见管底白色沉淀即为总RNA;吸弃上清,加入1 mL80%乙醇颠倒混匀;4℃、10000r/min离心15min;弃上清后室温晾干,用DEPC水溶解沉淀;取适量RNA样品,稀释后用紫外分光光度计测定浓度,读取D260nm/D280nm比值测定纯度,电泳鉴定RNA的完整性。
1.4 实时荧光定量PCR(qRT-PCR)
用All-in-OnemiRNAqRT-PCR检测试剂盒分析miRNA相对含量。按照说明书步骤,用通用反转录引物(5′-GCGAGCACAGAATTAATACGAC TCACTATAGGTTTTTTTTTTTTTTTTTTVN-3′)将 2 μg总RNA反转录(反转录条件:反应总体积25 μL,37℃反应 60min,结束后再进行85℃、5min灭活处理),所得反转录产物用灭菌水稀释至1/20,采用特异上游引物(5′-CGCAGTAGCAGCAC AGA-3′)和通用下游引物(5′-GCGAGCACAGAA TTAATACGAC-3′)进行下游qPCR实验,反应体积20 μL(PCR条件:95℃预变性 10min;95℃变性10s,58℃退火20s,72℃延伸10s,40个循环),U6作为内参(U6上游引物:5′-CTCGCTTCGGCA GCACA-3′),通过 CT(2-ΔΔCt)方法分析 miRNA 相对含量。各组PCR均进行3孔重复。
1.5 细胞转染
将细胞按2×105/mL的密度种于24孔板中,用含10%胎牛血清的RMPI-1640培养基于37℃、5%CO2条件下培养;用LipofectAMINE2000转染试剂转染细胞;每孔取0.5μL转染试剂和miRNA模拟物20pmol,分别稀释于250μL无血清1640培养基中,轻弹混匀,室温静置5min;将稀释好的转染试剂加入miRNA稀释物中,轻弹混匀,室温静置20min;将miRNA-转染试剂混合物逐滴加入细胞培养板中,培养4h后更换培养基,继续培养48h后提取总RNA用于miRNA定量检测。
1.6 细胞增殖实验
取对数生长期的细胞,制备单细胞悬液,以2×103/孔种于96孔板,37℃培养 24、48、72和96h后进行CCK-8检测,即每孔加入10μLCCK-8,4h后在酶标仪上测定各孔的D450nm值,以时间为横坐标、D450nm值为纵坐标绘制细胞生长曲线。
1.7 细胞迁移实验
取对数生长期的细胞,制备单细胞悬液,以5×105/孔接种于6孔板,37℃培养过夜后进行实验处理。继续培养24h,消化细胞制备单细胞悬液,稀释至2×105/mL,每种细胞种3个小室,每个小室中加入200μL细胞,在24孔板中加入500 μL含10%胎牛血清的培养基作为下液,将Tran⁃swell小室放入孔中,继续培养12~24h取出小室,用棉签擦去小室内表面未穿膜的细胞,甲醇固定15min,DAPI染核 10min,用PBS洗3次,于荧光显微镜下观察,20×10视野下计数细胞,共计数5个视野,统计结果。
1.8 细胞侵袭实验
将冻存于-80℃冰箱的Matrigel基质胶于4℃过夜(24h),变成液态。取300μL无血清培养基,加入 60 μL(或 50 μg/室)Matrigel,4℃混匀,加入Transwell小室各100 μL(3个室),放入37℃培养箱中孵育4~5h,当出现白色层时说明已经变为固态。其余步骤同细胞迁移实验。
1.9 统计分析
用SPSS16.0软件进行统计学分析。计量资料采用x±s表示,组间数据比较采用t检验分析和方差分析,多重比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 miR-195-5p在肺癌和结肠癌组织中的表达差异
通过starBasev2.0中的Pan-CancerPlatform直接调用TCGA数据库中有关miR-195-5p的miRNA-seq数据,并进行分析。数据中包括440例肺腺癌、332例肺鳞癌和314例结直肠癌样本,均以相对应的正常组织为对照。结果(图1)显示,miR-195-5p在肺腺癌和肺鳞癌中的表达含量都低于正常组织,然而在结直肠癌中的相对含量却高于正常对照。

图1 通过starBase分析TCGA数据库中miR-195-5p在肺癌与结直肠癌组织中的表达差异
2.2 miR-195-5p在肺癌和结肠癌细胞中的表达差异
进一步通过实时定量PCR检测了miR-195-5p在肺癌和结直肠癌细胞中的相对表达含量。实验采用了4种细胞,即人结直肠癌细胞SW620、人肺癌细胞A549、小鼠肺癌细胞344SQ和小鼠结直肠癌细胞MC38。结果显示,无论在人还是小鼠的肺癌细胞中,miR-195-5p的相对含量均显著低于对应的结直肠癌细胞(图2)。miR-195-5p在肺癌和结直肠癌组织中的表达差异揭示了miR-195-5p在不同肿瘤中可能具有不同的甚至相反的生物学功能。
2.3 miR-195-5p对肺癌与结肠癌细胞的增殖调控
为了探讨miR-195-5p在肺癌和结肠癌细胞中潜在的功能差异,我们首先检测了miR-195-5p对2种肿瘤细胞的增殖影响。CCK-8检测结果表明,miR-195-5p模拟物转染A549及SW620细胞,与转染无关对照miRNA(NCmiRNA)模拟物组相比,在72h后细胞增殖都发生明显改变。有趣的是,miR-195-5p过表达后对2种肿瘤细胞的增殖产生了完全相反的效应,表现出抑制肺癌细胞但却促进结直肠癌细胞的增殖(图3)。
2.4 miR-195-5p对肺癌与结直肠癌细胞侵袭与迁移的调控
利用Transwell检测了miR-195-5p对肺癌与结直肠癌细胞侵袭与迁移能力的影响。结果与增殖调控类似,miR-195-5p在2种肿瘤细胞中调控迁移与侵袭的能力迥异。与细胞迁移结果一致,miR-195-5p的过表达能够抑制肺癌细胞A549的侵袭与迁移(图4A),反过来促进结直肠癌细胞SW620的侵袭与迁移(图4B)。
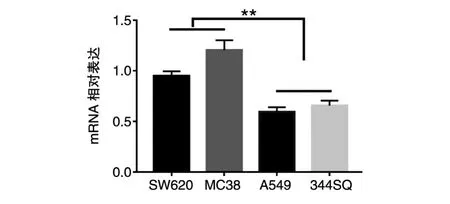
图2 实时定量PCR检测miR-195-5p在人肺癌细胞A549和人结直肠癌细胞SW620中的相对表达含量(**P<0.01)
3 讨论
随着对miRNA研究的深入,越来越多的证据表明,在不同组织、器官、细胞类型和生长发育过程中,miRNA的表达谱有很大差异,揭示miRNA的表达具有时序特异性和组织特异性。每种miRNA针对的数个甚至上百个潜在靶基因,在不同的细胞或同一细胞的不同状态下发挥功能性靶标的作用也有所不同[7]。这些研究结果不但说明miRNA及其靶标具有时空动态变化的特性,而且也提示miRNA在机体内发挥作用的复杂性。
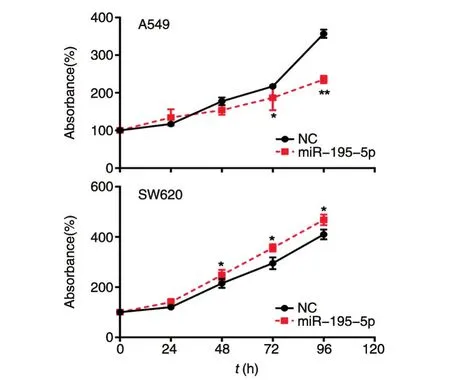
图3 CCK-8法检测miR-195-5p对人结直肠癌细胞SW620和人肺癌细胞A549增殖的影响(*P<0.05,**P<0.01)

图4 Transwell法检测miR-195-5p对人结直肠癌细胞SW620和人肺癌细胞A549迁移与侵袭的影响
本研究通过starBase调用TCGA数据库,分析了miR-195-5p在结直肠癌(314例)和肺癌(646例)中的表达情况,发现miR-195-5p在结直肠癌中相对于正常组织是高表达的,而在肺癌中截然相反。随后,我们通过结肠癌和肺癌细胞证实了miR-195-5p在表达上,以及细胞增殖、侵袭与迁移功能上的差异,揭示了miR-195-5p调控功能的复杂性。
同时有研究表明,miR-195-5p在其他肿瘤中的表达有高有低,在舌鳞状细胞癌[8]、膀胱肿瘤[9]、原发性腹膜癌[10]、乳腺癌[11]、胃癌和肝细胞癌[12]中均表达下调,在替莫唑胺耐药的胶质细胞瘤[13]、肾上腺皮质癌[14]、慢性淋巴细胞白血病[15]中表达上调。因此,miR-195在不同类型的肿瘤中表达不同,其在肿瘤发生和发展中的作用,不能简单地概括为一种抑癌因子或促癌因子,miR-195在肿瘤中的作用仍有待进一步研究。
参考文献

