不同干燥方法对香菇柄多糖的体外抗氧化研究
杨卓,王艳辉*,尹宝颖,石海燕
(1.河北农业大学 生命科学学院 河北省植物生理和分子病理学重点实验室, 河北 保定 071001;2.河北农业大学 园艺学院,河北 保定 071001)
香菇多糖是从香菇中提取的一种十分重要的活性成分,研究表明,其具有提高机体的免疫功能、抑制肿瘤、抗感染、抗病毒的作用。此外,还具有抑制血小板凝集、降血脂、降血糖、抗衰老、护肝、促进骨骼生长等多方面的药理活性,无任何毒副作用,是一种很好的免疫调节剂[1-5]。香菇由香菇盖和香菇柄组成,香菇盖因为味鲜、肉质肥厚和营养价值高,被用于销售食材。而香菇柄因其口感粗糙常被作为下脚料而遭到丢弃,从而造成了资源的极大浪费和环境污染。据报道,每年全国废弃的香菇柄达到了数万吨[6-8]。因此,将香菇柄用于工业生产有很大的潜在研究价值,本实验选用的材料是这些香菇的下脚料。
香菇的很多功效与香菇具有很好的抗氧化活性之间有很重要的关系,香菇多糖的体外抗氧化研究的文献有很多,可是香菇柄多糖的体外抗氧化的文章未见报道。采用合理的干燥方法可以使物料原有的营养成分尽可能多地保留[9]。刘丽娜等研究发现热风温度为50 ℃时,香菇柄能更有效的保留原有的营养成分,并且没有人比较不同的干燥方式对于香菇柄多糖的抗氧化的影响以及多糖提取是否需要醇沉和时间对于抗氧化的影响[10]。郑义等研究表明高良姜多糖对DPPH和ABTS自由基的清除能力与多糖浓度呈正相关[11]。在文章中研究了香菇柄多糖的DPPH自由基、ABTS自由基和还原力,并同时与具有显著抗氧化效果的VC进行比较,目的在于为人们提供一种具有较好抗氧化能力的保健食品,为以后研究提供依据。
1 材料与方法
1.1 材料与仪器
干香菇(市售)、葡萄糖、苯酚、浓硫酸、铁氰化钾、氯化铁、三氯乙酸、磷酸二氢钠、 磷酸氢二钠、酒石酸钾钠、二硝基水杨酸、氢氧化钠、亚硫酸钠、无水乙醇、ABTS、DPPH、VC、 过硫酸钾等均为分析纯。
鼎藏多功能粉碎机 浙江武义鼎藏日用金属制品厂;电子天平 奥豪斯仪器(上海)有限公司;超级恒温水浴锅 金坛市杰瑞尔电器有限公司;df-101s 集热式恒温磁力搅拌器 巩义市予华仪器有限公司;德国EPPENORF 5810R 台式高速离心机 上海肯强仪器有限公司;UV1800紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 香菇多糖的提取
香菇柄经烘干粉碎后,用蒸馏水常温浸润30 min。70 ℃水浴2 h,期间多次搅拌。然后离心(4000 r/min,20 min),将上层溶液用6层纱布过滤,将滤渣中液体挤出得到浸提液。取部分浸提液进行冷冻干燥和喷雾干燥。冷冻干燥:取多糖溶液用冷冻干燥机干燥72 h,得到冷冻干燥多糖的粉末; 喷雾干燥:将多糖溶液中加入20%的麦芽糊精,待麦芽糊精全部溶解后,将溶液放入水浴锅预热,然后用喷雾干燥机按照以下指标进行干燥,喷雾后得到多糖粉末。喷雾干燥的指标:进口温度190 ℃,热空气流量38 L/min,蠕动泵转速30 r/min,雾化压强21×10 kPa,添加助干剂麦芽糊精20%,控制出口温 度为70 ℃,折光率为4.3%。醇沉:取适当浸提液,加入3倍体积的95%乙醇,颠倒混匀,室温静置12 h后离心(4000 r/min,20 min),弃上清液,沉淀即为醇沉物;取部分醇沉物分别进行冷冻干燥和喷雾干燥,即得醇沉冷冻干燥多糖和醇沉喷雾干燥多糖。测干粉的总糖、还原糖和体外抗氧化活性,其余于-20 ℃保存,在保存的第10,20,30,40天分别检测体外抗氧化活性。
1.2.2 香菇多糖总糖含量测定
具体步骤参照姜琼等的方法[12]。
1.2.3 还原糖含量测定
采用 3,5-二硝基水杨酸(DNS)比色法测定,参照李志霞等的方法[13]。
1.2.4 DPPH自由基清除能力
参照初维等的方法并稍做修改[14]。
DPPH测试液的配制:准确称取7.864 mg DPPH用无水乙醇溶解,超声5 min,定容于10 mL容量瓶中摇匀,置于棕色瓶中保存,在3.5 h内用完。
将香菇多糖溶液稀释至一定的浓度,取2 mL多糖溶液样品置于试管中,再加入2 mL DPPH溶液,涡旋混匀,避光反应(5000 r/min 条件下离心15 min,静置 15 min),在517 nm处测其吸光值;以2 mL去离子水加入2 mL无水乙醇调零。香菇多糖提取液对 DPPH自由基清除能力用 R 表示:R(%)=[1-(Ai-Aj)/Ac]×100%。
式中:Ai为2 mL DPPH·溶液与2 mL待测样品混合液的吸光度;Aj为2 mL 待测样品溶液与 2 mL无水乙醇混合液的吸光度;Ac为2 mL DPPH·溶液与2 mL无水乙醇混合液的吸光度。
1.2.5 总抗氧化活性 ABTS
参照Ye等的方法并稍做修改[15]。
ABTS工作液的配制:将0.0768 g的ABTS和0.01324 g的K2S2O8分别溶于20 mL的去离子水,等待2种溶液充分溶解之后混匀,在室温下将混合液静置于黑暗条件下12~16 h,使用前用无水乙醇稀释,稀释至在734 nm下的吸光值为0.700±0.2。ABTS遇到氧化剂,溶液被氧化后由深蓝色生成蓝绿色的ABTS+。
取该稀释液2.9 mL,加入0.1 mL样品,混合均匀于30 ℃下反应20 min,在734 nm下测吸光值A样品,以去离子水代替样品作为对照,测吸光值A对照,ABTS·+清除率为ABTS·+=(1-A样品/A对照)×100%。
1.2.6 总还原力的变化
对一种物质来说,提供电子的能力越强,物质所具有的还原力就越强,所以,物质反映出的还原力实际上是它提供电子的能力。本实验中选择的氧化剂是铁氰化钾,具有抗氧化的物质可以使得溶液中的Fe3+还原成Fe2+,从而使反应溶液的颜色由黄色逐渐变成浅绿色,反应后在700 nm处测得吸光值。如果吸光度越大说明样品的还原能力越强,被检测的样品所具有的抗氧化能力越高[16]。
参照游丽君的方法并稍做修改[17]。
磷酸盐缓冲液的配制:取3.1196 g磷酸二氢钠溶于100 mL去离子水配制成0.2 mol/L的溶液,再取2.8392 g磷酸氢二钠溶于100 mL去离子水配制成0.2 mol/L的溶液,用pH计测定pH,使pH为6.6。
取样品2 mL置于试管中,加入1% (W/V)的铁氰化钾溶液 2 mL,再加入 0.2 mol/L 磷酸缓冲液(pH 6.6) 2 mL,涡旋混匀,置于水浴箱中50 ℃恒温反应20 min。接着加入10% (W/V) TCA 2 mL,涡旋混匀后离心10 min,转速为3000 r/min。取2 mL上清液,加入去离子水2 mL,再加入0.1%(W/V)氯化铁0.4 mL,涡旋混匀,放置反应10 min,测定样品在波长700 nm处的吸光值。
2 结果与分析
2.1 香菇柄的体外抗氧化作用研究
2.1.1 冷冻干燥的香菇柄多糖对DPPH自由基的清除VC和多糖样品对DPPH自由基的清除能力见图1。
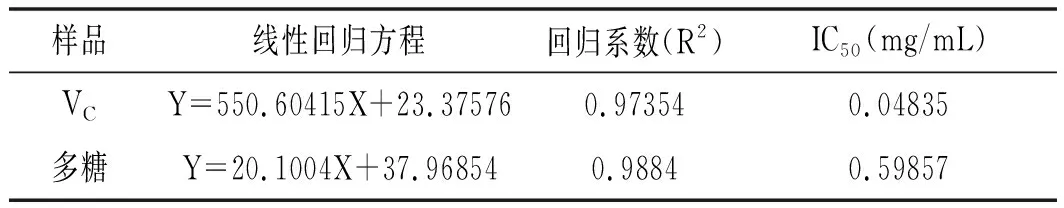
表1 DPPH自由基的清除活性分析Table 1 DPPH free radical scavenging activity analysis
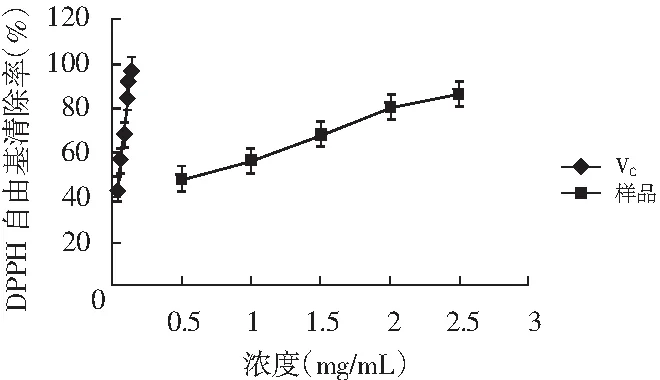
图1 香菇多糖和VC对DPPH自由基的清除能力Fig.1 Scavenging ability of DPPH free radicals of lentinan and VC
由图1可知,VC和多糖溶液均能够有效清除DPPH自由基,并且随着溶液浓度的增加清除率逐渐上升,最后逐步趋于平稳。而在DPPH测定法中,自由基清除能力的大小是用自由基的半数清除浓度,即IC50值来评价的,IC50值越小表明其自由基清除能力越强,即抗氧化能力越强[18]。由图1可知,DPPH自由基的清除能力随着多糖浓度的增加逐渐增强,但是低于VC的清除能力。溶液的颜色由紫色逐渐变成黄色,最后变成无色。溶液颜色越浅反映出溶液抗氧化活性越高。多糖和VC的IC50值分别是0.596,0.048 mg/mL。
2.1.2 冷冻干燥的香菇柄多糖对ABTS自由基的清除
香菇多糖和VC对ABTS·+自由基的清除能力见图,ABTS自由基的清除活性分析见表2。
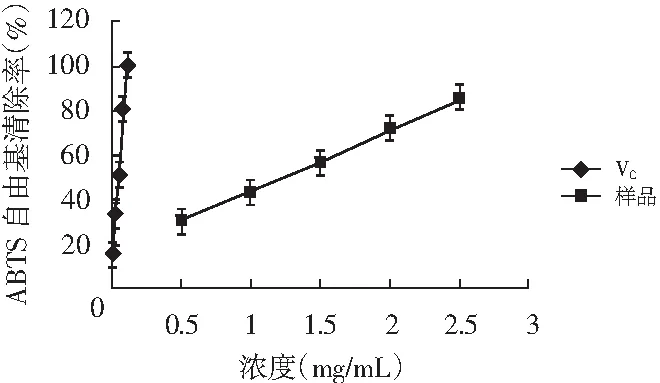
图2 香菇多糖和VC对ABTS·+自由基的清除能力Fig.2 Scavenging ability of ABTS·+ free radicals of lentinan and VC
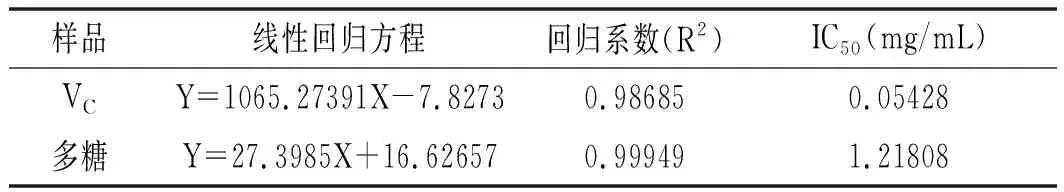
样品线性回归方程回归系数(R2)IC50(mg/mL)VCY=1065.27391X-7.82730.986850.05428多糖Y=27.3985X+16.626570.999491.21808
ABTS自由基清除能力常用于评价各种物质的总的抗氧化能力,由于抗氧化剂可以提供电子或氢原子灭活自由基,从而导致反应溶液的颜色由蓝色逐渐变浅直至无色,颜色的变化反映了物质抗氧化能力的强弱。在波长734 nm处的吸光值反映物质的抗氧化活性[19,20]。
由图2可知,随着溶液浓度的增加,对ABTS自由基的清除能力不断增大。反映出香菇柄多糖总的抗氧化能力很强,具有很好的抗氧化活性。多糖溶液和VC的IC50值分别为1.22,0.054 mg/mL。
2.1.3 冷冻干燥的香菇柄多糖总的还原力测定
香菇多糖和VC的还原力见图3,还原力分析见表3。
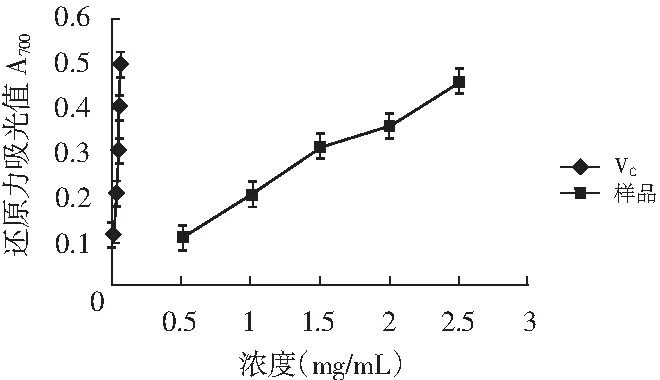
图3 香菇多糖和VC的还原力Fig.3 Reducing force of lentinan and VC

样品线性回归方程回归系数(R2)IC50(mg/mL)VCY=9.62667X+0.017670.999820.0501多糖Y=0.17213X+0.031130.986972.72386
化合物的还原力可作为化合物具有潜在抗氧化活性的重要指标。在反应溶液中加入多糖溶液和VC后可以使黄色溶液呈现不同程度的绿色,这是因为在反应溶液中存在还原剂时,能够使铁氰化钾络合物转化为亚铁形式,并且在700 nm波长处有最大吸收峰,吸光值越大反映化合物的还原力越强[21]。由图3可知,VC和多糖溶液的还原能力随浓度的增加而增大,但VC与多糖溶液的还原能力具有显著的不同,多糖溶液和VC的 IC50值分别是2.72,0.05 mg/mL。
2.2 不同提取方法的体外抗氧化活性的比较

图4 四种多糖的DPPH自由基的清除能力Fig.4 Scavenging ability of DPPH free radicals of four polysaccharides
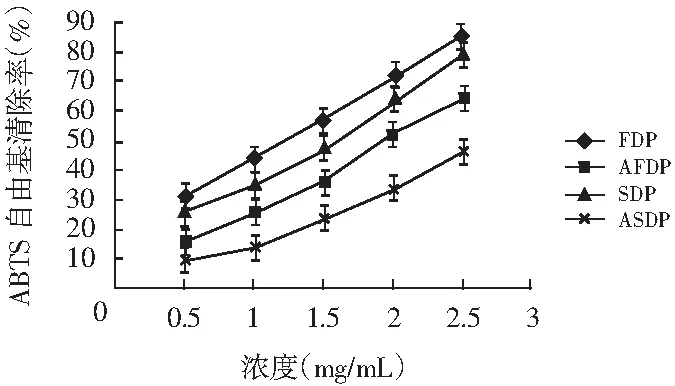
图5 四种多糖的ABTS自由基的清除能力Fig.5 Scavenging capacity of ABTS free radicals of four polysaccharides
由图4和图5可知,不同干燥方法下提取的香菇柄多糖对DPPH自由基清除能力大小依次为:FDP>SDP>AFDP>ASDP,对ABTS自由基清除能力大小依次为:FDP>SDP>AFDP>ASDP。FDP>SDP,AFDP>ASDP得知冷冻干燥得到的多糖比喷雾干燥得到的多糖具有更好的清除自由基的能力,有更好的体外抗氧化活性。因为喷雾需要较高的温度,香菇多糖在温度高于80 ℃的水溶液中,糖链由三重螺旋解螺旋变为松散的单链[22],高温使得多糖的结构可能被破坏,所以活性受到了影响。
由FDP>AFDP,SDP>ASDP可知, 醇沉后的多糖的抗氧化性要比没有醇沉的弱,因为醇沉后的多糖变得质地坚硬不溶于水,在溶解过程中破坏了多糖的结构,使得多糖的抗氧化性弱于未醇沉的多糖。并且醇沉后可能损失了一些物质,可能损失的物质具有抗氧化活性。所以选择了冷冻干燥并且无醇沉的多糖来研究时间对于体外抗氧化的影响,分别研究了第10,20,30,40天对抗氧化活性的影响。
2.3 储存时间对于香菇柄多糖体外抗氧化性的影响
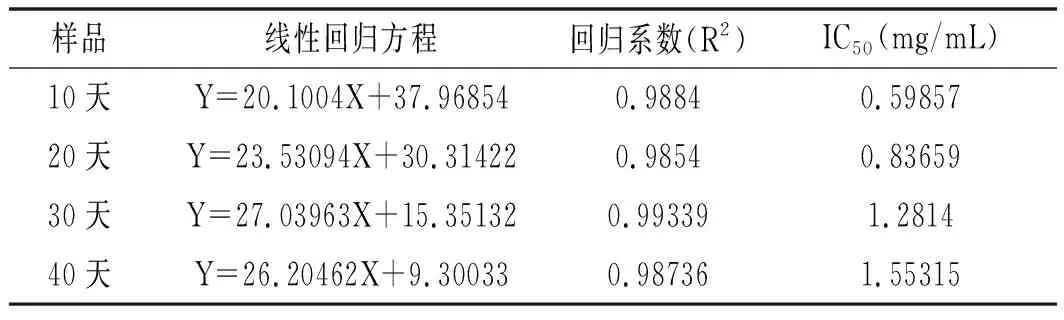
表4 DPPH自由基的清除活性分析Table 4 DPPH free radical scavenging activity analysis
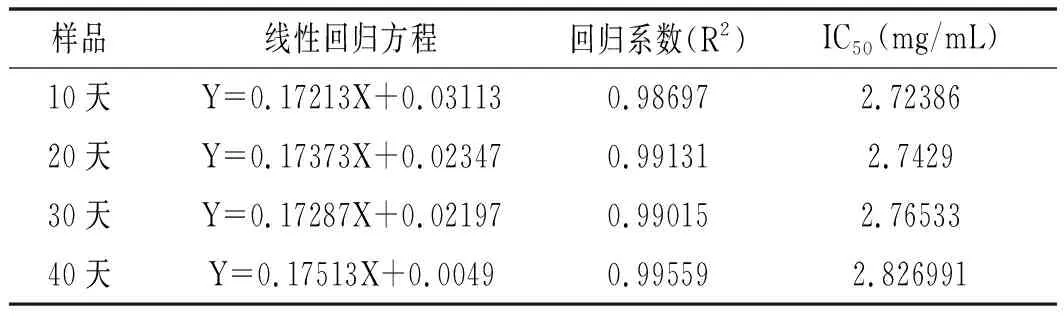
表5 ABTS自由基的清除活性分析Table 5 ABTS free radical scavenging activity analysis

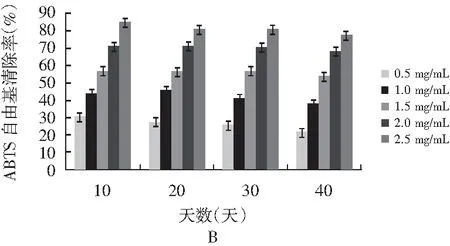
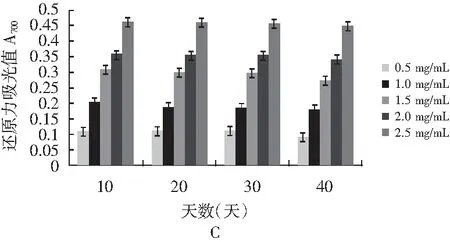
图6 不同时间段和浓度的香菇柄多糖的抗氧化性Fig.6 Antioxidant activities of Lentinus edodes stem polysaccharides at different time and content
注:A为DPPH自由基清除率;B为ABTS自由基清除率;C为还原力。
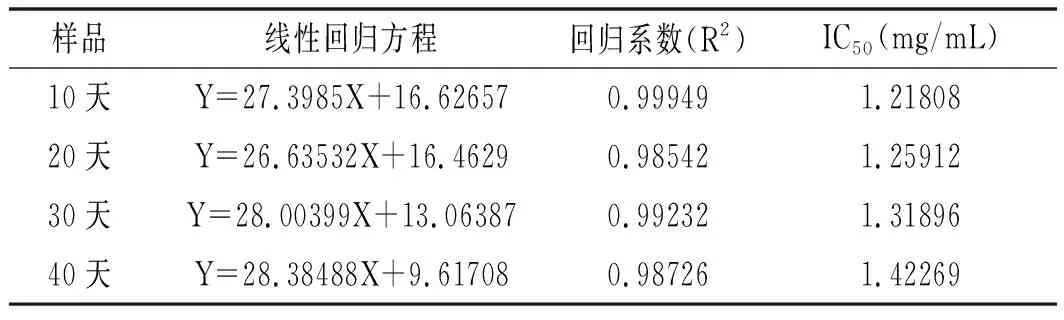
表6 总的还原力Table 6 Reducing force analysis
由表4~表6可知,香菇柄多糖随着贮存时间的延长,IC50值逐渐增大,表明多糖抗氧化性逐渐减弱。由图6可知,40天结束后对DPPH自由基和ABTS自由基的清除能力很强并且有很好的还原力,反映出香菇柄多糖还具有较好的抗氧化活性。抗氧化活性随着时间延长而逐渐减弱,但是仍然具有很好的抗氧化活性。在40天结束后当香菇柄多糖质量浓度为2 mg/mL时,其DPPH和ABTS自由基清除率分别达59.8%和70%,表明香菇柄多糖具有良好的抗氧化活性,而抗氧化能力对癌症、动脉硬化、糖尿病、心血管病、老年痴呆等疾病的治疗有着重要的意义[23]。
3 结论
香菇柄多糖对DPPH自由基和ABTS自由基有着很好的清除作用,并且具有很好的还原力,说明香菇柄多糖具有很好的体外抗氧化活性。香菇柄多糖的抗氧化性具有剂量和时间的依赖性。
香菇柄多糖的抗氧化活性均随着多糖浓度增加而逐渐增长。在相同的多糖浓度下,冷冻干燥得到的多糖的体外抗氧化活性要显著高于喷雾得到的多糖的抗氧化活性,醇沉得到的多糖的体外抗氧化活性要低于没有醇沉得到的多糖的抗氧化活性。因为喷雾在干燥过程中需要较高的温度,入口温度达到190 ℃,出口温度达到70 ℃。在高温下多糖的结构可能发生变化,进而影响了多糖的抗氧化活性。在醇沉后多糖粉末质地坚硬,再次溶于水需要较高温度,所以多糖结构可能改变,进而影响体外的抗氧化效果,多糖结构的变化需要进一步研究。香菇柄多糖的提取在醇沉前后的体外抗氧化存在着很大的不同,没有经过醇沉的香菇柄多糖体外抗氧化活性明显高于醇沉后的,没有经过醇沉的香菇柄多糖杂质较多,并且用于干燥的成本很大,所以在工业生产上选择了醇沉的方法,这样可以大大提高提取效率。
香菇柄多糖能够很好地清除自由基,具有很好的体外抗氧化活性。因为多糖的化学性质是很稳定的,香菇柄多糖如果是纯多糖,那么多糖的体外抗氧化活性随着时间延长不会降低,可是实验证明多糖的抗氧化活性随着时间延长而降低,可能是提取的香菇粉里面含有杂质,有可能是蛋白,蛋白的活性不稳定所以造成香菇柄多糖的活性不稳定。
本实验为香菇柄多糖的分离纯化、结构研究奠定了前期基础,同时为香菇柄多糖的抗氧化药理作用机制的深入研究提供了准确的实验依据。实验证明香菇柄多糖具有很好的抗氧化活性,可作为一种天然抗氧化剂。
参考文献:
[1]申进文,冯雅岚,庄庆利,等.香菇子实体多糖提取工艺优化研究[J].河南农业科学,2010,39(3):90-92.
[2]牛天增,刘娟,王永宏.香菇多糖提取技术的研究进展[J].食品研究与开发,2016,37(4):212-215.
[3]You R,Wang K,Liu J,et al.A comparison study between different molecular weight polysaccharides derived fromLentinusedodesand their antioxidant activities in vivo[J].Pharmaceutical Biology,2011,49(12):1298-1305.
[4]Bisen P S,Baghel R K,Sanodiya B S,et al.Lentinusedodes:a macrofungus with pharmacological activities[J].Current Medicinal Chemistry,2010,17(22):2419-2430.
[5]Xu X,Yan H,Tang J,et al.Polysaccharides inLentinusedodes:isolation,structure,immune modulating activity and future prospective[J].Critical Reviews in Food Science and Nutrition,2014,54(4):474-487.
[6]Chung W S,Wang J H,Bose S,et al.Hepatoprotective effect ofLentinusedodesmycelia fermented formulation against alcoholic liver injury in rats[J].Journal of Food Biochemistry,2015,39(3):251-262.
[7]Jiang T,Wang Q,Xu S,et al.Structure and composition changes in the cell wall in relation to texture of shiitake mushrooms (Lentinulaedodes) stored in modified atmosphere packaging[J].Journal of the Science of Food and Agriculture,2010,90(5):742-749.
[8]庞社霞,宋淑红.高压热水提取香菇柄中多糖工艺研究[J].农产品加工,2015(6):31-36.
[9]Motevali A,Minaei S,Khoshtaghaza M H,et al.Comparison of energy consumption and specific energy requirements of different methods for drying mushroom slices[J].Energy,2011,36(11):6433-6441.
[10]刘丽娜,王安建,李顺峰.香菇柄热风干燥特性及微粉性质研究[J].食品工业科技,2016,37(5):126-131.
[11]郑义,王卫东,李勇,等.高良姜多糖提取工艺优化及其抗氧化活性[J].食品科学,2014,35(2):126-131.
[12]姜琼,谢妤.苯酚-硫酸法测定多糖方法的改进[J].江苏农业科学,2013,41(12):316-318.
[13]李志霞,聂继云.响应面法对3,5-二硝基水杨酸比色法测定水果中还原糖含量条件的优化[J].分析测试学报,2016,35(10):1283-1288.
[14]初维,李兰兰,李岩,等.白鲜皮多糖的提取工艺及其抗氧化活性研究[J].中华中医药学刊,2017,35(7):1809-1812.
[15]Ye Chun-Lin,Hu Wei-Lian,Dai De-Hui.Extraction of polysaccharides and the antioxidant activity from the seeds ofPlantagoasiaticaL.[J].International Journal of Biological Macromolecules,2011,49:466-470.
[16]李乐,陈树俊,康俊杰,等.沙棘油复合蛋白多肽液抗氧化性研究[J].山西农业科学,2016,44(4):474-479.
[17]游丽君.泥鳅蛋白抗氧化肽的分离纯化及抗疲劳抗癌功效研究[D].广州:华南理工大学,2010.
[18]李盼,赵彬,罗孝平,等.几种果皮提取物的体外抗氧化与抗肿瘤活性比较[J].食品科技,2017,42(1):225-230.
[19]Han L,Suo Y,Yang Y,et al.Optimization,characterization,and biological activity of polysaccharides fromBerberisdasystachyaMaxim.[J].International Journal of Biological Macromolecules,2016,85:655-666.
[20]宋思圆,苏平,王丽娟,等.响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J].食品科学,2017,38(2):283-289.
[21]邹林武,赵谋明,游丽君.香菇多糖提取工艺的优化及其抗氧化活性研究[J].食品工业科技,2013,34(19):177-182.
[22]Zhang Y,Li S,Wang X,et al.Advances in lentinan:isolation,structure,chain conformation and bioactivities[J].Food Hydrocolloids,2011,25(2):196-206.
[23]吴丹.富硒香菇多糖和富硒平菇多糖体外抗氧化活性研究[J].安徽农业科学,2010,38(11):5841-5843,5856.

