乳腺导管原位癌和乳腺导管原位癌伴微浸润的分子分型差异性研究
李 爽,郎冠天,余科达,张 强
1.辽宁省肿瘤医院乳腺外科,辽宁 沈阳 110042;
2.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺导管原位癌(ductal carcinoma in situ,DCIS)被认为是乳腺浸润性癌的早期阶段,近10年来,钼靶筛查极大地提高了对此类疾病的早期检出率[1-2]。目前,在国内,DCIS占到新发乳腺癌的10%~15%[3-4]。美国抗癌联合会(American Joint Committee on Cancer,AJCC)将浸润灶范围小于等于1 mm的DCIS定义为乳腺导管原位癌伴微浸润(ductal carcinoma in situ with microinvasion,DCIS-MI)[5]。DCIS-MI占所有乳腺DCIS病例的5%~20%,占所有乳腺癌病例的1%左右[6-7]。DCIS-MI被认为是DCIS发展到浸润性乳腺癌(invasive breast cancer,IDC)的中间阶段。近年来,有研究证实,DCIS-MI具有侵袭性和转移性的潜能,是不同于DCIS的乳腺癌组分[7-10]。
近年来,基因芯片技术从基因表达水平上将乳腺癌分成不同的分子亚型,通过对数百个样本的分析将乳腺癌聚类为腔面A型、腔面B型、HER-2扩增型、基底样型和正常乳腺样型[11-13]。然而,对患者石蜡标本进行基因表达谱的大数据分析在现实中并不可行也不经济,所以,多数研究者以免疫组织化学标志物对乳腺癌进行分型,来代替大样本研究中得到的乳腺癌内部的分子分型。目前,免疫组织化学用于检测的分子标志物有雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)、人类表皮生长因子受体1(human epidermal growth factor receptor 1,HER-1)和细胞角蛋白5/6(cytokeratin 5/6,CK5/6)等[14]。这些标志物的4种组合可以对应到乳腺癌的4类分子分型:腔面A型[ER和(或)PR阳性,HER-2阴性,无论CK5/6和HER-1何状态]、腔面B型[ER和(或)PR阳性,HER-2阳性,无论CK5/6和HER-1何状态]、HER-2过表达型(ER和PR阴性,HER-2阳性,无论CK5/6和HER-1何状态)和基底样型(ER和PR阴性,HER-2阴性,CK5/6和HER-1阳性)。而其余免疫组织化学标志物均阴性的乳腺癌则统归于“未分类”型。尽管文献中对于将免疫组织化学表型和基因表达数据如何以更好的方式整合成一种精确的分类系统仍有争论,这种免疫组织化学的“替代”分型在很大程度上和基因表达的分子分型具有一致性而被普遍接受和认可。
乳腺癌的分型方法是从浸润性导管癌而非DCIS中分析得到的。极少数研究会关注到DCIS中的分子亚型,因此,本研究将分析DCIS和DCIS-MI这两类早期乳腺癌不同临床病理学特征和免疫组织化学分子表型间的差异。
1 资料和方法
1.1 研究对象
回顾性研究辽宁省肿瘤医院乳腺外科和复旦大学附属肿瘤医院乳腺外科的临床病例,病例收集时间为2007—2009年。所有乳腺癌患者在术前均有体格检查、胸片、双侧乳腺钼靶、心电图、血常规、血生化检测、乳房/腋窝淋巴结/腹部/盆腔及妇科超声。根据指南推荐,患者均在单纯切除术或保乳术后接受辅助治疗。肿瘤复发和患者生存状态等随访资料通过门诊随访和电话随访采集完成。本研究共纳入317例2007年1月—2009年12月在辽宁省肿瘤医院乳腺外科和复旦大学附属肿瘤医院乳腺外科接受治疗的乳腺DCIS患者。入组的患者符合以下筛选条件:① 女性;② 原发的单侧乳腺癌,无远处转移;③ 病理确诊为乳腺原位癌;④ 病理信息完整,且具有原位病灶免疫组织化学信息。
患者确诊乳腺癌时的中位年龄为52岁(22~85岁),中位随访时间为67个月(6~118个月)。其中,227例(71.6%)为纯DCIS患者,90例(28.4%)为DCIS-MI患者。组织病理和免疫组织化学结果经由每个中心的两名病理科医师确认,并根据AJCC第6版对DCIS和DCIS-MI的定义进行诊断[5]。研究中使用到的病理和免疫组织化学结果均来自于各中心病理数据库,而并未重新对病理切片进行复片。本研究经过辽宁省肿瘤医院和复旦大学附属肿瘤医院伦理委员会批准。
1.2 病理学定义
根据AJCC第6版标准,纯DCIS定义为乳腺实质内增殖的恶性上皮细胞但未突破基底膜[5]。DCIS-MI定义为有癌细胞突破基底膜但浸润灶最大直径不超过1 mm的DCIS。剔除任何微浸润表述不清的病例,如多灶浸润、灶性浸润、疑有浸润、广泛微小浸润及可疑微小浸润等。病理诊断为DCIS伴IDC的病例也从本研究中排除。
1.3 免疫组织化学评分
肿瘤ER、PR及HER-2状态通过免疫组织化学染色判定,经由各个中心病理科根据标准化流程完成。ER和PR表达以10%以上细胞核染色作为阳性标准;HER-2阳性判定标准参考2007年美国临床肿瘤学会与美国病理学家协会HER-2免疫组织化学评价指南[15]。由于HER-2状态在乳腺DCIS中的价值未知,因此很多HER-2++病例并未进一步进行荧光原位杂交(fluorescence in situ hybridization,FISH)检测。因此本研究剔除了HER-2++病例,仅保留免疫组织化学HER-2+和HER-2+++的病例,分别作为HER-2阴性和HER-2阳性。本研究根据ER、PR及HER-2状态将肿瘤分为腔面A型[ER和(或)PR阳性,HER-2阴性]、腔面B型[ER和(或)PR阳性,HER-2阳性]、HER-2过表达型(ER和PR阴性,HER-2阳性)和基底样型(ER和PR阴性,HER-2阴性)。因基底样型的标志物CK5/6和HER-1并不在辽宁省肿瘤医院和复旦大学附属肿瘤医院的常规检测范围,所以并未纳入此分级系统。但就免疫组织化学而言,在显微镜下通常需要有一定数量(比如至少100个)或数个不同区域(比如至少5个)的肿瘤细胞。对于微浸润的病例,由于很多病例浸润组织成分少,很难对病例进行免疫组织化学标志物的评估,因此微浸润的免疫组织化学标记缺失较多,该研究不特别要求微浸润的免疫组织化学标记结果。每个病例均由各个中心病理科两名病理学医师独立完成免疫组织化学染色结果的评分,对于判定结果不一致的病例,通过协商得出结论。
1.4 统计学处理
运用Pearson’s χ2进行相关性分析(必要时用Fisher精确检验)。用单因素方差分析两组及两组以上的连续变量。用K-M生存曲线分析术后无复发生存时间(relapse-free survival,RFS)并用Log-rank检验生存曲线间的差异性。RFS定义为活检或手术到首次复发(局部、区域或远位脏器)或对侧乳腺复发的时间。所有统计运算经由SPSS 17.0软件完成。P<0.05为差异有统计学意义。
2 结 果
317例DCIS患者的临床病理特征见表1。年龄对DCIS是否伴有微浸润成分并无影响。纯DCIS患者的肿瘤组织多小于1.5 cm,而DCIS-MI患者多分布在1.5~4.0 cm之间,后者的肿瘤大小倾向更大(P=0.059)。DCIS-MI患者相比纯DCIS患者具有更高的核分级(P=0.002)。本研究发现,纯DCIS相比DCIS-MI,ER阳性的比例更高,而PR的表达在两种病理类型间差异无统计学意义(P>0.05)。从免疫组织化学的分子表型上来看,在纯DCIS中,腔面A型占59.0%,腔面B型占14.1%,HER-2过表达型占16.3%,基底样型占10.6%;而在DCIS-MI中,腔面A型和HER-2过表达型的比例相对下降,腔面B型和基底样型的比例相对增高。HER-2阳性的肿瘤包含腔面B型和HER-2过表达型的肿瘤。DCIS-MI患者HER-2阳性的比例高于纯DCIS患者,但从分型上看,前者中HER-2过表达型的比例却低于后者。在DCIS-MI中,腔面B型占HER-2阳性肿瘤的主要部分(腔面B型和HER-2过表达型分别为26.7%和14.4%);而在纯DCIS中,HER-2过表达型则在HER-2阳性肿瘤中占据优势地位(腔面B型和HER-2过表达型分别为14.1%和16.3%)。
从生存分析的结果上看,纯DCIS患者的5年RFS为97.5%,DCIS-MI患者的5年RFS为92.0%,前者的生存预后趋向于更优,但差异无统计学意义(P=0.06,表2)。
单独分析各组内出现复发转移事件的病例发现,纯DCIS组有1例HER-2过表达型、2例基底样型在5年随访过程中出现复发转移,DCIS-MI组多为腔面型,有5例,其余HER-2过表达型和基底样型各1例。
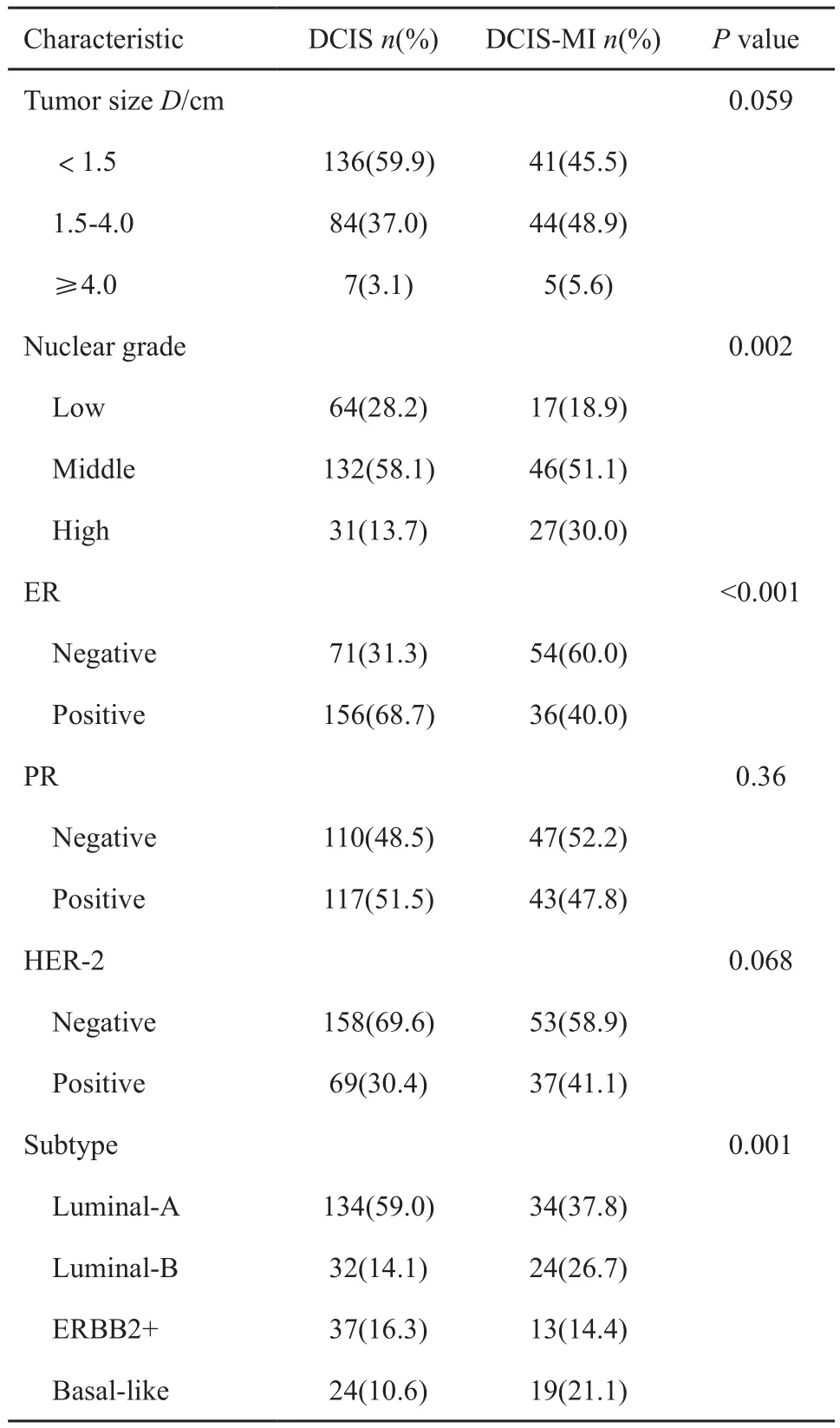
表1 DCIS患者的组间特征Tab.1 The subgroup characteristics of patients with DCIS

表2 纯DCIS患者和DCIS-MI患者的复发例数和生存预后比较Tab.2 Comparison of relapse events distribution and RFS outcomes between patients with DCIS and patients with DCIS-MI
3 讨 论
本研究在之前研究的基础上进一步分析了DCIS和DCIS-MI间的差异性[16]。研究重点关注DCIS和DCIS-MI中不同的分子分型的分布,并进一步分析两组间的生存预后。但由于病例数较少、随访时间较短,对于DCIS-MI患者的生存预后仍难给出最终结论。
与纯DCIS患者相比,DCIS-MI患者的肿瘤体积倾向更大,病理核分级更高。既往有研究对ER、PR及HER-2各自的表达状态进行分析得出,50%~75%的DCIS表达ER和(或)PR,ER和PR的高表达与低级别的DCIS相关[17]。在DCIS中,HER-2的表达也高于IDC,35%~65%的DCIS患者存在HER-2高表达[17-20],而仅有15%~30%的IDC患者高表达HER-2[21-24]。本研究结果显示,多数DCIS为ER阳性,而仅有不到50%的DCIS-MI患者表达ER,揭示了ER阴性的癌细胞在肿瘤向外周组织侵犯早期发挥着重要作用。同时,尽管HER-2在DCIS中的表达比IDC更高,纯DCIS组中HER-2的表达水平却低于DCIS-MI组。
但对于HER-2表达阳性的肿瘤而言,HER-2过表达型和腔面B型的比例有差异。在DCIS-MI中,腔面B型占HER-2阳性肿瘤的主要部分;而在纯DCIS中,HER-2过表达型则在HER-2阳性肿瘤中更为常见,这一结论有待后续更大样本量的研究进行考证。
最后,本研究对两组乳腺癌的生存预后进行了对比分析。目前,关于DCIS-MI的生存预后仍未有统一结论。部分研究认为,DCIS和DCIS-MI预后相似[25],而其他一些研究则得出了不一样的结论[7,26]。国外一项大宗的回顾性研究发现,DCIS-MI患者的生存预后和小于1 cm的浸润性小肿瘤非常接近[7]。本研究回顾了国内2个乳腺癌中心收治的DCIS和DCIS-MI患者,通过5年的随访数据分析可以看到,DCISMI趋向于具有较差的生存预后,当然样本量和随访时间的不足影响了研究结论的可靠性。此外,生存分析并未对治疗等因素进行多因素校正。后续仍期待有设计更好的前瞻性临床研究对DCIS的预后进行进一步分析。
本研究存在一定不足。本研究为单纯的观察性研究,但缺少对DCIS发展成为IDC的动态跟踪观察。临床上DCIS患者普遍接受手术治疗,因此很难观察到DCIS真实的自然发展进程。HER-2状态的判定并非完全严谨,对于HER-2++的患者并未用FISH做进一步检测。因为目前在DCIS中HER-2表达水平的地位仍不明确,对于此类乳腺癌的HER-2界值进行再判定并无必要。
综上所述,DCIS分子分型的分布和IDC具有差异性。分子分型分布不同,临床病理特征迥异,决定了DCIS和DCIS-MI是乳腺癌中不同的病理组分。最后,本研究的结论仍需后续更大样本量的研究进一步验证。
[1] DUFFY S W, DIBDEN A, MICHALOPOULOS D, et al. Screen detection of ductal carcinoma in situ and subsequent incidence of invasive interval breast cancers: a retrospective populationbased study [J]. Lancet Oncol, 2016, 17(1): 109-114.
[2] BLEYER A, WELCH H G. Effect of three decades of screening mammography on breast-cancer incidence [J]. N Engl J Med, 2012, 367(21): 1998-2005.
[3] FAN L, ZHENG Y, YU K D, et al. Breast cancer in a transitional society over 18 years: trends and present status in Shanghai,China [J]. Breast Cancer Res Treat, 2009, 117(2): 409-416.
[4] SI W, LI Y, HAN Y, et al. Epidemiological and clinicopathological trends of breast cancer in Chinese patients during 1993 to 2013: a retrospective study [J]. Medicine,2015, 94(26): e820.
[5] SINGLETARY S E, ALLRED C, ASHLEY P, et al. Revision of the American Joint Committee on Cancer staging system for breast cancer [J]. J Clin Oncol, 2002, 20(17): 3628-3636.
[6] BIANCHI S, VEZZOSI V. Microinvasive carcinoma of the breast[J]. Pathol Oncol Res, 2008, 14(2): 105-111.
[7] SOPIK V, SUN P, NAROD S A. Impact of microinvasion on breast cancer mortality in women with ductal carcinoma in situ[J]. Breast Cancer Res Treat, 2018, 167(3): 787-795.
[8] OKUMURA Y, YAMAMOTO Y, ZHANG Z, et al. Identification of biomarkers in ductal carcinoma in situ of the breast with microinvasion [J]. BMC cancer, 2008, 8: 287.
[9] VIEIRA C C, MERCADO C L, CANGIARELLA J F, et al.Microinvasive ductal carcinoma in situ: clinical presentation,imaging features, pathologic findings, and outcome [J]. Eur J Radiol, 2010, 73(1): 102-107.
[10] FANG Y, WU J, WANG W, et al. Biologic behavior and long-term outcomes of breast ductal carcinoma in situ with microinvasion [J]. Oncotarget, 2016, 7(39): 64182-64190.
[11] SOTIRIOU C, PUSZTAI L. Gene-expression signatures in breast cancer [J]. N Engl J Med, 2009, 360(8): 790-800.
[12] CIANFROCCA M, GRADISHAR W. New molecular classifications of breast cancer [J]. CA Cancer J Clin, 2009,59(5): 303-313.
[13] Comprehensive molecular portraits of human breast tumours[J]. Nature, 2012, 490(7418): 61-70.
[14] CAREY L A, PEROU C M, LIVASY C A, et al. Race, breast cancer subtypes, and survival in the carolina breast cancer study[J]. Jama, 2006, 295(21): 2492-2502.
[15] WOLFF A C, HAMMOND M E, SCHWARTZ J N, et al.American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer [J]. Arch Path Lab Med, 2007, 131(1): 18-43.
[16] YU K D, WU L M, LIU G Y, et al. Different distribution of breast cancer subtypes in breast ductal carcinoma in situ (DCIS),DCIS with microinvasion, and DCIS with invasion component[J]. Ann Surg Oncol, 2011, 18(5): 1342-1348.
[17] MARDEKIAN S K, BOMBONATI A, PALAZZO J P. Ductal carcinoma in situ of the breast: the importance of morphologic and molecular interactions [J]. Hum Pathol, 2016, 49: 114-123.
[18] CARRARO D M, ELIAS E V, ANDRADE V P. Ductal carcinoma in situ of the breast: morphological and molecular features implicated in progression [J]. Biosci Rep, 2014,34(1): e00090.
[19] PRUNERI G, LAZZERONI M, BAGNARDI V, et al. The prevalence and clinical relevance of tumor-infiltrating lymphocytes (TILs) in ductal carcinoma in situ of the breast[J]. Ann Oncol, 2017, 28(2): 321-328.
[20] LAMBEIN K, VAN BOCKSTAL M, VANDEMAELE L, et al.Comparison of HER2 amplification status among breast cancer subgroups offers new insights in pathways of breast cancer progression [J]. Virchows Arch, 2017, 471(5): 575-587.
[21] SERRANO-GÓMEZ S J, FEJERMAN L, ZABALETA J. Breast cancer in Latinas: a focus on intrinsic subtypes distribution[J]. Cancer Epidemiol Biomarkers Prev, 2018, 27(1): 3-10.
[22] ZUO T, ZENG H, LI H, et al. The influence of stage at diagnosis and molecular subtype on breast cancer patient survival: a hospital-based multi-center study [J]. Chin J Cancer, 2017,36(1): 84.
[23] LEE S B, SOHN G, KIM J, et al. A retrospective prognostic evaluation analysis using the 8th edition of the American Joint Committee on Cancer staging system for breast cancer [J].Breast Cancer Res Treat, 2018. [Epub ahead of print]
[24] LIAN W, FU F, LIN Y, et al. The impact of young age for prognosis by subtype in women with early breast cancer [J].Sci Rep, 2017, 7(1): 11625.
[25] WANG L, ZHANG W, LYU S, et al. Clinicopathologic characteristics and molecular subtypes of microinvasive carcinoma of the breast [J]. Tumour Biol, 2015, 36(4): 2241-2248.
[26] FANG Y, WU J, WANG W, et al. Biologic behavior and long-term outcomes of breast ductal carcinoma in situ with microinvasion [J]. Oncotarget, 2016, 7(39): 64182-64190.

