膨大剂处理对猕猴桃多酚含量及抗氧化活性的影响
邵佩,张昭,王琳,彭帮柱,冯武
(华中农业大学食品科学技术学院,湖北武汉 430070)
自由基在生命系统中天然存在,自由基是一种非常不稳定的物质,它能迅速破坏机体内的蛋白质、脂类、DNA和RNA等生物大分子的反应[1]。已有研究表明,自由基可以被多酚类化合物清除,是因为提供了氢离子或螯合金属离子抑制了氧化作用发生[2,3]。
猕猴桃果实汁多、肉厚,味道清香鲜美,营养丰富,含有糖、蛋白质、多酚类化合物、矿物质、氨基酸和维生素等多种营养物质,被誉为“水果之王”。并因其丰富的植物营养成分以及强的抗氧化能力被认为是极具保健价值的水果[4]。猕猴桃富含许多生物活性分子,近年来已有研究表明猕猴桃多酚具有抗氧化[5]、抑菌[6]、抗癌[7,8]、预防糖尿病[9]、抗过敏性皮炎[10]和提高免疫力[11]等作用。对野生软枣猕猴桃的总还原能力和DPPH自由基抗氧化活性研究结果表明野生软枣猕猴桃具有抗氧化、清除自由基的功效[12]。Park等[13]人也研究了“Hayward”、“Daeheung”、“Haenam”和“Bidan”四个品种猕猴桃的抗氧化活性,研究铜离子还原力(CUPRAC)和亚铁还原力实验(FRAP)显示四个品种猕猴桃对 Cu2+和 Fe3+具有较强的还原能力,对ABTS阳离子、DPPH自由基具有很好的清除能力。Fiorentino等[14]也评价了猕猴桃中植物化学物质的抗氧化能力,结果表明它们具有很好的清除 DPPH、过氧化氢、超氧自由基的能力,以及很好的还原能力。
目前学者研究膨大剂处理对猕猴桃营养成分、活性物质以及贮藏特性,关于膨大剂处理对猕猴桃多酚抗氧化活性研究未见报道。因此,本实验以总酚含量、总还原能力、羟基自由基、ABTS自由基、超氧自由基清除能力为考察指标。研究不同膨大剂处理以及不同膨大剂残留量对猕猴桃中多酚物质和抗氧化活性的影响,以期为生产高质量的猕猴桃提理论依据。
1 材料与方法
1.1 材料与仪器
95%乙醇、福林酚、抗坏血酸、碳酸钠、磷酸二氢钠、磷酸氢二钠、铁氰化钾、冰乙酸、三氯化铁、30%双氧水、硫酸亚铁、水杨酸、盐酸、邻苯三酚、过硫酸钾等试剂均为国产分析纯,没食子酸、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),上海源叶生物科技有限公司;Tris,美国Dow AUGUS公司;氯吡脲(CPPU)、噻苯隆(TDZ),上海源叶生物公司。
榨汁机,飞利浦公司;KQ2200DE型超声波清洗机,昆山市超声仪器有限公司;AF103制冰机,意大利Scotsman公司;IG20-WS台式离心机,长沙湘智离心机有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;BTP-8ZL00X冻干机,美国 SP公司;UV-1750型紫外-可见分光光度计,日本岛津公司;恒温水浴锅,天津市泰斯特仪器有限公司。
1.2 方法
1.2.1 样品处理
对照和膨大剂处理徐香猕猴桃为陕西眉县栽培(处理方式:在果实达到幼果细胞分裂期,即谢花后20 d,分别用10 mg/L药液和80 mg/L药液浸渍幼果,记为高浓度和低浓度,并按照膨大剂的处理量和膨大剂种类分别记为:CK(对照,不经过膨大处理)、CPPU-H、CPPU-L、TDZ-H、TDZ-L)。猕猴桃采摘运达实验室后,挑选出成熟度一致、大小均匀、无病虫害及机械损伤的完整果实,将其洗净、沥干、去皮切块,并于-20 ℃冰箱冻藏,备用。
1.2.2 猕猴桃多酚的提取
分别取膨大剂处理和对照组猕猴桃榨汁,取猕猴桃浆10 g,按照1:10的料液比加入70%乙醇溶液,于35 ℃,100 kW的超声波清洗机中超声30 min。然后置于8000 r/min离心机中离心10 min。重复离心三次并收集上清液,将其于45 ℃旋转蒸发仪中旋蒸至一定的体积后,置于-20 ℃冷冻12 h,冷冻干燥后备用。
1.2.3 猕猴桃多酚含量的测定
参照[5]福林-酚比色法,测量多酚冻干粉中的多酚含量。以没食子酸的质量浓度(mg/L)为横坐标,以吸光值为纵坐标绘制标准曲线。标准曲线方程为:

结果以没食子酸当量(mgGAE/g表示)。
将膨大处理和对照的猕猴桃多酚冻干粉配制成浓度为5 mg/mL。吸取1.0 mL各猕猴桃多酚样液,加入蒸馏水定容至2.0 mL,然后加入1.0 mL的福林酚溶液反应5 min。最后加入1.0 mL 10%的碳酸钠溶液后避光于25 ℃反应2 h。于765 nm波长处测量吸光度值,并使用标准曲线计算猕猴桃中多酚含量。换算公式如下:

式中:W-总酚的含量(mg/g);C-没食子酸质量浓度(mg/L);V-提取液体积(mL);N-稀释倍数;M-猕猴桃多酚样品的取样量(g)。
1.2.4 总还原能力的测定
参照 E.Tsantili[15]采用铁氰化钾还原显色法稍作修改测定总还原能力。取1.0 mL不同浓度的膨大处理和对照组猕猴桃多酚样液,加入0.2 mol/L的磷酸盐缓冲液(pH 6.6) 0.6 mL,然后加入1%的铁氰化钾溶液1.5 mL混匀后,置于50 ℃恒温水浴锅水浴20 min。
取出冷却至室温后加入10%冰醋酸溶液3.0 mL,于8000 r/min离心10 min。取上清液3.0 mL,加入5.0 mL的蒸馏水和1%的三氯化铁溶液0.2 mL,混匀后反应5 min,在517 nm处测量吸光值,实验3次平行取平均值。以相同体积的蒸馏水代替铁氰化钾来扣除其颜色,抗坏血酸为阳性对照来评价多酚的总还原能力。猕猴桃多酚样品的吸光度按如下公式计算:

式中:A-某浓度猕猴桃多酚样液的最终吸光度值;A1-不同种植方式的某浓度猕猴桃多酚的吸光度值。
1.2.5 ·OH清除能力的测定
参考文献[16,17]稍作修改,加入 1.0 mL浓度为 9 mmol/L的FeSO4溶液,1.0 mL浓度为8.8 mmol/L的H2O2溶液,1.0 mL浓度为 9 mmol/L的水杨酸溶液(50%乙醇配成)以及1.0 mL不同浓度的膨大处理和对照组的猕猴桃多酚。
最后加入1.0 mL H2O2启动反应后置于37 ℃水浴锅中水浴1 h。用同体积蒸馏水代替样品液作空白组,用同体积的蒸馏水代替水杨酸溶液做对照,在510 nm波长处测量吸光度值。以抗坏血酸作阳性对照,猕猴桃多酚和抗坏血酸的羟基自由基清除率按以下公式计算:
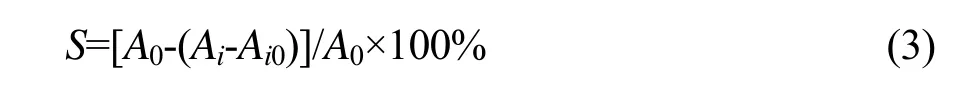
式中:A0-猕猴桃多酚样液用相同体积的蒸馏水代替测得的吸光度值;Ai-某浓度时猕猴桃多酚样品测得的吸光度值;Ai0-水杨酸醇溶液用等体积的蒸馏水代替测得的吸光度值;S-羟基自由基清除率,%。
1.2.6 ABTS+·清除能力的测定
参考L.Alvarez-Jubete[18,19]的方法作出修改。ABTS工作液的配制:将 7 mmol/L的 ABTS溶液和 2.45 mmol/L的过硫酸钾溶液1:1比例混匀,于室温下避光过夜放置 12~16 h,用蒸馏水对其稀释,使其吸光度值为0.70±0.02,所得为ABTS工作液。分别取不同浓度的膨大处理和对照组的猕猴桃多酚样液200 μL,然后加入3.0 mL的ABTS工作液。室温条件下避光反应1 h,用同等体积的蒸馏水代替ABTS溶液作对照,然后在734 nm波长处测量吸光度值。以相同浓度的抗坏血酸作为阳性对照,猕猴桃多酚样品和抗坏血酸的ABTS自由基清除率用如下公式计算:
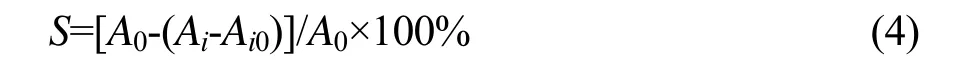
式中:A0-猕猴桃多酚样液用相同体积的蒸馏水代替测得的吸光度值;Ai-某浓度时猕猴桃多酚样液测得的吸光度值;Ai0-ABTS溶液用等体积的蒸馏水代替测得的吸光度值。S-ABTS自由基清除率,%。
1.2.7 超氧自由基清除能力的测定
参考文献[20,21]分稍作修改。分别取不同浓度的膨大处理组和对照组的猕猴桃多酚样液200 μL,然后加入 5.7 mL浓度为 50 mmol/L的 Tris-HCl缓冲液(pH=8.2)。
室温下混匀后加入0.1 mL浓度为6 mmol/L的邻苯三酚溶液后开始计时5 min,每隔30 s记录吸光度值。以相同浓度的抗坏血酸作为阳性对照,以同体积的蒸馏水做空白组,在320 nm波长处测量吸光度值。猕猴桃多酚和抗坏血酸的超氧自由基清除率按如下公式计算:

式中:∆A1/∆t-以蒸馏水代替猕猴桃多酚样液,邻苯三酚的自氧化时反应速率;∆A2/∆t-加入不同浓度猕猴桃多酚样液后邻苯三酚自氧化反应速率;I-超氧阴离子抑制率(%)。
1.2.8 不同膨大剂残留量对多酚含量的影响
通过前面的研究,筛选出对猕猴桃多酚含量和抗氧化活性影响较大的膨大剂种类,研究不同膨大剂残留量对猕猴桃总酚含量和抗氧化活性的影响。膨大剂允许残留量数值参考《食品中农药最大残留量》(GB 2763-2012)[22]对膨大剂TDZ和CPPU残留量的标准:

表1 水果中膨大剂允许残留量Table 1 The swelling agent in fruit allows for residual amount
从表中可以看出,国标中限定了CPPU在猕猴桃中的残留量,但并未限定TDZ在猕猴桃中的残留量,则参考其他水果中TDZ最大允许残留量。李瑞娟等[23]研究表明,0.1%氯吡脲药后30 d,在猕猴桃中的残留量未超过0.04 mg/kg。柴振林等[24]研究表明用药36 d后使用浓度为20、50、100 mg/L的样品中氯吡脲测定含量0.02 mg/kg左右,小于国家标准。本实验材料中膨大剂CPPU和TDZ的残留量均小于0.05 mg/kg,符合国家标准的规定,但是膨大剂残留量对多酚抗氧化活性的影响未见报道。因此,以国标中膨大剂在果实中的允许残留量为参考,向未膨大剂处理的果实中添加膨大剂,通过添加量保证其残留量为 0.01~0.05 mg/kg,研究不同残留量对猕猴桃多酚含量的影响,方法参考1.2.3。
1.2.9 不同膨大剂残留量对多酚抗氧化活性的影响
包括总还原能力、羟基自由基、ABTS自由基、超氧自由基清除能力的测定。方法参考1.2.4~1.2.7。
1.3 数据分析
采用 EXCEL 2010处理数据和统计分析,采用Origin 8.0进行绘图。实验数据均重复3次,以平均值±标准偏差表示,以p<0.05表示有显著差异具有统计意义。
2 结果与分析
2.1 膨大处理对猕猴桃多酚含量的影响
本实验采用一定浓度的各猕猴桃多酚样液测定总多酚含量,不同膨大处理对猕猴桃多酚含量影响结果如表2。
从表2中可以看出,对照CK的总酚含量最高,为3.26±0.14 mg/g,膨大剂TDZ和CPPU处理都能降低猕猴桃的总酚含量,TDZ膨大处理的总酚含量最低,TDZ-H和TDZ-L的总酚含量分别为2.64±0.25和2.16±0.01 mg/g。其中CPPU-H和CPPU-L的总酚含量无显著性差异(p<0.05),TDZ-H和TDZ-L的总酚含量无显著性差异(p<0.05)。综上所述,膨大剂 TDZ和CPPU处理降低猕猴桃多酚含量,且TDZ处理对总酚的影响程度显著大于CPPU处理,这可能是因为膨大剂处理后影响果实生长发育过程中内源激素的变化和抗氧化系统组成的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,并增大果粒和果重使膨大剂处理组的总酚含量低于对照组。本研究结果比李琛等[25]研究结果所得的猕猴桃总酚含量高,这可能与研究的种植条件和地区,原料的预处理方法等不同而存在差异。

表2 不同膨大处理的猕猴桃总酚含量Table 2 The total polyphenols content of Kiwifruit by different swelling agent treatments
2.2 膨大处理对猕猴桃多酚体外抗氧化能力研究
研究表明猕猴桃多酚有抗氧化能力,但关于膨大处理对猕猴桃多酚抗氧化活性的影响研究还未见报道。因此本实验以总还原能力、羟基自由基清除率、ABTS自由基清除率、超氧自由基清除率为参考指标对高、低浓度膨大剂TDZ和CPPU处理猕猴桃多酚的抗氧化活性进行对比分析。
2.2.1 总还原能力的测定
猕猴桃多酚总还原能力的测定可以作为抗氧化活性的重要指标,抗氧化剂通过给自由基提供电子,将三价铁还原为二价铁。高的吸光值表示猕猴桃多酚具有很高的总还原能力。本实验以Vc作阳性对照,综合测定并比较了不同膨大剂处理对猕猴桃多酚总还原能力的影响,结果如图1。
从图1中可以看出,不同膨大处理组和对照组猕猴桃多酚与Vc一样与浓度之间均呈现一定的量效关系。在多酚浓度20~100 mg/mL范围内,随着浓度升高,多酚的总还原能力显著增加,但其总还原能力均低于Vc。在猕猴桃多酚浓度为100 mg/mL时,猕猴桃多酚的总还原能力最强,对照组CK吸光值达0.52左右,CPPU-H、CPPU-L、TDZ-L、TDZ-H的吸光度分别为0.48、0.46、0.43、0.39。综上所述,表明猕猴桃多酚总还原能力大小顺序为CK>CPPU-H>CPPU-L>TDZ-L>TDZ-H。在多酚浓度较高时(60~100 mg/mL),膨大剂TDZ和CPPU处理降低猕猴桃多酚的总还原能力,并且膨大剂TDZ处理的总还原能力显著低于CPPU处理组(p<0.05)。刘金串等[26]研究膨大处理可使维多利亚葡萄多酚的铁氰化钾还原力减弱,与本实验结果相似。
左线隧道掘进后,1#承台向左线隧道方向发生少量的位移,右侧隧道开挖时1#承台X向的位移方向与左侧隧道开挖时相反,在隧道开挖结束时,1#承台的1号、2号角点最大位移约只有0.09 mm,3号、4号角点X向最大位移只有0.08 mm。2#承台的1号、2号角点X向最大位移约为-0.84 mm,3号、4号角点X向最大位移约为-0.79 mm。

图1 不同膨大剂处理对猕猴桃多酚总还原能力的影响Fig.1 Effects of different swelling agent treatments on the total reducing capacity of Kiwifruit polyphenol
2.2.2 ·OH自由基清除能力的测定
·OH自由基是一种重要的活性氧,具有极强的得电子能力即氧化能力。抗氧化剂具有很强的清除羟基自由基的能力,从而抑制氧化反应的产生。本文通过测定不同膨大剂处理对猕猴桃多酚·OH自由基清除能力,并对其抗氧化活性进行比较分析,结果见图2。

图2 不同膨大处理对猕猴桃多酚·OH清除能力的影响Fig.2 Effects of different swelling agent treatments on the hydroxyl radical scavenging capacity of Kiwifruit polyphenol
猕猴桃多酚对羟基自由基的清除率如图2所示,在多酚浓度5~10 mg/mL之间,随着浓度的升高,猕猴桃多酚对羟基自由基的清除率逐渐增大;在多酚浓度为15~25 mg/mL之间,多酚对羟基自由基的清除率变化较小,但其均低于同浓度下Vc羟基自由基清除率。当猕猴桃多酚浓度为25 mg/mL时,CK的对羟基自由基清除率为95.28%,CPPU-H、CPPU-L、TDZ-H、TDZ-L对羟基自由基清除率分别为94.06%、92.77%、87.97%、81.91%。则各猕猴桃多酚清除羟基自由基能力大小为 CK>CPPU-H>CPPU-L>TDZ-H>TDZ-L,随着多酚浓度升高膨大剂CPPU和TDZ处理显著降低清除羟基自由基能力(p<0.05)。综上所述,与对照CK相比,进一步说明膨大剂 TDZ处理显著降低猕猴桃多酚·OH清除能力,影响多酚的抗氧化活性。
2.2.3 ABTS+·自由基清除能力的测定
多酚类化合物对ABTS自由基的清除能力受到结构中存在的官能团的影响[27]。不同膨大处理对猕猴桃多酚ABTS+·自由基清除能力的测定结果如图3。

图3 不同膨大剂处理对多酚ABTS+·清除能力的影响Fig.3 Effects of different swelling agent treatment on the ABTS+·scavenging capacity of Kiwifruit polyphenol
从图 3可以看出,在一定浓度范围内,多酚ABTS+·清除能力存在量效关系。在多酚浓度 2~12 mg/mL,随着浓度升高,多酚ABTS+·清除能力增大。在浓度大于16 mg/mL时,各猕猴桃多酚达到最大值,与 Vc的 ABTS+·清除能力无显著性差异(p>0.05)。在浓度为20 mg/mL时,对照CK的ABTS+·清除能力为100%,CPPU-H、CPPU-L、TDZ-H、TDZ-L的清除率也为100%左右,与对照无显著性差异(p>0.05),即随着多酚浓度升高膨大剂TDZ和CPPU处理对猕猴桃多酚 ABTS+·清除能力的影响不大。由此可见,猕猴桃多酚清除ABTS自由基的能力最强,能够有效的清除自由基[28],且膨大处理对其影响不大。
2.2.4 超氧自由基(O·)清除能力的测定
在本实验中采取邻苯三酚自氧化法测定猕猴桃多酚对超氧自由基清除能力。不同膨大剂处理对超氧自由基清除能力的结果如图4。

图4 不同膨大剂处理对多酚超氧自由基清除能力的影响Fig.4 Effects of different swelling agent treatment on the hyperoxygen radical scavenging capacity of Kiwifruitpolyphenol
2.3 不同TDZ残留量对猕猴桃多酚含量影响
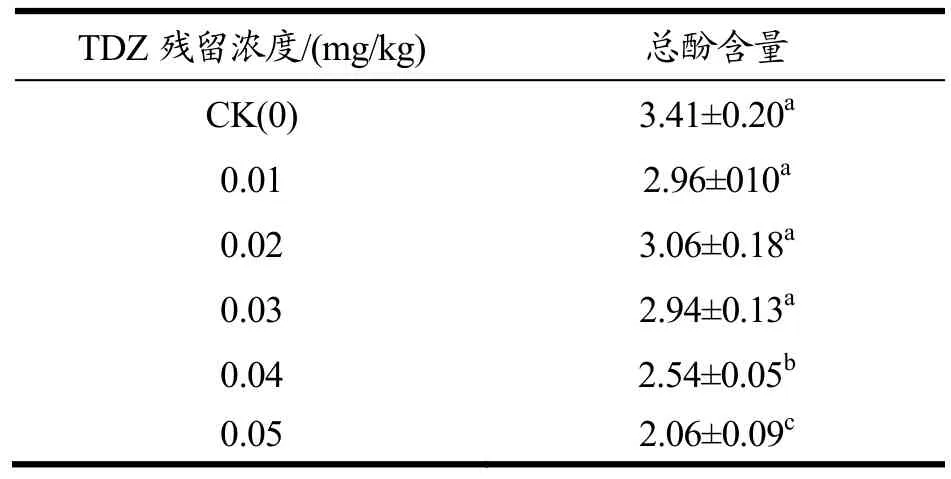
表3 不同TDZ添加量对猕猴桃总酚含量的影响Table 3 Effects of different the amounts of TDZ addedon the total phenol content of Kiwifruit
根据前面的实验,膨大剂TDZ处理对猕猴桃总多酚含量的影响较大,由于国标中未规定猕猴桃中TDZ的允许残留量,因此本实验参考其他水果中TDZ最低允许残留量,研究不同膨大剂添加浓度(0.01~0.05 mg/kg)对猕猴桃总酚含量的影响,作为允许残留量的参考值。结果如下表3。
不同 TDZ残留量的猕猴桃总酚含量存在显著性的差异。对照CK的总酚含量最高3.41±0.20 mg/g,TDZ残留量为0.05 mg/kg时总酚含量最低2.06±0.09 mg/kg。结果表明猕猴桃中TDZ浓度越高,猕猴桃多酚的总酚含量越低,并且TDZ浓度大于0.04 mg/kg时,即与对照CK相比有显著性差异(p<0.05)。综上所述,膨大处理TDZ添加量高时显著降低猕猴桃总酚含量。
2.4 不同 TDZ残留量对猕猴桃多酚抗氧化活性的影响

图5 不同浓度TDZ对猕猴桃多酚总还原能力的影响Fig.5 Effects of different concentration of TDZ on the total reducing capacity of Kiwifruit polyphenol

图6 不同浓度TDZ对猕猴桃多酚·OH清除能力的影响Fig.6 Effects of different concentration of TDZ on the hydroxyl radical scavenging capacity of Kiwifruit polyphenol
由图5可知,多酚浓度在20~100 mg/mL范围内,不同 TDZ残留量猕猴桃多酚的总还原能力随着残留浓度的增加而增加。在多酚浓度为100 mg/mL时,各猕猴桃多酚的总还原能力达到最大值。此时,对照组CK的总还原能力为0.51,对应0.01~0.05 mg/kg TDZ残留量组的总还原能力分别为0.47、0.43、0.42、0.42、0.41。当TDZ残留量大于0.01 mg/kg时,与对照组相比处理组有显著性差异(p<0.05)。说明TDZ残留量大于0.01 mg/kg,即降低猕猴桃多酚的总还原能力。
由图6可知,多酚浓度在5~25 mg/mL范围内,不同 TDZ残留量各猕猴桃多酚清除羟基自由基能力随着多酚浓度的增加而增加。在浓度为25 mg/mL时,各猕猴桃多酚清除羟基自由基能力达到最大值。与对照CK、TDZ添加量0.01~0.05 mg/kg对羟基自由基的清除率分别为:92.61%、92.26%、91.24%、85.90%、87.85%、80.40%。当TDZ残留浓度大于0.02 mg/kg时,与CK相比有显著性差异(p<0.05)。表明TDZ残留量大于0.02 mg/kg即可显著降低猕猴桃多酚清除羟基自由基能力。

图7 不同浓度TDZ对猕猴桃多酚ABTS+·清除能力的影响Fig.7 Effects of different concentration TDZ on the ABTS+· scavenging capacity of Kiwifruit polyphenol

图8 不同浓度TDZ对多酚超氧自由基清除能力的影响Fig.8 Effects of different concentration of TDZ on the hyperoxygen radical scavenging capacity of Kiwifruit polyphenol
由图 7可知,随着多酚浓度从 2 mg/mL到 20 mg/mL范围内,ABTS自由基清除能力与浓度存在量效关系,在浓度为20 mg/mL时,对照CK对ABTS自由的清除率为 100%左右,浓度 0.01~0.03 mg/kg TDZ处理对ABTS自由基的清除率也为100%左右,TDZ浓度0.04 mg/kg和0.05 mg/kg对应的ABTS自由基清除率为91.73%和93.88%,与对照CK相比有显著性差异(p<0.05)。说明TDZ残留量大于0.03 mg/kg即可影响猕猴桃多酚对ABTS自由基的清除率。
由图8可知,在浓度20~100 mg/mL范围内,对超氧自由基清除能力随着多酚浓度增大而增大,在浓度为 100 mg/mL时,CK对超氧自由基清除率为90.70%。与对照CK对超氧自由基的清除率相比,TDZ浓度大于0.04 mg/kg时才显著降低猕猴桃多酚对超氧自由基的清除能力。综上所述,总体TDZ浓度对猕猴桃多酚的超氧自由基清除率影响不大。
3 结论
3.1 膨大剂是植物生长调节剂,又叫外源激素。具有生物活性,调节生长发育,与内源生长调节物质和代谢紧密相连,是一种依据细胞结构人工合成的物质。猕猴桃中膨大剂的主要成分为氯吡脲(CPPU),是苯基脲类衍生物,促进细胞分裂、分化和扩大,促进器官形成。近年来,苯基脲类衍生物噻苯隆(TDZ)也作为猕猴桃的膨大剂。膨大剂在水果中应用的研究多集中在对葡萄研究方面,目前已有研究膨大剂对葡萄果实产量、品质、果实大小、化学成分以及抗氧化性的影响。董秋洪等[29]研究了CPPU(苯甲脲类细胞分裂素)、赤霉素(GA)、对氯苯氧乙酸(PCPA)等膨大剂的混合使用可以促进果实的膨大,但会降低果实品质。郭正兵等[30]选取3种类型的膨大剂分别应用于巨峰系列3个品种的栽培过程中,结果表明每种膨大剂均改善了 3种葡萄品种的产量和品质,但存在较大的差异。张艳宜等[31]以陕西主产的“秦美”猕猴桃为试材,进行采前膨大剂(CPPU),采后 1-甲基环丙烯(1-MCP)处理和膨大剂+1-甲基环丙烯(CPPU+1-MCP)处理果实评价货架期感官品质,发现两者对猕猴桃果实感官品质有一定的影响,改变了猕猴桃的风味。
3.2 近年来,有很多对膨大处理后对果实的影响相关研究,而关于膨大剂在猕猴桃中的应用方面主要研究其对猕猴桃货架期感官品质、外观、化学成分的影响,对抗氧化活性研究较少。刘金串等[32以红地球鲜食葡萄品种为试材,对其葡萄进行膨大处理,测定基本的理化指标和抗氧化活性,发现膨大处理可增加红地球葡萄酚类物质含量并增强铜离子还原能力、铁氰化钾还原力,但对金属螯合力、羟自由基清除能力影响较小,并且不同的葡萄膨大处理对其影响效果不同。本研究表明猕猴桃多酚有较好的抗氧化活性,膨大处理对猕猴桃多酚和抗氧化活性有一定的影响。总体来看,不同膨大处理可降低猕猴桃多酚含量和抗氧化活性。膨大剂TDZ处理影响大于CPPU处理,且对总酚含量、总还原能力、羟基自由基清除率、超氧自由基清除率影响比较大(总体差异显著),而对ABTS自由基清除率影响较小(总体差异不显著)。对不同TDZ残留浓度的研究结果表明:TDZ残留量大于0.04 mg/kg即可显著降低猕猴桃总酚含量,TDZ残留量对总还原能力和羟基自由基清除率的影响较大,对超氧自由基清除率和ABTS自由基清除率的影响较小。
3.3 因此,随着人们安全意识的提高,在实际生产中应全面考虑膨大处理对猕猴桃品质的影响,让膨大剂的使用更加合理科学,才能在确保食品安全的前提下更有针对性地指导猕猴桃生产中果实处理技术改善。
[1]Mantle D, Eddeb F, Pickering A T. Comparison of relative antioxidant activities of British medicinal plant speciesin vitro[J].Journal of Ethnopharmacology, 2000, 72(1): 47-51
[2]Gulcin I, EliAs R, GepdiRemen A, et al. Antioxidant secoiridoids from fringe tree (Chionanthus virginicusL.) [J].Wood Science & Technology, 2009, 43(3-4): 195
[3]Viudamartos M, Ruiz Navajas Y, Sánchez Zapata E, et al.Antioxidant activity of essential oils of five spice plants widely used in a Mediterranean diet [J]. Flavour & Fragrance Journal, 2010, 25(1): 13-19
[4]Kaya A, Aydin O, Kolayli S. Effect of different drying conditions on the vitamin C (ascorbic acid) content of Hayward kiwifruits (Actinidia deliciosa Planch).[J]. Food &Bioproducts Processing, 2010, 88(2): 165-173
[5]左丽丽.狗枣猕猴桃多酚的抗氧化与抗肿瘤效应研究[D].哈尔滨:哈尔滨工业大学食品科学与工程学院,2013 ZUO Li-li. Characterization of antioxidant and anti-tumor ofActinidia kolomiktapolyphenol [D]. Harbin: College of Food Science and Engineering of Harbin Institute of Technology,2013
[6]王菲.软枣猕猴桃黄酮类化合物的提取纯化及生物活性研究[D].沈阳:沈阳农业大学食品学院,2011 WANG Fei. Extraction and Purification and Biological Activities of Flavonoids from fruit ofActinidia auguta[D].Shenyang: College of Food of Shenyang Agricultural University, 2011
[7]彭吕杨.七种水果提取物抗氧化和抑制肿瘤活性研究.[D].天津:天津大学化学工程学院,2014 PENG Lv-yang. Investigation on antioxidant and anti-tumor capacity of seven fruit extracts. [D]. Tianjin: College of Chemical Engineering of Tianjin University, 2014
[8]Gorinstein S, Haruenkit R, Poovarodom S, et al. The comparative characteristics of snake and kiwi fruits[J]. Food and Chemical Toxicology, 2009, 47(8): 1884-1891
[9]Abe D, Saito T, Kubo Y, et al. A fraction of unripe kiwi fruit extract regulates adipocyte differentiation and function in 3T3-L1 Cells [J].Biofactors, 2010, 36(1): 52-59
[10]Kim J Y, Lee I K, Son M W, et al. Effects of orally administered actinidia arguta (Hardy Kiwi) fruit extract on 2-chloro-1,3,5-trinitrobenzene-induced atopic dermatitis- like skin lesions in NC/Nga mice [J]. Journal of Medicinal Food,2009, 12(5): 1004-1015
[11]Iwasawa H, Morita E, Ueda H, et al. Influence of kiwi fruit on immunity and its anti-oxidant effects in mice [J]. Food Science and Technology Research, 2010, 16(2): 135-142
[12]周丽萍,王化,李梦莎,等.野生软枣猕猴桃的多酚含量及抗氧化能力研究[J].黑龙江科学,2016,7(12):14-15 ZHOU Li-ping, WANG Hua, LI Meng-sha, et al. Research on the polyphenol content and the antioxidant capacity of wildActinidia arguta[J]. Heilongjiang Science, 2016, 7(12):14-15
[13]Park Y S, Leontowicz H, Leontowicz M, et al. Comparison of the contents of bioactive compounds and the level of antioxidant activity in different kiwifruit cultivars [J]. Journal of Food Composition & Analysis, 2011, 24(7): 963-970
[14]Fiorentino A, D'Abrosca B, Pacifico S, et al. Identification and assessment of antioxidant capacity of phytochemicals from Kiwi Fruits[J]. Journal of Agricultural and Food Chemistry, 2009, 57(10): 4148-4155
[15]Tsantili E, Konstantinidis K, Christopoulos M, et al. Total phenolics and flaconoids and tatal antionxidant capacity in pistachio(Pistachis veraL.)nuts in relation to cultivars and storage condition [J]. Scientia Horticulturae, 2011, 129(4):694-701
[16]Ismail H I, Chan K W, Mariod A A, et al. Phenolic content and antioxidant activity of cantaloupe (Cucumis Melo)methanolic extracts [J]. Food Chemistry, 2010, 119(2): 643-647
[17]Kubola J, Siriamornpun S. Phenolic contents and antioxidant activities of bitter gourd (Momordica CharantiaL.)leaf, stem and fruit fraction extractsin vitro[J]. Food Chemistry, 2008,110(4): 881-890
[18]Alvarez-Jubete L, Wijngaard H, Arendt E K, et al.Polyphenol composition andin vitroantioxidant activity of amaranth, quinoa buckwheat and wheat as affected by sprouting and baking [J]. Food Chemistry, 2010, 119(2): 770-778
[19]Zhou H-C, Lin Y-M, Li Y-Y, et al. Antioxidant properties of polymeric proanthocyanidins from fruit stones and pericarps ofLitchi Chinensissonn [J]. Food Research International,2011, 44(2): 613-620
[20]Fiorentino A, D'Abrosca B, Pacifico S, et al. Identification and assessment of antioxidant capacity of phytochemicals from kiwi fruits [J]. Journal of Agricultural and Food Chemistry, 2009, 57(10): 4148-4155
[21]孙瑾,王宗举,陈岗,等.橄榄中多酚类物质体外抗氧化活性研究[J].中国食品添加剂,2010,100(3):69-73 SUN Jin, WANG Zong-ju, CHEN Gang, et al. Study on in vitro antioxidant activity of polyphenols from canarium album [J]. Chinese Food Additives, 2010, 100(3): 69-73
[22]GB 2763-2012,食品安全国家标准《食品中农药最大残留量》[S]GB 2763-2012, National food safety standard Maximum residue limits for pesticides in food [S]
[23]李瑞娟,于建垒,宋国春,等.氯吡脲在猕猴桃和土中的消解动态与残留测定[J].山东农业科学,2009,2:78-80,83 LI Rui-juan, YU Jian-lei, SONG Guo-chun, et al.Degradation dynamic and residue determination of forchlorfenuron in Chinese goose beery fruit and soil [J].Shandong Agricultural Sciences, 2009, 2: 78-80, 83
[24]柴振林,杨柳,朱杰丽,等.氯吡脲在猕猴桃中的残留动态研究[J].果树学报,2013,30(6):1011-1015 CHAI Zhen-lin, YANG Liu, ZHU Jie-li, et al. Study on residue dynamics of forchlorfenuron in Kiwifruit [J]. Journal of Fruit Science, 2013, 30(6): 1011-1015
[25]李琛,张婷,罗安伟,等.8种猕猴桃抗氧化活性评价及基于HPLC与 FT-IR指纹分析的品种区分[J].现代食品科技,2016,32(6):288-297 LI Chen, ZHANG Ting, LUO An-wei, et al. Evaluating antioxidant capacity of eight kiwi fruit cultivars and identifying cultivars based on HPLC and FT-IR fingerprint analysis [J]. Modern Food Science and Technology, 2016, 32(6): 288-297
[26]刘金串.膨大处理对鲜食葡萄植物化学成分及抗氧化活力的影响[D].杨凌:西北农林科技大学,2011 LIU Jin-chuan. Effect of enlargement treatments on the phyto-chemicals and antioxidant activity of table grape berries [D]. Yangling: Northwest Agriculture and Forestry University, 2011
[27]Hayes J E, Allen P, Brunton N, et al. Phenolic composition andin vitroantioxidant capacity of four commercial phytochemical products: Olive Leaf Extract (Olea EuropaeaL.), Lutein, sesamol and ellagic acid [J]. Food Chemistry,2010, 126(3): 948-955
[28]黄琴,沈杨霞,张成静,等.铁皮石斛多酚和黄酮含量及与抗氧化活性的相关性[J].应用与环境生物学报,2014, 20(3):438-442 HUANG Qin, SHEN Yang-xia, ZHANG Cheng-jing, et al.Correlation of the antioxidant property with the total phenolic contet and total flavonoids of differentDendrobium officinale[J]. Journal of Applied and Environmental Biology, 2014,20(3): 438-442
[29]董秋洪,杨天仪,施莉莉,等.三种膨大剂对京玉葡萄果粒膨大及其品质的影响[J].中国南方果树,2004,33(1):54-56 DONG Qiu-hong, YANG Tian-yi, SHI Li-li, et al. Effects of three extenders on fruit enlargement and quality of jingyu grape [J]. South China Fruits, 2004, 33(1): 54-56
[30]郭正兵,高大响,解振强.几种膨大剂对葡萄产量和品质的影响[J].江苏农业科学,2006,5:91-92,135 GUO Zheng-bing, GAO Da-xiang, XIE Zhen-qiang. Effects of several extenders on grape yield and quality [J]. Jiangsu Agricultural Sciences, 2006, 5: 91-92, 135
[31]张艳宜,任亚梅,宋小青,等.CPPU和1-MCP处理对猕猴桃货架期感官品质的影响[J].中国食品学报,2017, 17(3):208-217 ZHANG Yan-yi, REN Ya-mei, SONG Xiao-qing, et al.Effects of CPPU and 1-MCP treatment on sensory quality of kiwifruit during shelf-life [J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(3): 208-217
[32]刘金串,孟江飞,郭志君,等.膨大处理对红地球葡萄酚类物质及抗氧化活性的影响[J].食品科学,2012,33(5):7-12 LIU Jin-chuan, MENG Jiang-fei, GUO Zhi-jun, et al. Effect of enlargement treatment on phenolic content and antioxidant activities red globe grape [J]. Food Science, 2012, 33(5): 7-12

