普萘洛尔影响血管瘤干细胞向脂肪分化的研究
王献路,娄 寅,陈增红,曹东升
婴幼儿血管瘤(infantile hemangiomas, IHs)是婴幼儿时期最常见的良性肿瘤,全世界范围内的发病率高达4%~10%[1]。2008年,Léauté-Labrèze et al[2]发现普萘洛尔(Propranolol, PRN)可对IHs产生治疗效果。时至今日,PRN已渐渐替代激素成为治疗IHs的一线药物。同样在2008年,血管瘤干细胞(hemangioma stem cells, HemSCs)被Khan et al[3]首次报道,并在裸鼠上重建了独特的IHs演变过程,提示HemSCs可能是IHs的来源细胞。近年来,关于PRN治疗IHs的研究大多数是围绕HemSCs开展的,取得了一些成果[4-5],但是对于其治疗机制尚无突破性进展。IHs的自然发展最终是以纤维脂肪组织出现代替增生的血管组织为特征性表现的,临床上也发现,使用PRN治疗IHs数月后再次行手术切除的患儿,术中切除的瘤体组织表浅面呈现IHs特征性的鲜红色圆形凸起,但深部会有大量脂肪组织存在,与消退阶段出现大量脂肪细胞的特征相似,但时间进程上却大大提前。由此推测,PRN可能是通过影响HemSCs向脂肪细胞分化从而治疗血管瘤的。该研究通过对HemSCs进行体外提取与培养,检测PRN干预HemSCs时脂化相关因子的变化,旨在为IHs的治疗提供新的思路与方法。
1 材料与方法
1.1血管瘤标本经安徽医科大学第二附属医院伦理委员会批准,征得患儿家属同意并签署知情同意书后,收集安徽医科大学第二附属医院整形外科手术切取的未进行任何治疗的增殖期血管瘤新鲜标本,共2例,经安徽医科大学第二附属医院病理科确诊为增殖期血管瘤。HemSCs的获取依据Khan et al[3]的方法,从增生期血管瘤组织中分离并培养,取第4~10 代血管瘤干细胞进行实验。
1.2主要试剂与仪器MS分选柱、CD133免疫磁珠试剂盒(德国Miltenyi公司);DMEM培养基、胎牛血清(FBS)(美国Hyclone公司);盐酸普萘洛尔(美国Sigma公司);鼠抗人CD31、CD90、CD105抗体(美国Biolegend公司);胎儿骨髓间质干细胞成脂诱导分化培养基试剂盒、油红O染色试剂盒(广州赛业生物科技公司);Real Time PCR试剂盒(日本TaKaRa公司);脂肪分化指标的一抗(C /EBPα、C /EBPβ、PPARγ)(武汉博士德生物公司);光学显微镜(日本Olympus公司);流式细胞仪(美国Beckman公司);Real Time PCR仪(美国ABI公司)。
1.3血管瘤干细胞的分选与培养手术切取新鲜增殖期血管瘤组织,立即浸入4 ℃的DMEM/20%胎牛血清(FBS)+1%青霉素-链霉素(PS)的培养基中,然后迅速送到实验室。大量的PBS冲洗标本后,剪除皮肤、脂肪、血凝块及其他非瘤体组织,并留取明确的血管瘤组织。将未经处理的血管瘤组织用剪刀切碎成小组织块,浸入0.2%胶原酶中,37 ℃水浴箱中消化约1.5~2 h,弃上清液,DMEM重悬,通过100 μm的细胞滤网过滤后获得单细胞悬液。加入CD133磁珠,4 ℃避光孵育30 min,PBS清洗,弃上清液,重悬后,流入分选柱,通过CD133标记的免疫磁珠技术提纯CD133(+)HemSCs,收集细胞,然后培养于EGM-2/20%FBS+ 1%PS培养基中。通过细胞计数法计算HemSCs提取率[6]。培养48 h后,更换培养液,去除漂浮的细胞和未标记的磁珠。当原代细胞汇合成片铺满培养瓶时,用胰蛋白酶消化技术培养HemSCs并在体外传代培养。第4~10代HemSCs用于实验研究。
1.4形态学观察通过倒置显微镜,观察HemSCs接种在96孔培养板上24 h和48 h后细胞的形态。随着细胞代数的增加,可以观察到HemSCs的形态学的改变。
1.5流式细胞术鉴定血管瘤干细胞使用PE小鼠抗人CD31、CD90、CD105抗体进行检测。收集第3代HemSCs,细胞浓度调整为1×107个/ml。离心管为对照,CD31、CD90、CD105,加入500 μl细胞悬液,后加入5 μl相应抗体,4 ℃避光孵育30 min。清洗细胞2次后加入600 μl PBS,然后通过流式细胞术进行上机检测。Cytomics CXP软件分析数据。
1.6油红O染色检测HemSCs的成脂转化收集对数生长期的HemSCs,调整HemSCs浓度为1×105个/ml,接种于6孔板中。隔天换液待HemSCs生长到90%融合,用培养基A液即诱导培养基将PRN稀释成不同浓度(50 μmol/L、100 μmol/L),替换原培养液,对照组加入培养基A液,实验组加入不同浓度的PRN溶液,3 d后更换为培养基B液即基础培养基,培养24 h后更换培养基A液继续诱导。培养基A液和B液交替培养至脂滴变得足够大而圆后,PBS冲洗,4%中性甲醛溶液固定30 min后,再次PBS冲洗,加入1 ml油红O染料工作液30 min,弃去油红O染液,用PBS冲洗后显微镜下观察细胞成脂染色效果并拍照。
1.7RealTimePCR法检测HemSCs脂肪分化的相关指标提前染毒HemSCs(对照组和实验组,实验组:50 μmol/L、100 μmol/L PRN溶液),用TRIzol溶液提取RNA。将提取的总RNA,反转录试剂盒,RNase Free dH2O置于冰上,按照试剂盒说明书进行操作,反转录为cRNA。在Pubmed上选择Gene数据库搜索相关基因,以人ACTB 内参引物(NO. B661102)作为内参照,PCR引物序列见表1。以cDNA 链为模板进行PCR 反应,进行两步法PCR扩增标准程序:95 ℃预变性30 s;95 ℃ 5 s、60 ℃ 34 s,扩增40个循环。反应结束后,确认Real Time PCR的扩增曲线和融解曲线,分析结果。
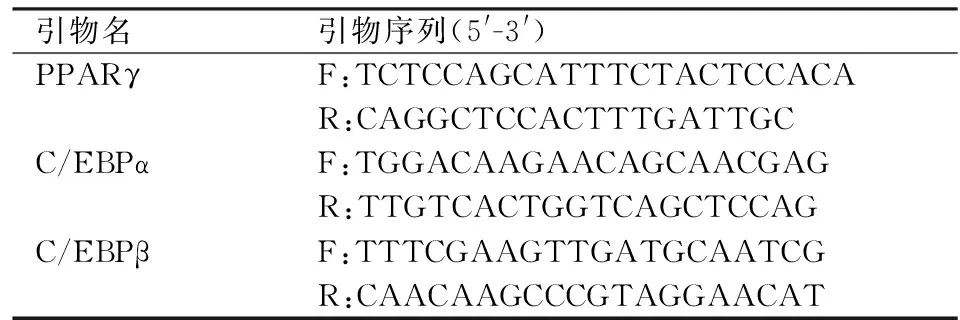
表1 PCR使用引物列表
1.8Westernblot法检测HemSCs脂肪分化的相关指标提前染毒HemSCs(对照组和实验组,实验组:50 μmol/L、100 μmol/L PRN溶液),RIPA裂解液裂解并提取蛋白质,BCA法蛋白定量后,SDS-PAGE电泳分离,电泳条件:60 V、30 min;120 V、1.5 h。电泳结束后,将蛋白转移至PVDF 膜上,5%脱脂牛奶封闭1~4 h,TBST洗膜3次,每次10 min,一抗室温孵育1~3 h,TBST洗膜3次,每次10 min,加入二抗,室温孵育1~3 h,TBST洗膜3次,每次10 min,化学发光,显影。
1.9统计学处理采用SPSS 17.0软件进行分析,组间显著差异采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1HemSCs的提取率使用CD133免疫磁珠分离技术,从婴幼儿增殖期血管瘤标本中分离出HemSCs,运用细胞计数法计算HemSCs提取率分别为0.27%和0.18%(样品1和2),平均约0.36%。
2.2HemSCs的形态观察HemSCs接种在96孔板中,显微镜下观察细胞形态,显示细胞呈圆形,同时可看到许多圆形透亮的未标记CD133的免疫磁珠。24 h后再次观察,显示圆形细胞开始变成椭圆形,长条形,形状多样且不规则(图1A)。48 h后,不规则形状的细胞已经变成长梭形扩散于孔板中(图1B),同时可看到许多圆形透亮的未标记CD133的免疫磁珠和大量未贴壁的死细胞。形态学观察表明,HemSCs的形态呈长梭形,类似于间充质干细胞的形态。其中第4代HemSCs细胞排列呈螺旋形漩涡状排列(图1C)。随着代数的增加,HemSCs的形态从长主轴变为三角形,四边形和不规则形状。第8代HemSCs仍然具有强大的增殖和集落形成能力(图1D)。
2.3流式细胞术检测细胞表型流式细胞术结果表明提取的细胞高度表达CD90(98.8%)和CD105(97.8%),但不表达CD31(0.7%)(图2),符合HemSCs的细胞表型。
2.4HemSCs的成脂诱导和油红O染色油红染色显示,HemSCs在脂肪培养基培养12~15 d后,细胞质内有许多红色脂滴形成。对照组的红色脂滴数较实验组少,且体积偏小,像花环一样围绕着细胞核一圈。而实验组细胞质内的红色脂滴像葡萄串样聚集在一起,形状更圆更大(图3)。且随着PRN浓度的上升,100 μmol/L组较50 μmol/L组细胞质内红色脂滴数量有增加趋势(图3B、3C)。另外还观察到实验组与对照组相比,HemSCs的数目和密度有减少趋势(图3A、3C)。

图1 血管瘤干细胞形态观察 SP×100

图2 流式细胞术检测血管瘤干细胞表型

图3 血管瘤干细胞的成脂诱导和油红O染色 SP×200

图4 Real Time PCR检测各组C /EBPα、PPARγ和C /EBPβ表达情况
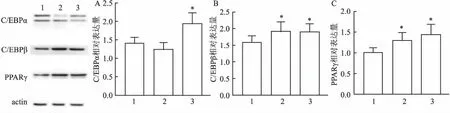
图5 Western blot法检测各组C /EBPα、PPARγ和C /EBPβ的表达情况
2.5RealTimePCR法检测HemSCs脂肪分化的相关指标C /EBPα指标在50 μmol/L PRN溶液干预后,与对照组相比差异无统计学意义(P>0.05),但是在100 μmol/L PRN溶液干预后,与对照组相比RNA水平上升,是对照组的3.2倍,差异具有统计学意义(P<0.05)。PPARγ和C/EBPβ指标经50 μmol/L和100 μmol/L PRN溶液干预后,与对照组相比RNA水平都显著上升,差异具有统计学意义(P<0.05)(图4)。
2.6Westernblot法检测HemSCs脂肪分化的相关指标HemSCs经不同浓度PRN溶液干预后,Western blot法检测HemSCs脂肪分化相关指标蛋白表达水平改变趋势与Real Time PCR法检测HemSCs脂肪分化相关指标RNA水平变化相一致(图5)。
3 讨论
IHs是儿童时期最常见的良性血管肿瘤,由紊乱的血管和不成熟的血管细胞组成。2008年PRN治疗血管瘤被发现,经过近十年的大量研究,PRN已经代替激素成为治疗IHs的突破性治疗方法。但是关于其治疗机制仍然不清楚。在此之后,HemSCs被Khan et al[3]从血管瘤瘤体组织中成功分离,并重建了独特的IHs演变过程,学者们才把目光集中到HemSCs的研究上来。Boye et al[7]认为血管瘤是HemSCs分化为内皮细胞的表型而形成。
IHs的生物过程复杂,有自行消退的特点,通常表现为3个不同的阶段,即增殖阶段、消退阶段以及消退完成阶段[8]。消退完成时,其特征性表现是纤维脂肪组织包绕塌陷的血管结构,这些独特的生理特点明显区别于血管畸形。Khan et al[3]在进行HemSCs研究时也发现,HemSCs在消退期会分化为脂肪细胞。脂化通常与C/EBPα、C/EBPβ以及PPARγ这3种因子相关。当特定细胞接收到脂肪转化相关信号后,转录因子C/EBPβ表达增加,诱导C/EBPα和PPARγ上调,促进与脂肪形成有关的基因表达增加,加速脂化过程。
本研究中,参考Khan et al[3]的HemSCs分选培养方法,并稍作修改,使胶原酶的消化时间从30 min延长至1.5~2 h,目的是为了提高单细胞悬液的质量,进而提高HemSCs的提取产率。而后采用流式细胞术检测其细胞表型,细胞高度表达干细胞标志物CD90和CD105,但不表达血管瘤内皮细胞标志物CD31,证实培养的细胞为HemSCs。HemSCs经成脂诱导分化培养基作用后,油红染色显示细胞质内有许多红色脂滴形成,并且实验组内的红色脂滴与对照组相比数量多且形状更大更圆,证实HemSCs有向脂肪细胞分化的潜能,并且PRN干预后,加速了HemSCs的脂化。随后用Real Time PCR法和Western blot法检测不同浓度PRN溶液干预下HemSCs脂化相关指标的变化,结果显示PPARγ和C/EBPβ指标经50 μmol/L和100 μmol/L PRN溶液干预后,与对照组相比RNA及蛋白水平都显著上升,差异具有统计学意义。C /EBPα指标在50 μmol/L和100 μmol/L PRN溶液干预后,与对照组相比,趋势不一致。虽然C /EBPα在50 μmol/L PRN溶液干预下相比于对照组RNA水平有所下降,但差异无统计学意义,C /EBPα在100 μmol/L PRN溶液干预后,与对照组相比RNA水平上升,差异具有统计学意义。这些结果与成脂诱导分化后油红O染色结果相一致,从侧面验证了实验的假设。
IHs的发生在临床上很常见,不仅给患儿带来了生理和心理上的巨大的痛苦,也给家庭和社会带来了沉重的经济负担。此次的研究成果有助于揭示PRN治疗IHs的机制,也将为临床上更好的运用PRN治疗血管瘤提供理论新依据。
参考文献

