硅酸钠溶液与酸反应的实验探究
徐小健

摘要: 通过对硅酸钠溶液与盐酸反应的最佳实验操作方法以及硅酸钠溶液和二氧化碳反应生成硅酸凝胶实验的探究,得出制备硅酸凝胶的几种可行的实验方法,以及硅酸钠溶液与二氧化碳反应所生成的钠盐种类。
关键词: 硅酸钠溶液; 二氧化碳; 硅酸凝胶; 实验探究
文章编号: 1005-6629(2018)4-0072-03 中图分类号: G633.8 文献标识码: B
人教版教材《化学1》第四章第一节中设计了硅酸钠溶液与盐酸反应制取硅酸胶体的实验,其内容为:“在试管中加入3~5mL Na2SiO3溶液(饱和Na2SiO3溶液按1∶2或1∶3的体积比用水稀释),滴入1~2滴酚酞溶液,再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液红色变浅并接近消失时停止,静置。[1]”教材中的实验并未提到盐酸的浓度,如果温度较低时按照教材中的实验方案进行实验需等待较长时间,甚至还需要水浴加热。此外,由于硅酸的酸性比碳酸还弱,那么Na2SiO3溶液能不能与CO2反应?能不能也产生凝胶状的硅酸?反应生成什么钠盐?为弄清楚这些问题,特对Na2SiO3溶液与酸反应的情况做如下探究。
1 硅酸钠溶液与盐酸反应生成硅酸凝胶的实验研究
硅酸在不同的浓度、温度和pH下,以不同的程度缩水聚合成各式硅酸,其结构有开链的,有环状的,也有立体网状的。其通式是xSiO2·yH2O。通常将硅酸写成H2SiO3只是笼统地代表所有硅酸而已。形成硅酸凝胶不仅与溶胶的聚合度有关,也与其交联度有关,一般来说在各种硅酸中H2O与SiO2的比值越小,其交联度和聚合度就越大,即越容易凝聚[2]。选用什么浓度的溶液进行实验比较合适呢?考虑到无论是演示实验还是学生分组实验,实验现象应尽可能快速、明显,所以选用饱和Na2SiO3溶液和6~7mol/L盐酸进行实验,达到了预期的实验效果。
1.1 向饱和Na2SiO3溶液中加入盐酸
实验操作及现象如表1所示。
表1 实验操作及现象
1.2 向盐酸中加入饱和Na2SiO3溶液
实验操作及现象如表2所示。
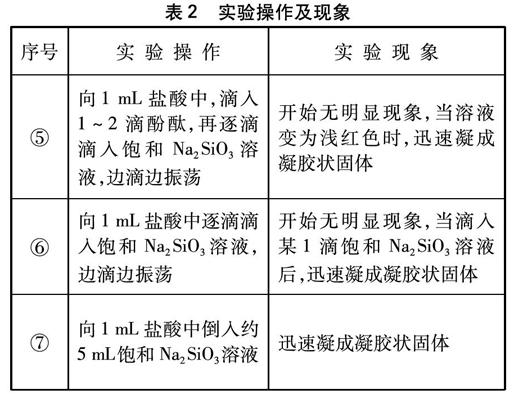
表2 实验操作及现象
所以,如果只想让学生了解Na2SiO3溶液与盐酸反应产生沉淀,只需采用实验①的做法;如果想观察到凝胶状固体,可以采用实验③、⑥或⑦的做法;如果想让学生了解Na2SiO3溶液呈碱性,可以向其中滴入1~2酚酞,采用实验②或⑤的做法。
2 硅酸钠溶液与碳酸反应生成硅酸凝胶的实验研究
由于碳酸的酸性强于硅酸,所以从理论上说,Na2SiO3溶液可以與CO2反应生成硅酸。向久置的硅酸钠溶液中滴加盐酸,有气泡生成[3],亦可说明Na2SiO3溶液能与CO2反应。
2.1 用组合装置进行实验
2.1.1 实验装置
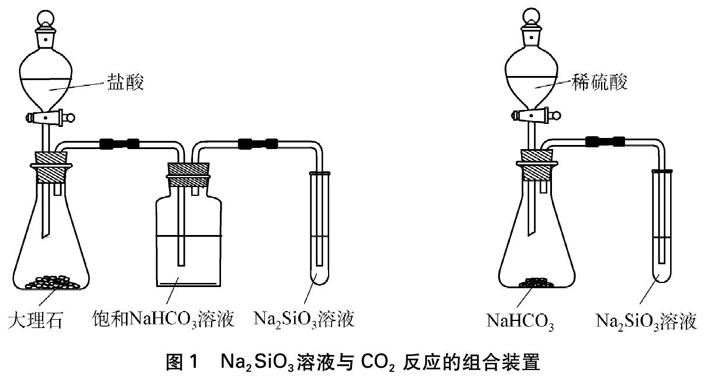
实验装置如图1所示。
图1 Na2SiO3溶液与CO2反应的组合装置
2.1.2 实验处理
如果用大理石与盐酸反应制取CO2气体,由于CO2气体中混有的HCl气体能与Na2SiO3溶液反应,所以须将其通过饱和NaHCO3溶液除去,再通入Na2SiO3溶液中,如图1所示。这样实验装置较为复杂,建议采用NaHCO3固体与稀硫酸反应或加热NaHCO3固体制取CO2,从而简化实验装置。
2.1.3 操作与现象
向试管内加入约2mL饱和Na2SiO3溶液,通入CO2气体。几分钟后溶液上方试管内壁有白色固体产生,停止通气,静置片刻,可观察到试管内液体凝成凝胶状固体。值得注意的是,如果长时间持续通入CO2气体,反而难以形成凝胶状固体。
2.2 用软饮料瓶进行实验
由于饱和Na2SiO3溶液中通入CO2气体产生硅酸凝胶耗时较长,不适合课堂演示,所以对该实验进行改进。取一个350mL软饮料瓶,洗净后晾干,用向上排空气法收集满CO2气体备用。拧开瓶盖,向瓶内加入1~2mL饱和Na2SiO3溶液,迅速拧紧瓶盖,充分振荡,可以观察到饮料瓶逐渐变瘪,并能感知到瓶壁微热,说明该反应放热。振荡1分钟左右,将瓶子倒置在桌上约1分钟,拧开瓶盖,可以观察到瓶盖内产生白色透明、软而有弹性的凝胶状固体。垫一薄层保鲜膜,即可用手进行触摸(也是一次感悟化学、与化学亲密接触的机会)。显然,用软饮料瓶进行实验,速度更快、效果更好、趣味性更强。
3 硅酸钠溶液与碳酸反应生成钠盐的实验研究
3.1 理论分析
查得H2CO3的电离常数Ka1=4.3×10-7、 Ka2=5.61×10-11, H2SiO3的电离常数Ka1=2.2×10-10、 Ka2=2×10-12[4]。由于电离H+的能力H2CO3>H2SiO3>HCO -3,所以向Na2SiO3溶液中通入CO2气体时,应该生成H2SiO3和HCO -3,而不生成CO2-3。
然而,目前仍有部分教师根据经验认为,向Na2SiO3溶液中通入CO2气体除了生成硅酸外,生成的钠盐与CO2的用量有关,通入少量CO2气体时,生成Na2CO3,通入足量CO2气体时,生成NaHCO3。实际情况如何呢?
3.2 实验探究
3.2.1 思路分析
由于Na2SiO3溶液中通入少量CO2气体时,溶液中还有大量过量的Na2SiO3,难以直接检验出生成的是NaHCO3还是Na2CO3。那么换个角度,可以探究H2SiO3能不能与Na2CO3反应。目前普遍认为酸与盐发生复分解反应时一般要求酸可溶,盐可以不溶。那么H2SiO3能不能与Na2CO3反应呢?当然也可以探究Na2SiO3能不能与NaHCO3反应。
3.2.2 实验步骤与现象
(1) 用饱和Na2SiO3溶液与盐酸或CO2制取硅酸凝胶。
(2) 将凝胶用玻璃棒搅碎后,加入蒸馏水,振荡,弃去上层液体,重复2~3次。
(3) 向洗净后的硅酸中加入蒸馏水,振荡,分为两等份,一份加入足量的饱和Na2CO3溶液,另一份加入等量的水做对比实验。将两份混合物充分振荡,为了加快反应速率,可以在酒精灯火焰上适当微热,观察到加有饱和Na2CO3溶液的硅酸逐渐溶解。
(4) 取3mL饱和的Na2SiO3溶液于试管中,向试管中加入2mL饱和的NaHCO3溶液,振荡试管[5],放置一段时间或水浴加热一段时间,均未见明显现象。
3.2.3 实验结论与延伸
(1) 实验结论
实验现象表明,H2SiO3能与Na2CO3溶液反应,Na2SiO3与NaHCO3溶液无明显现象,可说明Na2SiO3溶液中通入少量CO2气体时,应该生成H2SiO3与NaHCO3。
(2) 拓展延伸
① 既然H2SiO3能與Na2CO3溶液反应,而相同条件下,Na2SiO3溶液的碱性强于Na2CO3溶液,那么H2SiO3能与Na2SiO3溶液反应吗?鉴于此,将3.2.2实验中的“饱和Na2CO3溶液”换成“饱和Na2SiO3溶液”进行探究,实验现象与之相似,说明H2SiO3能与Na2SiO3溶液反应生成酸式盐。
② 受Na2CO3+CO2+H2O2NaHCO3知识的影响,有人理所当然地认为向酸性弱于碳酸的酸所对应的盐溶液中通入CO2气体,都应该先生成碳酸盐,后生成碳酸氢盐。其实不然,能不能生成碳酸盐,取决于酸的酸性是否比HCO-3还弱。常见酸性弱于碳酸的酸除了硅酸外,还有HClO、 OH和Al(OH)3等,HClO、 OH
和Al(OH)3的酸电离平衡常数分别为2.98×10-8、 1.1×10-10、 6.3×10-13,可以看出,其中酸性弱于HCO -3的只有Al(OH)3,所以向NaAlO2溶液中通入CO2气体时,生成的钠盐才与CO2量有关,而向Na2SiO3、 NaClO或ONa
溶液中通入CO2气体时,生成的钠盐与CO2量无关,应该生成NaHCO3。
在当前提倡以核心素养为导向的化学教学中,教师在备课时需进一步加强批判性思维和发散性思维,敏锐地捕捉教学中的疑点,精心设计教学方案。教学时应引导学生参与其中,发挥学生的主体作用,让设计的教学方案更加完善,然后再通过实验进行研究,进而得出结论。相信只要持之以恒,教师和学生的思维品质和研究水平一定会得到较大程度的提升。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·化学1[M].北京:人民教育出版社, 2007: 76.
[2]阳智纯.“硅酸钠与盐酸反应”最佳实验条件的探究[J].化学教学, 2008,(7): 11~13.
[3]张道年.久置硅酸钠溶液的“另类”现象[J].化学教学, 2011,(2): 43.
[4]北京大学等.无机化学(下)(第4版)[M].北京: 高等教育出版社, 2003: 567, 578.
[5]朱正德.从制备硅酸凝胶的实验探究谈“强酸制弱酸”规律[J].化学教学, 2013,(5): 49~50.

