铁的吸氧腐蚀实验的新设计
陈云
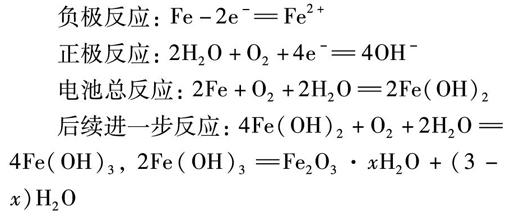
摘要: 依据铁的吸氧腐蚀原理,运用“一次性暖贴”、玻璃仪器以及手持技术改进传统实验。采用玻璃仪器探究铁的吸氧腐蚀过程中的物质转化,进一步利用氧气传感器和温度传感器对铁氧化过程的能量变化、铁的吸氧腐蚀的微观原理、影响铁的吸氧腐蚀速率因素等进行实验探究,说明钢铁的吸氧腐蚀是一个氧气参与的放热反应。
关键词: 吸氧腐蚀;氧气传感器;温度传感器;实验探究
文章编号: 1005-6629(2018)4-0059-03 中图分类号: G633.8 文献标识码: B
1 问题的提出
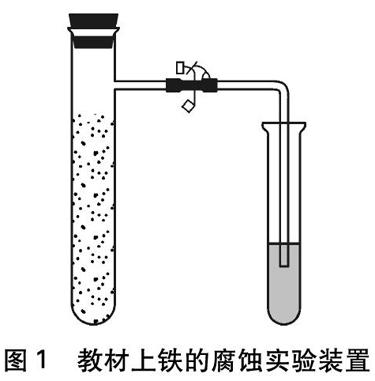
苏教版《化学反应原理》在金属的电化学腐蚀中设计了这样的活动与探究: 向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用氯化钠溶液润湿过的具支试管中,按图1组装好仪器。几分钟后,打开止水夹,观察、比较导管中水柱(在水中滴加几滴红墨水)的变化和试管中的现象。
图1 教材上铁的腐蚀实验装置
学生对实验现象进行分析时可能存在以下困惑: 钢铁在潮湿空气中容易生锈为什么是吸氧腐蚀过程,如何证明?铁原子失电子,氧化产物是什么,如何证明?导管内水柱上升只能说明具支试管内气体减少,怎么证明是O2参加反应呢?是否可以从定性和定量两个角度证明O2参与吸氧腐蚀过程?
化学解惑的重要途径就是实验探究,利用玻璃仪器的传统实验呈现物质变化的宏观现象,借助电子传感器捕捉化学反应过程中的细微变化,通过手持技术对铁的吸氧腐蚀实验进行改进和补充,从而帮助学生正确理解吸氧腐蚀的概念,解决学生的疑惑问题。
2 实验探究分析铁的吸氧腐蚀原理
2.1 实验原理
不纯的金属与电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子被氧化,这种腐蚀叫做电化学腐蚀。当在钢铁表面形成的电解质溶液薄膜呈中性或酸性很弱,且溶有一定量的氧气时发生吸氧腐蚀,反应如下:
负极反应: Fe-2e-Fe2+
正极反应: 2H2O+O2+4e- 4OH-
电池总反应: 2Fe+O2+2H2O2Fe(OH)2
后续进一步反应: 4Fe(OH)2+O2+2H2O4Fe(OH)3, 2Fe(OH)3Fe2O3·xH2O+(3-x)H2O
本实验设计从两个角度分析铁的吸氧腐蚀实验原理:
(1) 为验证铁的吸氧腐蚀是电化学过程,将铁、碳从微观粒子放大到铁钉和碳棒,通过连接微电流计观察指针偏转情况说明构成原电池。向铁钉处滴加K3[Fe(CN)6]溶液,向碳棒处滴加酚酞溶液,通过现象证明原电池正负极产物。
(2) 为验证铁的吸氧腐蚀过程中氧气的参与情况,设计利用氧气传感器在一个封闭环境中测定一次性暖贴发热过程中氧气浓度的变化。通过改变氧气初始浓度利用温度传感器监测温度变化,探究氧气初始浓度对钢铁吸氧腐蚀的影响。
2.2 实验药品与仪器
实验仪器: 威尼尔数据采集器、氧气传感器、温度传感器、滤纸、带鱼嘴夹的导线、电流表、培养皿、双口瓶、单孔塞、导管、剪刀、烧杯、玻璃棒、漏斗
实验药品: 铁钉、多孔碳棒、1mol/L Na2SO4溶液、6mol/L NaCl溶液、K3[Fe(CN)6]溶液、酚酞溶液、双氧水、二氧化锰、一次性暖贴(铁粉型、市售)
本实验采用威尼尔公司的数字采集器、数据采集软件、氧气传感器以及温度传感器。
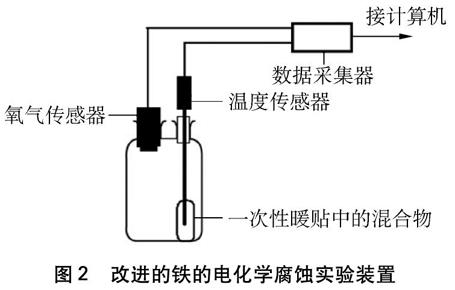
2.3 实验装置
实验装置见图2。
图2 改进的铁的电化学腐蚀实验装置
2.4 实验过程
实验探究1:
将一片用6mol/L NaCl溶液湿润的滤纸条置于培养皿中,将带有鱼嘴夹的两根导线分别夹铁钉和碳棒,连接微电流计,将两电极分别接触滤纸条两端,观察、记录实验现象。
实验探究2:
将铁钉、碳棒置于用6mol/L NaCl溶液湿润的滤纸条上,连接电流计反应一段时间之后,向铁钉与滤纸接触处滴加1滴K3[Fe(CN)6]溶液[1],向碳棒与滤纸接触处滴加1滴酚酞溶液,观察、记录实验现象{提示: Fe2+的检验: 加入K3[Fe(CN)6]溶液,產生特征蓝色沉淀}。
实验探究3:
用USB数据线将计算机与数字采集器连接起来,将氧气传感器、温度传感器连接到数据采集器上。将滤纸卷成圆筒状放入双口瓶内,使筒口对准插入温度传感器的瓶口,在双口瓶的另一端接入氧气传感器。取一袋一次性暖贴,剪开,将其中的固体粉末倒入烧杯内,用玻璃棒迅速搅拌均匀,再沿漏斗从连接温度传感器的瓶口倒入正下方圆柱形滤纸槽内,迅速插入温度传感器,点击数据采集器。
数据图像纵轴选择O2浓度(%)(体积分数)和温度(℃),横轴选择时间(s),开启仪器采集数据,观察氧气浓度和温度变化情况。
实验探究4:
向双口瓶中通入氧气,用氧气传感器监测氧气浓度变化。再重复操作,改变氧气初始浓度,采集数据,观察O2浓度和温度随时间变化情况。
2.5 结果与讨论
(1) 实验探究1和实验探究2结果表明通过观察到有电流通过微电流计指针偏转,说明构成原电池,验证钢铁的吸氧腐蚀是一种电化学过程。铁电极附近产生特征蓝色沉淀说明生成Fe2+,碳电极附近变成红色说明生成OH-,现象很好地将钢铁的吸氧腐蚀过程中的物质转化情况加以体现。
(2) 实验探究3结果如图3,实验表明O2含量在300秒内从最初的21%逐渐下降到14%,温度从最初的34℃逐渐上升到47℃,说明铁的吸氧腐蚀是一个放热的过程,双口瓶内减少的气体是O2,即氧气参与铁的腐蚀。实验探究4结果如图4和图5,实验表明氧气初始浓度越高,温度上升越快,吸氧腐蚀速率越快。
图3 氧气起始浓度为21%的放热时间曲线
图4 不同氧气起始浓度随时间变化的曲线
图5 不同氧气起始浓度时温度随时间变化的曲线
2.6 结论
本实验运用“一次性暖贴”、玻璃仪器以及手持技术,通过在密闭容器内氧气的浓度随着温度的上升逐渐减小的变化曲线,并且O2初始浓度越高,温度上升越快,钢铁吸氧腐蚀速率也更快,说明钢铁的吸氧腐蚀中氧气参与了反应且是一个放热的过程。
3 反思与启示
铁的吸氧腐蚀实验是氧化还原反应原理在电化学中的应用之一,如何将反应的微观变化尽可能通过技术手段呈现出来成为本实验设计的主要思想。与传统实验相比较: 将铁、碳从微观颗粒放大到铁钉和碳棒,宏观展现其电化学原理,利用宏观现象解释微观的物质变化,有效地激发了学生思维。实验在培养皿中进行,用滤纸作为载体,材料易得,操作简单,现象明显,便于学生分组探究。手持技术的应用使得一些原本不明显的现象更加明显和可测。将手持技术运用于钢铁的吸氧腐蚀的定性和定量研究已经有不少人做过,如何创新是最难的。在查阅资料过程中发现已经做过的工作主要有以下几种: 单传感器监测氧气[2]或压强变化;单传感器监测溶解氧变化[3];双传感器监测O2和压强变化[4]等,但是实验设计中都有一个共性,即运用的药品是实验室的铁粉、碳粉和NaCl。化学来源于生活,在学习的过程中,又向学生渗透了利用新技术、新方法。学习化学的主要目的是服务于工业与生活,并应用于解决生活中的相关问题。因此结合生活中的化学,本实验直接利用熟悉的“一次性暖贴”,对其包装设计和药品成分展开讨论研究。
实验过程中发现有以下几方面需要作进一步思考:
(1) 学生探究实验设计。在设计探究钢铁的吸氧腐蚀原理的实验时,发现构成原电池的放电量很小,因此在选择电流计时应选择微电流计。本实验检验亚铁离子时选用K3[Fe(CN)6]溶液,实验现象较为明显,但这种药品学生并不熟悉,若使用熟悉的检验方法应怎样改进?
(2) 原电池实验设计。在考虑O2参与反应时,曾设计向正极多孔碳棒通入O2,但是效果较差,原因是多方面的,如饱和NaCl溶液中O2的溶解度较小、碳棒吸附O2的能力也很小等。后续工作如怎样增大正极碳吸附O2的效果;选择合适的NaCl溶液的浓度以增大O2的溶解度;温度的影响,是否可以结合手持技术作进一步的探究等,都是可以继续进行实验探究的方面[5]。
(3) 实验设计时,相關知识紧密联系工业与生活。如: 铁、碳混合物在水溶液中形成微电池,可以用来处理水中的污染物,是否可以从这个角度进一步作实验探究。因此后续相关工作还有很多,需要不断去探索。
参考文献:
[1]郑晓红.几则电化学实验的改进与创新[J].化学教育, 2015,(3): 69~72.
[2]徐泓,朱敏,魏明贵.铁粉吸氧腐蚀系列实验的设计及应用[J].化学教学, 2015,(4): 63~66.
[3]江军.基于原理解读的铁吸氧腐蚀实验再设计[J].化学教育, 2015,(15): 56~59.
[4]江军.利用数字化实验系统探究铁的吸氧腐蚀实验[J].化学教育, 2014,(7): 55~58.
[5]徐卫瑛,赵琦.微型氧浓差电池的制作与分析[J].化学教学, 2013,(12): 51~52.

