萌发期干旱胁迫下棉花转录因子的表达
, ,
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室, 乌鲁木齐 830046)
植物遭受环境胁迫会影响其生理生化变化,从而影响重要的蛋白和基因的调控。种子萌发是棉花生长过程中的关键阶段,是衡量棉花抗旱性强弱的重要时期[1],转录因子在信号传递过程中有重要的调控功能,使植物能够响应干旱胁迫。了解转录因子在干旱胁迫下萌发过程中的表达为深入研究棉花抗旱的调控通路奠定基础。前人研究进展:转录因子能与基因的顺式作用元件结合,进而调控基因的表达,在植物信号传导和基因表达调控网络中起着重要作用[2,10]。已有大量研究表明,在模式植物拟南芥中,转录因子在萌发期响应各种胁迫,如AtWRKY 6在种子萌发和早期萌发阶段作为一个正调控因子调控ABA信号途径[3];AtMYB 96转录因子通过调控下游基因ABI4的表达调节拟南芥萌发[4];过表达AtDREB2C可延长种子萌发时间并增加种子中ABA含量[5];NAC家族转录因子NTL8在拟南芥中通过盐调控途径介导GA的合成[6]。在其他经济作物中,转录因子调控干旱代谢途径也已有大量研究,如玉米中DREB 2 A转录因子通过调节下游靶基因ZmGOLS2的表达,使玉米在干旱、高盐、高温下有较高的萌发率和存活率[7];在小麦48个干旱诱导WRKY转录因子中,证实TaWRKY1和TaWRKY33启动子区含有许多非生物胁迫响应元件,并用荧光定量表明TaWRKY1在高温和ABA胁迫下表达上调,在低温下表达上调;TaWRKY33参与高温、低温、ABA和MeJA胁迫[8]。而在棉花中转录因子在干旱胁迫下的表达调控途径鲜见报道。本研究切入点:由于新疆陆地棉新陆早17号中响应干旱的转录因子研究较少,调控途径未知。本研究选用新疆陆地棉新陆早17号,探讨干旱胁迫下转录因子的表达,阐明转录因子调控途径。拟解决的关键问题:检测陆地棉新陆早17号中NAC、MYB、DREB、WRKY转录因子在萌发期不同浓度PEG胁迫下的表达,以阐明干旱胁迫对转录因子表达的影响,为调节植物耐旱的途径奠定理论基础。
1 材料和方法
1.1 试验材料
本试验所用棉花种子为新疆农业科学院经济作物研究所玛纳斯实验站提供的新陆早17号。PEG-6000为分析纯。
1.2 试验处理
棉花种子进行表面消毒后,浸泡于蒸馏水中24 h。在直径10 cm方形培养皿内铺2层滤纸,用不同浓度PEG-6000润湿,以倾斜时皿底无溶液为标准。将种子从蒸馏水中取出,剥掉种皮,播种于上述滤纸上,每隔2 d添加1次PEG,以保持种子始终在模拟干旱胁迫状态下生长[9]。以双蒸水润湿滤纸为空白对照组;以不同浓度PEG润湿滤纸为PEG处理组。分别在播种后第2天、第4天和第6天测量棉花根长,统计萌发率,将取得的子叶和胚根,迅速冻于液氮中备用。
1.3 总RNA的提取和cDNA的合成
棉花总RNA用Omega公司Plant RNA Kit提取,所提取RNA质量通过琼脂糖凝胶电泳和定量来检测。采用MLV反转RNA合成cDNA。
1.4 干旱胁迫下萌发期棉花转录因子的表达分析
根据转录因子cDNA序列设计上下游引物,以GhEF1α为内参。qRT-PCR反应体系为:cDNA 1μL,SYBR Green 10μL,上下游引物各0.3μL,ROX校正液 0.1μL,用Rnase-free water补至20μL。反应过程为预变性94 ℃ 30 s,变性94 ℃ 5 min,退火62 ℃ 30 s,延伸72 ℃ 30 s,重复40个循环。本实验所用实时定量PCR仪型号为ABI 7500,数据用2-ΔΔCT分析[10]。
1.5 数据分析
所有图用Graph Pad Prism 5.0软件绘制,并用该软件进行统计学分析,方法为单因素方差分析。
2 结果与分析
2.1 PEG胁迫及ABA处理对棉花种子萌发的影响
如图1及表1所示,利用不同浓度PEG-6000对新陆早17号棉花种子进行胁迫,随PEG浓度增加,根长先增长后变短,结合相同条件下的萌发率,采用该PEG浓度梯度处理棉花种子,并检测转录因子在萌发期的表达。
表1 不同浓度PEG胁迫下棉花种子的萌发率

PEG-6000浓度萌发率(%)第2天第4天第6天ck40851002.52695100523801001036959514.5238090

图1 不同浓度PEG胁迫下棉花根长的测定结果
2.2 萌发期棉花转录因子在胚根中的表达分析
由图2~图4可知,根据检测萌发期不同时期转录因子的表达,在棉花胚根中,胁迫2 d时,转录因子响应PEG胁迫较少,NAC 5在5%PEG胁迫时,与空白对照组相比表达量显著上调;NAC 6在2.5%PEG胁迫时,与空白对照组相比,表达量下调。至胁迫4 d时,所选转录因子在PEG处理组与对照组相比,表达量都下调,且有显著差异。其中,NAC 1、NAC 3、NAC 4、NAC 6、DREB、MYB、WRKY在所有PEG胁迫条件下与对照组相比差异显著,NAC 2在10%PEG胁迫下与对照组相比有差异,NAC 5在14.5%PEG胁迫下与对照组相比有差异。至胁迫6 d,NAC 4在14.5%PEG胁迫下与对照组相比表达量显著上调,WRKY在10%PEG胁迫下与对照组相比表达量显著上调,NAC 6在2.5%、5%、10%PEG胁迫下与对照组相比表达量都显著下调。结果表明,胁迫4 d是转录因子响应PEG胁迫的主要时期。

注:***表示p<0.001,**表示p<0.01,*表示p<0.05。下同。图2 棉花转录因子在胁迫2 d胚根中的表达

图3 棉花转录因子在胁迫4 d胚根中的表达
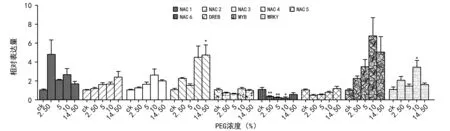
图4 棉花转录因子在胁迫6 d胚根中的表达
2.3 萌发期棉花转录因子在子叶中的表达分析
由图5~图7可看出,与胚根中转录因子表达相比,在子叶中,胁迫2 d时,NAC 1的表达在各PEG处理组均显著低于对照组,10%PEG胁迫时,NAC 2与NAC 3与对照组相比表达量显著上调。至胁迫4 d,NAC 1在5%PEG胁迫时与对照组相比表达了显著上调,在2.5%和14.5%PEG胁迫时,NAC 2和NAC 3与对照组相比表达量显著下调,NAC 5在所有PEG处理组的表达量均显著低于对照组,MYB在2.5%和5%PEG胁迫时与对照组相比表达量显著低于对照组,在14.5%PEG胁迫时,表达量极显著低于对照组。至胁迫6 d,NAC 2、NAC 3、NAC 5、NAC 6及DREB在2.5%PEG胁迫下,表达量显著高于对照组,NAC 4在5%、10%及14.5%PEG胁迫时表达量显著低于对照组,WRKY在10%和14.5%PEG胁迫时与对照组相比表达量有差异。以上结果表明,在子叶中,转录因子响应PEG胁迫是分时段进行的,未出现某一时期集中响应PEG胁迫。
3 讨 论
植物响应干旱胁迫是由许多生理水平及分子水平的改变组成的复杂过程。在干旱胁迫下,许多转录因子通过单独发挥作用或者共同调控形成一个互作网络[11-12]。植物通过激活由基因网络控制的一系列生理生化反应,在分子、细胞和整个植物水平上响应和适应干旱。根据在干旱胁迫下表达发生改变的基因具有的潜在功能,主要分为以下两类:一类是在信号通路及转录控制中发挥作用的基因,如激素,蛋白激酶,磷酸酶和转录因子;另一类由保护植物细胞抵御外界胁迫的基因组成,有脱水蛋白,热休克蛋白,衰老相关基因,膜渗透保护剂等[13-14]。目前,对转录因子的研究主要通过转录组数据分析得到调控途径中的关键转录因子,用沉默或过表达方式验证其功能。本研究检测了新疆陆地棉品种新陆早17号中GhNAC 1-6、GhMYB、GhDREB、GhWRKY在PEG胁迫下表达的变化,确定其是否响应PEG胁迫,为后续实验提供理论基础。

图5 棉花转录因子在胁迫2 d子叶中的表达

图6 棉花转录因子在胁迫4 d子叶中的表达

图7 棉花转录因子在胁迫6 d子叶中的表达
通过比较分析各时期转录因子的表达,发现转录因子响应PEG胁迫集中于胁迫4 d,其中NAC 1、NAC 3、NAC 4、NAC 6、DREB、MYB及WRKY在各PEG胁迫浓度表达量都显著或极显著低于对照组,该结果与Meng C等[15]、Zhang X等[16]的结果部分一致,其中NAC 4与NAC 6响应PEG胁迫结果与Meng C报道一致,NAC 1与NAC 3响应PEG胁迫与Meng C报道不一致,产生该结果可能的原因是检测基因表达时期不同,本研究在种子萌发过程中检测基因是否响应PEG胁迫,而Meng C在幼苗期及开花后检测基因是否响应PEG胁迫。此外DREB响应PEG胁迫,与Bo H[17],Ma L F等[18]的结果一致,WRKY与Yan Y等[19],Phukan U J等[20]的结果一致,说明在陆地棉不同品种中,该转录因子可能发挥相同的作用;MYB响应PEG胁迫与Chen T等[21],Baldoni E等[22]的结果一致,说明不同品系的棉花中,MYB转录因子具有相同的调控作用。
根据转录因子在胚根和子叶中不同时间的表达发现,在胚根中,转录因子集中在胁迫第4天响应PEG胁迫,NAC 2和NAC 5分别在10%、14.5%PEG胁迫与对照组相比表达量有差异,其余转录因子在各PEG胁迫下表达量都显著或极显著低于对照组,其中NAC 1、NAC 3、NAC 4、NAC 6、DREB、MYB及WRKY分别平均下调了61.57倍、3.78倍、7.67倍、42.42倍、13.32倍、80.51倍及135.67倍。在子叶中,转录因子的表达与胚根中不同,胁迫时间不同,有不同的基因响应PEG胁迫,如在胁迫第2天,NAC 1在PEG胁迫组表达显著低于对照组,表达量平均下调了6.71倍;胁迫第4天,NAC 2、NAC 3、NAC 5与MYB在PEG处理组表达量分别下调了3.5倍、3.75倍、7.5倍、1.61倍;胁迫第6天,NAC 4下调了11.88倍,NAC 6、DREB、WRKY分别上调了2.83倍、1.75倍、304倍。
4 结 论
通过检测萌发期陆地棉品种新陆早17号中转录因子的表达,结果表明,所筛选的转录因子都响应PEG胁迫,胚根中转录因子表达下调明显,尤其是NAC 1、MYB、WRKY分别下调了61.57倍、80.51倍、135.67倍。
参考文献:
[1]王俊娟,叶武威,王德龙,等.PEG胁迫条件下41份陆地棉种质资源萌发特性研究及其抗旱性综合评价[J].植物遗传资源学报,2011,12(6):840-846.
[2]Hobert O.Gene regulation by transcription factors and microRNAs[J].Science,2008,319(5 871):1 785-1 786.
[3]Huang Y,Feng C Z,Ye Q,et al.Arabidopsis WRKY 6 Transcription Factor Acts as a Positive Regulator of Abscisic Acid Signaling during Seed Germination and Early Seedling Development[J].Plos Genetics,2016,12(2):e 1005833.
[4]Lee K,Lee H G,Yoon S,et al.The Arabidopsis MYB 96 Transcription Factor Is a Positive Regulator of ABI4 in the Control of Seed Germination.[J].Plant Physiology,2015,168(2):677.
[5]Je J,Chen H,Song C,et al.Arabidopsis DREB 2 C modulates ABA biosynthesis during germination.[J].Biochemical & Biophysical Research Communications,2014,452(1):91-98.
[6]Kim S,Lee A,Yoon H,et al.A membrane-bound NAC transcription factor NTL 8 regulates gibberellic acid-mediated salt signaling in Arabidopsis seed germination.Plant J[J].Plant Journal,2008,55(1):77.
[7]Gu L,Zhang Y,Zhang M,et al.ZmGOLS 2,a target of transcription factor ZmDREB 2 A,offers similar protection against abiotic stress as ZmDREB 2 A[J].Plant Molecular Biology,2016,90(1-2):157.
[8]He G H,Xu J Y,Wang Y X,et al.Drought-responsive WRKY transcription factor genes TaWRKY 1 and TaWRKY 33 from wheat confer drought and/or heat resistance inArabidopsis:[J].Bmc Plant Biology,2016,16(1):116.
[9]常丹,杨艺,王艳,等.24-表油菜素内酯对PEG与盐胁迫下棉花种子萌发的影响[J].西北农业学报,2015,24(3):96-101.
[10]严晓红,包秋娟,张富春.干旱胁迫下油菜素内酯浸种对棉花种子萌发期NAC转录因子表达的影响[J].新疆农业科学,2017,54(8):1 414-1 421.
[11]Singh D,Laxmi A.Transcriptional regulation of drought response:a tortuous network of transcriptional factors[J].Frontiers in Plant Science,2015,6.
[12]Nakashima K,Yamaguchishinozaki K,Shinozaki K.The transcriptional regulatory network in the drought response and its crosstalk in abiotic stress responses including drought,cold,and heat.[J].Frontiers in Plant Science,2014,5(170):170.
[13]Padmalatha K V,Dhandapani G,Kanakachari M,et al.Genome-wide transcriptomic analysis of cotton under drought stress reveal significant down-regulation of genes and pathways involved in fibre elongation and up-regulation of defense responsive genes[J].Plant Molecular Biology,2012,78(3):223-246.
[14]Chaves M M,Flexas J,Pinheiro C.Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J].Annals of Botany,2009,103(4):551.
[15]Meng C,Cai C,Zhang T,et al.Characterization of six novel NAC genes and their responses to abiotic stresses inGossypiumhirsutumL.[J].Plant Science,2009,176(3):352-359.
[16]Zhang X,Zhen J,Li Z,et al.Expression Profile of Early Responsive Genes Under Salt Stress in Upland Cotton (GossypiumhirsutumL.)[J].Plant Molecular Biology Reporter,2011,29(3):626-637.
[17]Bo H,Jin L G,Liu J Y.Molecular cloning and functional characterization of a DREB 1/CBF-like gene (GhDREB1L) from cotton[J].中国科学:生命科学,2007,50(1):7.
[18]Ma L F,Zhang J M,Huang G Q,et al.Molecular characterization of cotton C-repeat/dehydration-responsive element binding factor genes that are involved in response to cold stress[J].Molecular Biology Reports,2014,41(7):4 369-4 379.
[19]Yan Y,Jia H,Wang F,et al.Overexpression of GhWRKY 27 a reduces tolerance to drought stress and resistance to Rhizoctonia solani infection in transgenic Nicotiana benthamiana[J].Frontiers in Physiology,2015,6(265):265.
[20]Phukan U J,Jeena G S,Shukla R K.WRKY Transcription Factors:Molecular Regulation and Stress Responses in Plants[J].Frontiers in Plant Science,2016,7(807560):760.
[21]Chen T,Li W,Hu X,et al.A Cotton MYB Transcription Factor,GbMYB 5,is Positively Involved in Plant Adaptive Response to Drought Stress[J].Plant & Cell Physiology,2015,56(5):917.
[22]Baldoni E,Genga A,Cominelli E.Plant MYB Transcription Factors:Their Role in Drought Response Mechanisms[J].International Journal of Molecular Sciences,2015,16(7):15 811-15 851.

