模拟增温及隔离降雨对中亚热带杉木人工林土壤可溶性有机质的数量及其结构的影响
李 欢,杨玉盛,司友涛,*,林伟盛,熊德成,刘小飞
1 福建师范大学地理科学学院,福州 350007 2 福建省湿润亚热带山地生态重点实验室-省部共建国家重点实验室培育基地,福州 350007
土壤有机质(soil organic matter, SOM)是森林生态系统中最大的碳库[1],可溶性有机质(dissolved organic matter,DOM)代表SOM很小的一部分,具有很高的活性[2]。DOM通常定义为能够通过0.45μm孔径滤膜且大小和结构不同的有机物[3]。它是水溶性的天然有机化合物,成分复杂,包括单体化合物以及超分子体系[4]。在植物-微生物-土壤体系中,DOM对碳(C)、氮(N)循环具有重要的作用[5-6]。
从工业革命至今,化石燃料的大量开采和使用造成大气中“温室气体”的剧增,产生了以气候变暖为主要特征的气候变化[7]。据2013年IPCC最新的气候变化研究显示,1880—2012年全球平均地表温度大约上升了0.85℃[8]。气候变暖导致陆地生态系统的降雨格局发生改变,报道指出,纬向平均降水很可能在高纬度和部分中纬度地区增加,而在亚热带地区则会减少[9]。温度、水分是生态系统过程的重要因子,全球变暖和降雨格局发生改变将会影响森林生态系统的结构和功能[10-11],DOM作为陆地生物地球化学循环的重要组成部分,对土壤固碳、微生物和植物的养分有效性具有重要的意义[12],因此研究土壤DOM对温度和水分的响应可以为预测未来森林生态系统C、N循环的趋势提供科学依据。
文献表明[3],可溶性有机碳(dissolved organic carbon, DOC)的数量与温度呈正相关关系,这归因于在较高的温度下,微生物的活性有所提高。在富含有机质的土壤中(如泥炭土),温度升高有使DOM浓度增加的可能性[13]。Riikka等[14]通过模拟全球气候变暖,研究土壤C对増温的响应,结果表明:持续7年的增温对亚北极区的土壤C库只有轻微的影响,但增温样地的DOC含量比没有增温的样地高,这可能是因为温度升高提高了植物生长量,从而增加了可溶性C的输入。Fröberg等[15]通过对云杉林土壤进行长达14年的增温(5℃)试验,发现在旱季对土壤进行灌溉,使土壤保持潮湿状态,DOC的浓度增加,他们认为在未来更为频繁的降雨条件下,DOM在夏季和秋季的通量可能会增加。另有报道指出[16-17],旱季DOM的浓度会减少,一旦发生降雨,在相当长的时间里DOM的浓度则会增加。而Fenner等[18]发现,在干旱停止后,DOM的产生速率提高,这可能是因为酚氧化酶接触氧气后分解了酚类化合物。报道指出[19],由于氧化还原条件的改变,在旱期,含氮的DOM组分会减少。显然,温度和降水变化对DOM具有明显的影响,但其中的机理还不甚清楚,亟待研究。
我国湿润亚热带地区森林生物资源丰富,自然条件优越,分布着世界上现存面积最大、最典型的常绿阔叶林,但是大面积的常绿阔叶林被改造成了杉木人工林。杉木林作为最重要的人工林之一,占世界人工林面积的6.5%,占我国人工林面积的19%,对我国林业生产具有重要的意义。由于该区大力营造人工林,使其贡献了我国森林碳汇能力的65%[20]。该地区高温、高湿,有机质分解快,DOM在土壤中的迁移较为迅速,淋溶和损失的风险很大,它对生态系统碳氮循环中的作用可能比温带的森林更为重要[21]。气候变暖,降雨减少可能是该地区未来气候变化的趋势,这可能会加大DOM的分解作用,从而不利于DOM的稳定与固持,使土壤养分流失。现有的野外增温控制平台主要集中在中高纬地区,而关于我国亚热带地区野外增温结合多种气候变化因子的试验却极少报道。因此,通过研究温度和降水对土壤DOM的影响有助于了解全球气候变化背景下该地区森林生态系统的结构与功能的变化。据此,本文在野外杉木幼林地建立多气候因子试验平台,模拟未来全球气候变化,以土壤DOM为对象,结合紫外-可见光谱(UV-Vis)、荧光光谱(FS)等技术,探讨土壤增温和降雨减少对DOM的数量及其组成的影响。
1 试验地概况
试验区位于福建三明森林生态系统与全球变化定位观测研究站(26°19′N,117°36′E)。平均海拔为300m,属中亚热带季风气候,年均温度为19.1℃,年均降雨量为1749mm,降雨季节主要集中在3月—8月,相对湿度为81%。土壤为黑云母花岗岩发育的红壤[22]。
本试验所选样地为杉木幼林地,样地内包含若干个面积为2m×2m的试验小区,小区四周用4块PVC板(200cm×70cm)焊接,使小区与小区之间的土壤隔开,以防止各小区相互干扰。小区内的土壤由周围成熟杉木人工林土壤供给,具体方法为:将成熟杉木林的土壤分层(0—10、10—20、20—70cm)取回后剔除粗根、石块和其他杂物,再分层混合均匀重填回2m×2m的试验小区内,同时采用压实法调整土壤容重与原位土壤容重接近,以消除土壤异质性。
试验设对照(CK)、增温(W)、隔离降雨(P)、增温与隔离降雨的交互作用(WP)4种处理,每个处理3个小区(重复),共12个2m×2m的试验小区。于2013年l0月在所有的试验小区平行布设相同的加热电缆,深度为10cm,间距为20cm,且在最外围环绕一周,保证样地增温的均匀性。隔离降雨处理即在P和WP试验小区内,在离地面1.5m处每隔5cm均匀地布设一个0.05m×5m的透明U型管,从而隔离50%的自然降雨[22]。于2013年11月在每个2m×2m小区种植4棵1年生2代半短侧枝杉木幼树,平均高度为(25.7±2.52)cm,平均主干基径为(3.35±0.48)cm,杉木的位置设于两条电缆线之间。电缆布设完成5个月后(2014年3月)开始通电增温(只有W和WP小区增温,且增温小区始终比对照小区高5℃)。
2 研究方法
2.1 样品采集
土壤样品采集共有3个时间点,分别为:2014年10月、2015年1月和2015年4月(2014年10月和2015年1月为旱季,2015年4月为雨季)。样地各月份大气温度和降雨量见图1,3个采样点的大气月均温度依次为19.1℃、9.8℃、17.5℃,月均降雨量依次为0.1、2.1、4.5mm。每次采样均在各个小区按S型布设5个土壤取样点,按0—10、10—20cm分层取样。样品带回室内,去除碎屑、砂砾以及植物根系,再将每块样地中的相同层次的5个取样点土样混合成一个样品,过2mm筛,取一部分测定土壤基本理化性质、土壤微生物量碳(microbial biomass carbon, MBC)和微生物量氮(microbial biomass nitrogen, MBN),其余部分用于提取DOM。

图1 不同采样时间试验地的大气温度及降雨量Fig.1 Atmospheric temperature and rainfall in the experimental field at different sample time
2.2 土壤DOM的提取
土壤DOM的提取采用水浸提法[23]。称取15g鲜土于50mL离心管中,加入30mL去离子水(水土比为2∶1,V/W),于振荡机上振荡30min,然后以转速4000r/min离心10min,再用0.45μm滤膜过滤,滤液中的有机物即为土壤DOM。
2.3 样品的分析与测定
pH采用CHN868型pH计(Thermo Orion)测定,水土比为2.5∶1;土壤含水量(soil water content,SWC)的测定采用烘干法;土壤总有机碳(soil organic carbon,SOC)和土壤总氮(soil total nitrogen,STN)采用碳氮元素分析仪(VarioMAX, Elementar, Munchen, Germany)测定。在不同的时间观测点,4种处理的土壤基本性质见表1。
MBC和MBN的浸提采用氯仿熏蒸-硫酸钾法[24]。用总有机碳分析仪(TOC-VCPH,Shimadzu,Kyoto,Japan)测定提取液中的有机碳含量,用连续流动分析仪(San++,Skalar,Breda,Netherlands)测定提取液中有机氮的含量。土壤MBC的计算公式如下:BC=ΔEC/kC,式中:ΔEC为熏蒸与未熏蒸提取液中有机碳含量的差值;kC为转换系数,该值取0.45;MBN的计算公式为:BN=ΔEN/kN,ΔEN为熏蒸与未熏蒸提取液中有机氮含量的差值;kN为转换系数,该值取0.54。
滤液中的DOC、DON含量分别采用总有机碳分析仪(TOC-VCPH,Shimadzu,Kyoto,Japan)和连续流动分析仪(San++,Skalar,Breda,Netherlands)测定。紫外可见吸光值采用紫外-可见分光光度计(UV-2450,Shimadzu,Kyoto,Japan,比色皿边长为1cm)测定,待测液在波长为254nm处的吸收值(Special Ultraviolet-Visible Absorption, SUVA)与DOC的浓度能够计算DOM的芳香性指数(Aromaticity index,AI),即AI=UV254/ DOC)×100[25]。荧光光谱采用日立荧光光谱仪(F7000,Hitachi,Toykyo,Japan)测定,激发和发射光栅狭缝宽度为5nm,扫描速度为1200nm/min,其中激发光谱波长为254nm,发射波长范围为300—480nm;荧光同步波长范围为250—500nm。荧光光谱测定前用稀盐酸将待测溶液的pH值调为2,以提高灵敏度[25]。荧光发射光谱中Σ(435—480nm)区域与Σ(300—345nm)区域的峰面积比值为荧光发射光谱腐殖化指数(Humification index,emission mode,HIXem),可以用来表示DOM的聚合程度[26-28];荧光同步光谱波长460nm与345nm处荧光强度的比值为荧光同步光谱腐殖化指数(Humification index,synchronous mode,HIXsyn)[27-28]。
2.4 数据处理与分析
使用SPSS 19.0软件进行数据分析。采用单因素方差分析和独立样本t检验比较同一时间观测点下相同土层的不同处理间或同一处理的相同土层在不同时间下的土壤性质、MBC、MBN和DOM的数量及其光谱学特征值的差异性;采用三因素方差分析检验相同土层中温度、降雨、时间对各指标的影响(文章中仅列出W、P、W×P的影响);采用相关性分析探讨各指标之间的关系(P<0.05)。相关图表采用Excel和Origin完成。
3 结果与分析
3.1 增温、隔离降雨及其交互作用对土壤理化性质的影响
表1为三个采样时间点下不同处理的土壤理化性质。在第一个采样点(2014年10月),对于0—10cm土层,与CK相比,仅W的土壤含水量显著降低;W、WP的pH显著小于CK;W、P、WP的SOC、STN、C/N略小于CK,但无显著性差异。在10—20cm土层,W、P的土壤含水量显著小于CK,WP无显著差异性;与CK相比,仅W的pH显著降低;W、P、WP的SOC、STN、C/N较CK小,但仅P的SOC、STN显著小于CK。在第二个采样点(2015年1月),0—10cm土层的土壤经P、WP处理后,土壤含水量显著降低;W、WP的pH显著小于CK;仅W的SOC显著小于CK;在10—20cm土层,P的pH显著小于CK,而各处理的土壤含水量、SOC、STN、C/N无显著性差异。在第三个采样点(2015年4月),0—10cm土层的土壤经WP处理后土壤含水量显著下降;W、WP的pH显著低于CK;各处理的SOC、STN、C/N无显著性差异。在10—20cm土层,各处理的土壤含水量无显著性差异;P的pH显著小于CK;各处理的SOC、STN、C/N无显著性差异。

表1 不同采样时间下不同处理的土壤性质
不同大写字母表示同一种处理在同一土层不同时间之间差异显著, 不同小写字母表示同一时间同一土层不同处理之间差异显著(P<0.05);结果表示为平均值±标准差(n=3)
同一种处理的土壤含水量,随着时间的变化有略微差异。对于两个土层而言,在2014年10月,各处理的土壤含水量最低,这可能是因为该季为旱季,降雨少,且由于温度较高,水分蒸发。到了2015年1月,气温下降,蒸发量减少,使得土壤含水量有所增加。在2015年4月,CK、W、WP的含水量比2015年1月有所降低,这可能是因为虽然该季为雨季,但是植物进入生长季,对水分的需求加大;而P的土壤含水量有所增加。随着时间的推移,与CK相比,W、P、WP的土壤pH、SOC均有降低的趋势。方差分析结果表明:在0—10cm土层,增温(W)因子对土壤含水量的作用显著;而在10—20cm土层,隔离降雨(P)因子对土壤含水量有显著作用(表2)。对于两土层而言,W对土壤pH的作用达到显著水平,P仅对0—10cm土层的作用显著(表2),说明温度对pH的影响范围更大。
3.2 增温、隔离降雨及其交互作用对土壤DOM数量的影响
图2为不同采样时间点下各处理土壤DOC及DON的数量。对两个土层而言,在第一个采样点,WP处理的DOC和DON含量最高;在第二个采样点,W和WP处理的土壤DOC含量较高,而P和WP处理的DON含量较高;在第三个采样点,与CK相比,W、P、WP的DOC含量显著提高;同时仅W处理的DON显著高于CK。在两个土层中,同种处理的土壤DOC的数量随着时间的推移而增加;同时,CK和W处理的土壤DON也逐渐增加,但P和WP处理的土壤DON呈现先增加后降低的趋势。这可能是因为随着植物的生长,来源于凋落物和根系分泌物的碳源变得相对丰富,致使各处理的DOC得到一定程度的累积;另外,2014年10月、2015年1月为旱季,2015年4为雨季,干湿交替可能会破坏土壤的结构,使吸附在土壤中的DOC释放出来。植物生长量的增加可能导致CK、W的DON增加,进入雨季后,P、WP的土壤透气性可能较差,影响了微生物的活性,降低了有机质的分解效率,DON的数量降低。方差分析结果显示,W、W×P对0—10cm和10—20cm土层的DOC数量的影响显著(表2)。W对0—10cm土层的DON数量影响显著,而对10—20cm土层的DON数量无显著性影响;P、WP对两土层的DON数量均有显著性影响(表2)。

图2 不同采样时间下不同处理的土壤可溶性有机碳及可溶性有机氮的数量Fig.2 The quantity of soil dissolved organic carbon and nitrogen of different treatments at different sample timeCK, 对照, control; W, 增温, warming; P, 隔离降雨, precipitation reduction; WP, 增温×隔离降雨, warming and precipitation reduction; 1, 0—10cm土层, 0—10cm soil depth; 2, 10—20cm土层, 10—20cm soil depth. 不同大写字母表示同一种处理在同一土层不同时间之间差异显著, 不同小写字母表示同一时间同一土层不同处理之间差异显著(P<0.05)。结果表示为平均值±标准差(n=3)
3.3 增温、隔离降雨及其交互作用对土壤微生物量碳、氮的影响
图3为2015年1月和2015年4月不同处理的MBC、MBN。前期由于试验时间相对较短,土壤微生物对新的环境可能正处于适应期,相对还不稳定,这样不利于比较试验处理对微生物的影响。因此,本试验中并未对2014年10月的样品进行土壤微生物量的测定。由图3所示,在第二个采样点,CK处理的土壤MBC含量最高;并且在10—20cm土层,WP和W相对于CK显著降低了53%和24%。在第三个采样点,W和P处理的土壤MBC含量高于CK土壤,并且在10—20cm土层P的MBC比CK高115%。在0—10cm土层,CK、W、P的MBC随着时间的延迟呈上升趋势,WP呈下降趋势;在10—20cm土层,CK、WP的MBC随时间而降低,W、P则升高。在第二个采样点,在0—10cm土层,W的MBN显著低于CK,P、WP则显著高于CK;在10—20cm土层,W、WP的MBN小于CK。在第三个采样点,与CK相比,WP、W两个土层的MBN均显著降低,而P处理显著提高了0—10cm土层的MBN。随着时间的延迟,在0—10cm土层中,CK、W、P的MBN越来越大,WP则越来越小;在10—20cm土层,W的MBN呈增长趋势,CK、P、WP呈下降趋势。
方差分析结果表明W、WP因子仅对10—20cm土层的MBC有显著性作用;W对两土层的MBN均有显著性影响,对于下层土壤,仅W对MBN的作用显著,而P对MBN无显著性作用(表2)。
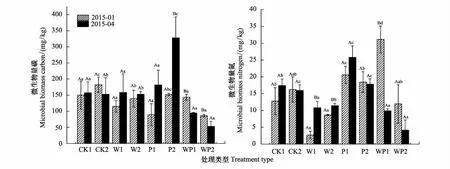
图3 不同采样时间下不同处理的土壤MBC、MBN含量Fig.3 The content of soil MBC,MBN of different treatments at different sample timeCK, 对照, control; W, 增温, warming; P, 隔离降雨, precipitation reduction; WP, 增温×隔离降雨, warming and precipitation reduction; 1, 0—10cm土层, 0—10cm soil depth; 2, 10—20cm土层, 10—20cm soil depth; 不同大写字母表示同一种处理在同一土层不同时间之间差异显著, 不同小写字母表示同一时间同一土层不同处理之间差异显著(P<0.05);结果表示为平均值±标准差(n=3)
3.4 增温、隔离降雨及其交互作用对土壤DOM的紫外光谱特征值的影响
图4为不同时间下增温、隔离降雨及其交互作用对土壤DOM紫外光谱学特征的影响。在旱季(前两个采样点),P处理的土壤DOM的AI高于W和WP,但到了雨季(第三个采样点)P处理的芳香性指数最低。在0—10cm土层,CK、W的芳香性指数随着时间的推移先降低后升高,P、WP则随时间的推移先升高后降低;在10—20cm土层,CK、P的芳香性指数随着时间的推移而降低,W随时间延迟先增大后减小,而WP则先降低后升高。方差分析结果表明,在0—10cm土层,W和P的交互作用(W×P)对DOM的芳香性指数有显著的影响,而在10—20cm土层,双因子的作用不显著,单因子W、P对芳香性指数的作用显著(表2)。

图4 不同采样时间下不同处理土壤DOM的紫外光谱特征 Fig.4 Characteristics of ultraviolet spectra of soil DOM of different treatments at different sample timeCK, 对照, control; W, 增温, warming; P, 隔离降雨, precipitation reduction; WP, 增温×隔离降雨, warming and precipitation reduction; 1, 0—10cm土层, 0—10cm soil depth; 2, 10—20cm土层, 10—20cm soil depth. 不同大写字母表示同一种处理在同一土层不同时间之间差异显著, 不同小写字母表示同一时间同一土层不同处理之间差异显著(P<0.05);结果表示为平均值±标准差(n=3)
3.5 增温、隔离降雨及其交互作用对土壤DOM荧光光谱特征的影响
如图5所示,在0—10cm土层,CK、W、P、WP处理的土壤DOM,其荧光发射光谱腐殖化指数HIXem值和荧光同步光谱腐殖化指数HIXsyn的值均随时间的推移先增大后减小;在10—20cm土层,CK、W的HIXem值逐渐减小,P、WP则先增大后变小,各处理的HIXsyn值则随时间的推移先增大后减小。在第一个采样点,W、WP的HIXsyn显著小于CK;在下层土壤,W的HIXsyn小于CK,而P大于CK,结果与AI相呼应,说明该阶段P增加了DOM的芳香性指数及腐殖化程度。在第二个采样点,在0—10cm土层,W的HIXsyn值比CK显著下降了76%;在10—20cm土层,P的HIXem显著大于CK,W、WP的HIXsyn显著小于CK,表明CK的结构比W、WP更为复杂。在第三个采样点,在上层土壤中,与CK相比,W、P、WP的HIXem、HIXsyn有所降低;在10—20cm土层,各处理的HIXem、HIXsyn值无显著性差异。方差分析显示W、P因子对上层土壤DOM的腐殖化程度具有显著性的影响,同时W对下层土壤的腐殖化程度也有显著的作用(表2)。
4 讨论
土壤含水量是影响生态过程的重要因子,增温处理使土壤温度升高,加速水分蒸发;隔离降雨处理则通过减少外源水分的输入影响土壤含水量。总体来看,W对表层土的含水量有显著影响,而P处理对下层土的含水量影响显著(表2)。这是因为增温后表层土壤的水分更容易蒸发,而下层土壤的土壤水分蒸发相对困难所以受增温的影响较小[29]。土壤含水量还受到季节的影响,在旱季(前两个采样点),W、P和WP处理的土壤含水量基本都低于CT,这可能是因为该时期降雨少,且部分水分蒸发,因此降低了W、P、WP土壤中的水分。但在雨季(第三个采样点),仅WP处理的表层土壤含水量显著低于CT处理,这是因为大量的外源雨水输入削弱了增温和隔离降雨的作用;再有,该季气温回升加强水分的蒸发;同时,由于植物加速生长,增加了植物对水分的利用。
表2增温、隔离降雨对土壤性质、MBC、MBN、土壤DOM的数量及其光谱学特征的影响的方差分析
Table2Varianceanalysesoftheeffectsofwarming,precipitationreductiononsoilproperties,MBC,MBN,thequantityandspectroscopiccharacteristicsofDOM

土层Soil layer/cm指标Index因子FactorWPW×P土层Soil layer/cm指标Index因子FactorWPW×P0—10土壤含水量∗∗∗NSNS10—20∗∗∗NSNS10—20NS∗NS0—10DOC∗∗∗NS∗∗∗0—10pH∗∗∗∗NS10—20∗∗∗∗∗∗∗10—20∗∗∗NSNS0—10DON∗∗∗∗∗∗∗∗∗0—10SOCNSNS∗∗10—20NS∗∗∗∗∗∗10—20NSNS∗0—10AINSNS∗∗∗0—10STNNSNSNS10—20∗∗∗NS10—20NSNSNS0—10HIXemNSNSNS0—10MBCNSNSNS10—20∗∗NSNS10—20∗∗∗NS∗∗∗0—10HIXsyn∗∗∗∗NS0—10MBN∗∗∗∗∗NS10—20∗NSNS
W, 增温, warming; P, 隔离降雨, precipitation reduction; WP, 增温×隔离降雨, warming and precipitation reduction;SOC, 土壤有机碳, soil organic carbon; STN, 土壤总氮, soil total nitrogen; MBC, 微生物量碳, microbial biomass carbon; MBN, 微生物量氮, microbial biomass nitrogen; DOC,可溶性有机碳, dissolved organic carbon; DON, 可溶性有机氮, dissolved organic nitrogen; AI, 芳香性指数, aromaticity index; HIXem, 荧光发射光谱腐殖化指数, humification index, emission mode; HIXsyn, 荧光同步光谱腐殖化指数, humification index, synchronous mode; NS, 没有显著差异, no significant differences; *,P< 0.05; **,P<0.01;***,P<0.001

图5 不同采样时间下不同处理土壤DOM的荧光光谱特征Fig.5 Characteristics of fluorescence spectra of soil DOM of different treatments at different sample timeCK, 对照, control; W, 增温, warming; P, 隔离降雨, precipitation reduction; WP, 增温×隔离降雨, warming and precipitation reduction; 1, 0—10cm土层, 0—10cm soil depth; 2, 10—20cm土层, 10—20cm soil depth; 不同大写字母表示同一种处理在同一土层不同时间之间差异显著,不同小写字母表示同一时间同一土层不同处理之间差异显著(P<0.05);结果表示为平均值±标准差(n=3)
本研究中,增温显著影响两层土壤的pH。温度升高后,土壤盐溶液的浓度、CO2和交换性阳离子会发生改变,进而影响土壤的pH[29-30]。增温后土壤含水量的减少也是pH降低的原因之一。土壤水分高时,土壤中的电解质被稀释,从而有更多的阳离子进入到溶液中,导致pH升高[31],因此土壤水分与土壤pH显著正相关(表3)。
土壤含水量与MBC、DOC呈显著正相关,但与SOC呈显著负相关(表3)。这表明SOC的变化可能主要是以土壤微生物以及DOM为媒介来调控的。DOM是微生物可以直接利用的能量和养分源[32],也是土壤肥力的敏感指标[33],其含量对增温和隔离降雨都很敏感(表2)。DOC含量高的土壤,越有利于微生物的分解,相应的SOC也就较少(表1,图2)。
AI表示DOM中芳香化合物的含量和高分子缩聚作用的程度[34],它与芳香H的含量呈正相关关系[35]。AI越高,表示DOM含有丰富的芳香化合物如木质素的衍生化合物[36]。HIXem、HIXsyn决定了DOM的腐殖化程度[34]。HIXem、HIXsyn越大,表明DOM含更多难分解的物质[34]。较高的HIXem值表示分子结构越复杂,DOM组分包含高度缩合的芳香环和高分子化合物如腐殖质;而HIXsyn与芳香C的含量呈正相关[37]。由此表明,AI和HIXem、HIXsyn能够用来分析DOM的分解难易程度。在2014年10月,W和WP的DOC高于CK,芳香性指数和腐殖化程度也较低,说明W和WP能够降低SOC的活化能,促进SOC向DOC的转化[38],增强微生物的活性,加速SOC的分解;方差分析显示,增温会显著影响DOC的数量(表2)。此时,P处理的土壤DOC数量最少,芳香性指数和腐殖化程度较高,SOC的数量也较低;这是因为P处理会增加土壤的透气性,加速土壤中原有DOC的矿化,同时由于缺乏新鲜DOM的输入,所以SOC含量降低。再有,该阶段属于旱季,过少的降雨量会影响土壤营养的淋溶,而长时间的干旱造成植物缺水,不利于植物生长[39],加上植物根部对于水分的竞争也会加剧,由此造成地上部分获取水分减少,使生物量降低[40],所以P处理减少了DOC的输入。因此总体上CK处理的SOC含量最高。
在2015年1月,W处理的土壤DOC、DON的数量大于CK,再次证明了增温有利于DOC、DON的产生。尽管高温使得微生物的数量不多,但总体矿化作用较强,SOC持续活化为DOC、DON后很快被矿化,W处理的AI和HIXem降低也表明了DOC的易分解性,最终使得W处理的SOC含量最低。值得注意的是,此采样的时间点是干旱的冬季,增温不利于微生物生长。另一方面,增温能够增加植物细根的数量[14,41],而来源于植物根系的分泌物也是土壤C的重要组成部分[42],继而通过激发效应[43-44],促进本底有机质的矿化[45- 47]。此阶段P处理的DOC数量较少,且其组分难以分解(图4,图5);P处理导致土壤水分降低,从而影响植物的生长[39],因此缺乏外源有机质的输入,这可能是其土壤SOC较低的重要原因。在此阶段,WP处理的10—20cm土层的含水量最低,DOC的AI和HIXem也较低,但是SOC含量最高,这与WP处理较低的MBC相呼应,因为较少的微生物量减缓了SOC的分解。WP是W和P的双重作用,温度升高促使植物的生物量增加,提高外源有机质的输入量,促进DOC、DON的数量增加,但由于微生物分解较慢,所以净的结果是SOC的累积。
到了2015年4月,雨季来临,增温和隔离降雨对土壤水分的影响不明显。相反,P处理的含水量是最高的,这可能是由于前期干旱的条件增加了土壤的孔隙,土壤蓄水能力增加,而较多的水分利于DOM的溶解释放。旱季由于缺少扩散作用,微生物基质得到累积,进入雨季,细菌的溶解以及C的溶解度增强,导致DOC的浓度变大[48],细菌的溶解释放大部分的亲水性物质即芳香性低的物质[48],使得DOM的可利用性增强,更容易被降解[48],因此P处理的MBC和MBN最高,AI最低。W处理的DOC、DON最高,SOC含量最低,说明增温一年后,W处理的土壤固碳能力较差。在所有处理中,WP的土壤含水量、MBC和MBN低,而SOC含量高,说明水分的相对缺乏是影响WP处理的关键因子,增温能够增加有机质的输入,但是水分减少降低了微生物的活性,抑制有机质分解,因此在增温和隔离降雨二者交互作用下,SOC得以累积。
整体而言,在试验期,土壤增温加速了有机质的分解,促进DOC、DON数量的增加,而其DOM的组分具有较低的芳香性指数和腐殖化指数,因此增温使土壤DOM的结构变得相对简单。隔离降雨对土壤DOM的作用在旱季和雨季略有差异,这可能是由于季节变化影响土壤的结构与环境而造成的。在增温与隔离降雨的双重作用下,土壤DOC及DON的数量相对增多,其结构较对照简单,但相对单因子增温试验而言更为复杂。增温、隔离降雨及其交互作用对土壤DOM的影响较为复杂,未来还将持续观测以更为深入地探究温度及水分带来的影响。
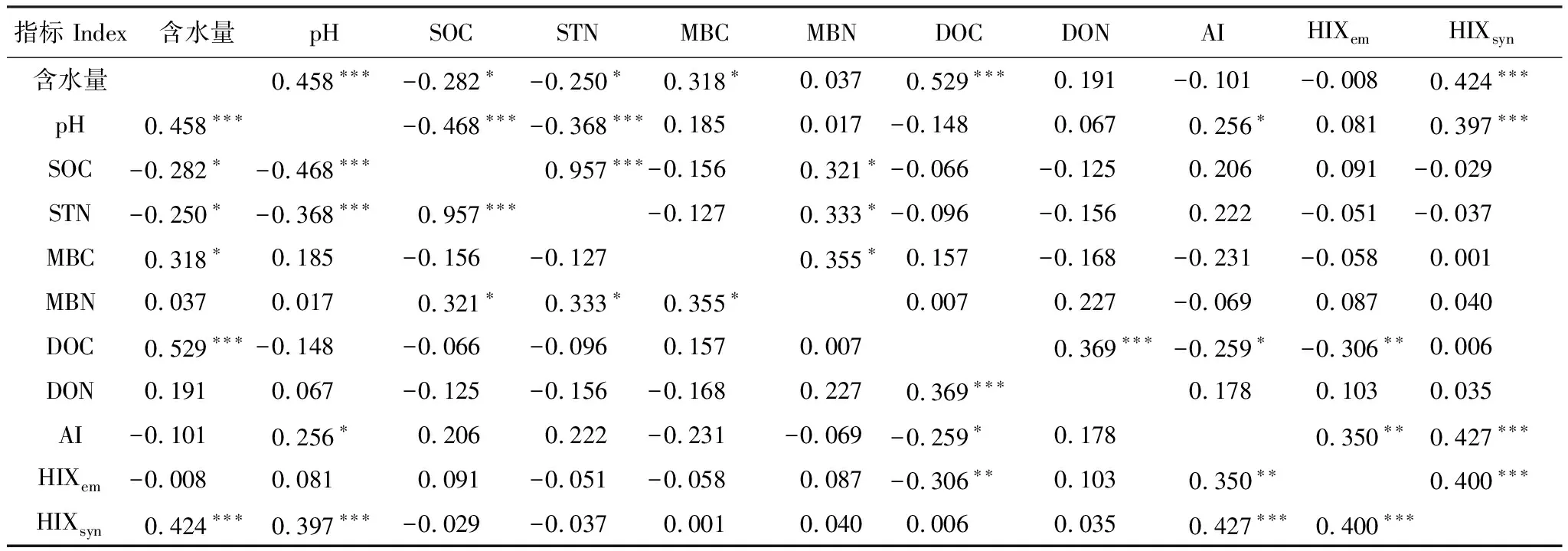
表3 各指标之间的相关性分析
SOC, 土壤有机碳, soil organic carbon; STN, 土壤总氮, soil total nitrogen; MBC, 微生物量碳, microbial biomass carbon; MBN, 微生物量氮, microbial biomass nitrogen; DOC,可溶性有机碳, dissolved organic carbon; DON, 可溶性有机氮, dissolved organic nitrogen; AI, 芳香性指数, aromaticity index; HIXem, 荧光发射光谱腐殖化指数, humification index, emission mode; HIXsym, 荧光同步光谱腐殖化指数, humification index, synchronous mode; *,P< 0.05; **,P<0.01;***,P<0.001
5 结论
温度和水分是重要的生态因子,对森林生态系统的功能起着重要作用。增温加速水分蒸发,隔离降雨通过限制外源雨水的输入降低土壤含水量,因此增温对表层土壤水分的影响较大,而隔离降雨对下层土壤水分的影响较大。土壤水分的改变直接影响土壤DOC的数量和质量、植物根系分泌物的产生以及土壤微生物的丰度。DOC和MBC是本试验调控SOC含量变化的重要因子。增温处理含较多易分解的DOM,因此SOC的含量低。隔离降雨的影响具有季节性,在旱季不利于植物的生长,并抑制微生物的活性,而在雨季,隔离降雨处理的土壤DOC和MBC明显提升。增温及隔离降雨的交互作用在一定程度上增加了土壤DOM的数量,但由于土壤的微生物活性降低,因此减缓SOC的分解。与对照相比,单独增温或隔离降雨处理并不利于SOC的固持。但是由于野外条件相对复杂,试验周期短,未来会长期观测各处理土壤的有机质及微生物等的变化,以深入了解在未来全球气候变化背景下,温度和水分对森林生态系统C、N循环的影响。
参考文献(References):
[1] Chassé A W, Ohno T, Higgins S R, Amirbahman A, Yildirim N, Parr T B. Chemical force spectroscopy evidence supporting the layer-by-layer model of organic matter binding to iron (oxy)hydroxide mineral surfaces. Environmental Science & Technology, 2015, 49(16): 9733- 9741.
[2] Bolan N S, Adriano D C, Kunhikrishnan A, James T, McDowellR, SenesiN. Chapter one-dissolved organic matter: biogeochemistry, dynamics, and environmental significance in soils. Advances in Agronomy, 2011, 110: 1- 75.
[3] Kalbitz K, Solinger S, Park J H, Michalzik B, Matzner E. Controls on the dynamics of dissolved organic matter in soils: a review. Soil Science, 2000, 165(4): 277- 304.
[4] Nebbioso A, Piccolo A. Molecular characterization of dissolved organic matter (DOM): a critical review. Analytical and Bioanalytical Chemistry, 2013, 405(1): 109- 124.
[5] Roberts P, Gibbons J M, Hill P W, Jones D L,Farrell M. Limited effects of land use on soil dissolved organic matter chemistry as assessed by excitation-emission fluorescence spectroscopy and molecular weight fractionation. Soil Use and Management, 2016, 32(4): 662- 665.
[6] Kaiser K, Kalbitz K. Cycling downwards—dissolved organic matter in soils. Soil Biology and Biochemistry, 2012, 52: 29- 32.
[7] 周广胜, 王玉辉. 全球生态学. 北京: 气象出版社, 2003.
[8] Stocker T, Plattner G K, Dahe Q. IPCC climate change 2013: the physical science basis-findings and lessons learned//EGU General Assembly Conference. Washington, DC: EGU, 2014.
[9] 董思言, 高学杰. 长期气候变化——IPCC第五次评估报告解读. 气候变化研究进展, 2014, 10(1): 56- 59.
[10] Aronson E L, McNulty S G. Appropriate experimental ecosystem warming methods by ecosystem, objective, and practicality. Agricultural and Forest Meteorology, 2009, 149(11): 1791- 1799.
[11] Melillo J M, Steudler P A, Aber J D, Newkirk K, Lux H, Bowles F P, Catricala C, Magill A, Ahrens T, Morrisseau S. Soil warming and carbon-cycle feedbacks to the climate system.Science, 2002, 298(5601): 2173- 2176.
[12] Scott E E, Rothstein D E. The dynamic exchange of dissolved organic matter percolating through six diverse soils. Soil Biology and Biochemistry, 2014, 69: 83- 92.
[13] Fenner N, Freeman C, Lock M A, Harmens H, Reynolds B, Sparks T. Interactions between elevated CO2and warming could amplify DOC exports from peatland catchments. Environmental Science & Technology, 2007, 41(9): 3146- 52.
[14] Rinnan R, Michelsen A, Jonasson S. Effects of litter addition and warming on soil carbon, nutrient pools and microbial communities in a subarctic heath ecosystem.Applied Soil Ecology, 2008, 39(3): 271- 281.
[15] Fröberg M, Grip H, Tipping E, Svensson M, Strömgren M, Kleja DB. Long-term effects of experimental fertilization and soil warming on dissolved organic matter leaching from a spruce forest in Northern Sweden. Geoderma, 2013, 200- 201: 172- 179.
[16] Worrall F, Burt T. Time series analysis of long-term river dissolved organic carbon records. Hydrological Processes, 2004, 18(5): 893- 911.
[17] Evans C D, Monteith D T, Cooper D M. Long-term increases in surface water dissolved organic carbon: observations, possible causes and environmental impacts. Environmental Pollution, 2005, 137(1): 55- 71.
[18] Fenner N, Freeman C. Drought-induced carbon loss in peatlands. Nature Geoscience, 2011, 4(12): 895- 900.
[19] Dillon P J, Molot L A. Long-term trends in catchment export and lake retention of dissolved organic carbon, dissolved organic nitrogen, total iron, and total phosphorus: The Dorset, Ontario, study, 1978- 1998. Journal of Geophysical Research, 2005, 110(G1): G01002.
[20] Piao S L, Fang J Y, Ciais P, Peylin P, Huang Y, Sitch S, Wang T. The carbon balance of terrestrial ecosystems in China. Nature, 2009, 458(7241): 1009- 1013.
[21] Yang Y S, Guo J F, Chen G S, Yin Y F, Gao R, Lin C F. Effects of forest conversion on soil labile organic carbon fractions and aggregate stability in subtropical China. Plant and Soil, 2009, 323(1/2): 153- 162.
[22] 刘小飞, 林廷武, 熊德成, 林伟盛, 林成芳, 杨玉盛. 土壤增温及降雨隔离对杉木幼林林下植被生物量的影响. 亚热带资源与环境学报, 2014, 9(3): 92- 95.
[23] Wu J S, Jiang P K, Chang S X, Xu Q F, Lin Y. Dissolved soil organic carbon and nitrogen were affected by conversion of native forests to plantations in subtropical China. Canadian Journal of Soil Science, 2010, 90(1): 27- 36.
[24] Vance E D, Brookes P C, Jenkinson D S. Microbial biomass measurements in forest soils: the use of the chloroform fumigation-incubation method in strongly acid soils. Soil Biology and Biochemistry, 1987, 19(6): 697- 702.
[26] Zsolnay A, Baigar E, Jimenez M, Steinweg B, SaccomandiF. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying. Chemosphere,1999, 38(1): 45- 50.
[27] Bu X L, Ding J, Wang L, Yu X, Huang W, Ruana H H. Biodegradation and chemical characteristics of hot-water extractable organic matter from soils under four different vegetation types in the Wuyi Mountains, southeastern China. European Journal of Soil Biology, 2011, 47(2):102- 107.
[28] He X S, Xi B D, Wei Z M, Jiang YH, Geng CM, Yang Y, Yuan Y, Liu HL. Physicochemical and spectroscopic characteristics of dissolved organic matter extracted from municipal solid waste (MSW) and their influence on the landfill biological stability. Bioresource Technology, 2011, 102(3): 2322- 2327.
[29] Li D D, Li Y J, Liang J, Zhao CZ, Yin HJ, Yin CY, Cheng XY, Liu Q. Responses of soil micronutrient availability to experimental warming in two contrasting forest ecosystems in the Eastern Tibetan Plateau, China. Journal of Soils and Sediments, 2014, 14(6): 1050- 1060.
[30] Sun D D, Li YJ, Zhao W Q, Zhang ZL, Li DD, Zhao CZ, Liu Q. Effects of experimental warming on soil microbial communities in two contrasting subalpine forest ecosystems, eastern Tibetan Plateau, China. Journal of Mountain Science, 2016, 13(8): 1442- 1452.
[31] 黄昌勇, 徐建明. 土壤学. 北京: 中国农业出版社, 2010.
[32] Marschner B, Kalbitz K. Controls of bioavailability and biodegradability of dissolved organic matter in soils. Geoderma, 2003, 113(3/4): 211- 235.
[33] Laudicina V A, Palazzolo E, Badalucco L. Natural organic compounds in soil solution: potential role as soil quality indicators. Current Organic Chemistry, 2013, 17(24): 2991- 2997.
[34] Bu X L, Wang L M, Ma W B, Yu X N, McDowell W H, Ruan H H. Spectroscopic characterization of hot-water extractable organic matter from soils under four different vegetation types along an elevation gradient in the Wuyi Mountains. Geoderma, 2010, 159(1/2): 139- 146.
[35] Kalbitz K, Schmerwitz J, Schwesig D, Matzner E. Biodegradation of soil-derived dissolved organic matter as related to its properties. Geoderma, 2003, 113(3/4): 273- 291.
[36] Kiem R, Kögel-Knabner I. Contribution of lignin and polysaccharides to the refractory carbon pool in C-depleted arable soils. Soil Biology and Biochemistry, 2003, 35(1): 101- 118.
[37] Michel K, Matzner E, Dignac M F, Kögel-Knabner I. Properties of dissolved organic matter related to soil organic matter quality and nitrogen additions in Norway spruce forest floors. Geoderma, 2006, 130(3/4): 250- 264.
[38] 刘煜, 胡小飞, 陈伏生, 袁平成. 马尾松和苦槠林根际土壤矿化和根系分解CO2释放的温度敏感性. 应用生态学报, 2013, 24(6): 1501- 1508.
[39] Eamus D. Ecophysiological traits of deciduous and evergreen woody species in the seasonally dry tropics. Trends in Ecology & Evolution, 1999, 14(1): 11- 16.
[40] Meinzer F C, Andrade J L, Goldstein G, Holbrook N M, Cavelier J, Wright S J. Partitioning of soil water among canopy trees in a seasonally dry tropical forest. Oecologia, 1999, 121(3): 293- 301.
[41] 熊德成, 刘小飞, 陈仕东, 林伟盛, 林廷武, 林成芳, 陈光水, 杨玉盛. 土壤增温对杉木幼苗细根形态特征的影响. 亚热带资源与环境学报, 2014, 9(3): 89- 91.
[42] Chabbi A, Rumpel C. Organic matter dynamics in agro-ecosystems-the knowledge gaps. European Journal of Soil Science, 2009, 60(2): 153- 157.
[43] Kuzyakov Y, Friedel J K, Stahr K. Review of mechanisms and quantification of priming effects. Soil Biology and Biochemistry, 2000, 32(11/12): 1485- 1498.
[44] 袁淑芬, 汪思龙, 张伟东. 外源有机碳和温度对土壤有机碳分解的影响. 土壤通报, 2015, 46(4): 916- 922.
[45] 廖畅, 田秋香, 汪东亚, 曲来叶, 吴宇, 刘峰. 外源碳输入对中亚热带森林深层土壤碳矿化和微生物决策群落的影响. 应用生态学报, 2016, 27(9): 2848- 2854.
[46] Kuzyakov Y, Domanski G. Carbon input by plants into the soil. Review. Journal of Plant Nutrition and Soil Science, 2000, 163(4): 421- 431.
[47] Cross A, Sohi S P. The priming potential of biochar products in relation to labile carbon contents and soil organic matter status. Soil Biology and Biochemistry, 2011, 43(10): 2127- 2134.
[48] Mavi M S, Marschner P. Drying and wetting in saline and saline-sodic soils—effects on microbial activity, biomass and dissolved organic carbon. Plant and Soil, 2012, 355(1/2): 51- 62.

