单增李斯特菌CdaA的抗原表位分析及抗体的制备
孙静娟 邱景璇 曾海娟 丁承超 王广彬 李杰 王淑娟 刘箐
(1. 上海理工大学医疗器械与食品学院,上海 200093;2. 徐州绿健乳品饮料有限公司,徐州 221006)
单增李斯特菌是一种兼性厌氧细菌,同时也是胞内寄生菌,能够引起李斯特菌病。李斯特菌病的易感人群包括新生儿、孕妇、老年人和免疫受损的病人,感染死亡率极高[1-2]。单增李斯特菌广泛存在于自然环境中,可以在冷藏温度下生长繁殖,并能够在较宽泛的盐浓度、温度和pH值条件下生存,使得其在食品加工企业很难得到控制[3]。另外,单增李斯特菌能够黏附在食品加工器械上形成菌膜以逃避外界对它的杀伤,进而增加食品污染的可能性[4]。因此,能够准确高效地检出样品中单增李斯特菌就显得非常重要。
相关学者研究了单增李斯特菌cdaA的结构域分布及表达模式,并衍射出CdaA晶体结构[5-6]。cdaA编码的腺苷酸环化酶CdaA,催化线性二腺苷酸环化成环二腺苷酸(Cyclic di-adenosine monophosphate,c-di-AMP),c-di-AMP作为第二信使参与重要的细胞活动,包括细胞壁代谢、维持DNA完整性、离子通道、转录调节及酶的变构调节[7]。最重要的是,c-di-AMP作为分泌因子能刺激宿主细胞胞质反应,激发先天免疫的胞浆途径[8]。腺苷酸环化酶的过表达能引起宿主细胞在感染期间机体免疫反应增强。研究表明,多种不同的菌群都能产生c-di-AMP[9],海栖热袍菌中DNA完整性扫描蛋白质DisA首次发现腺苷酸环化酶[10]。除了DisA环化酶,枯草芽孢杆菌还依赖CdaA环化酶和CdaS环化酶协作调节c-di-AMP水平[11],但单增李斯特菌只有一种CdaA类型的环化酶协作调节c-di-AMP水平。环化酶CdaA缺失会导致细菌生长迟缓[12],因而CdaA在单增李斯特菌增殖过程中起到重要作用。
利用生物信息学工具从海量数据中筛选出来的单增李斯特菌cdaA具有种内保守、种间特异的特点,抗原表位预测显示CdaA具有良好的抗原表位,所以本研究对CdaA进行免疫学验证,以CdaA为检测靶标检测单增李斯特菌。CdaA的N端存在的跨膜区可能会使得CdaA的表达受阻,所以构建pET30a系统原核表达Δ100CdaA,Ni柱纯化后以Δ100CdaA为免疫原制备多克隆抗体和单克隆抗体,并测定了单抗的性质。本研究尝试用生物信息学筛选检测靶标并进行免疫学验证,旨为筛选合理的检测靶标提供新的思路及为检测单增李斯特菌奠定实践基础。
1 材料与方法
1.1 材料
1.1.1 菌种及培养条件 实验菌株均由上海理工大学微生物研究所提供(表1),所有菌株均在37℃用脑心浸液培养基(BHI)培养。

表1 33株实验李斯特菌
1.1.2 主要试剂 限制性内切酶购自大连宝生物工程有限公司;高保真酶试剂盒(Phanta®Max Super-Fidelity DNA Polymerase)和一步克隆试剂盒(One Step Cloning Kit)购自南京诺唯赞生物科技有限公司;一步法细菌活性蛋白提取试剂盒(One Step Bacterial Active Protein Extraction Kit)和His标签纯化柱(Ni-IDA-Sefinose Column)购自生工生物工程(上海)股份有限公司;琼脂糖割胶回收试剂盒(BioSpin Gel Extraction Kit)和质粒抽提试剂盒(BioSpin Plasmid DNA Extraction Kit)购自杭州博日科技生物有限责任公司;HAT培养基购自Sigma公司;96孔细胞培养板购自Costar公司;小鼠单抗亚型鉴定试剂盒购自洛阳佰奥通实验材料中心。
1.2 方法
1.2.1 系统进化树的构建 EGD-e菌株是研究单增李斯特菌的模式菌株,根据NCBI数据库上公布的单增李斯特菌EGD-e菌株上cdaA序列(Gene ID:984739)运用Primer3设计扩增cdaA的特异性引物F1-R1,引物信息见表2。引物均由生工生物工程(上海)股份有限公司合成。割胶回收PCR产物连接至pET30a载体,导入大肠杆菌DH5α感受态细胞中。抽提质粒,送上海华大基因科技有限公司测序,根据测序结果运用MEGA 5.0构建NJ进化树。

表2 引物信息
1.2.2 CdaA的生物信息学分析 运行综合性数据库NCBI上的ORF finder工具分析cdaA开放阅读框。运行ExPASy的ProtParam程序分析预测CdaA的理化性质[13]。运行SignalP4.1 Server程序预测CdaA是否含有信号肽及其剪切位点。运行TMHMM Server v.2.0程序预测CdaA是否为膜上蛋白及其跨膜区域。运行DNAstar 软件的 protean程序预测CdaA的线性抗原表位[14-17];运行SEPPA 2.0程序预测CdaA的空间抗原表位[18-19]。
1.2.3 原核表达与纯化
1.2.3.1 引物设计 前期实验发现CdaA的诱导表达效果不明显,优化诱导条件也不能提高表达水平,考虑到CdaA的跨膜区会阻碍原核表达,所以根据NCBI上公布的cdaA序列运用Primer3设计特异性引物F2-R2,用于扩增Δ300cdaA片段,即缺少形成跨膜区的第1-300 bp的基因片段,引物信息见表2。
1.2.3.2 Δ300cdaA的扩增与克隆 根据高保真酶试剂盒的推荐参数设置PCR反应程序:预变性 95℃ 3 min;变性95℃ 15 s,退火56℃ 15 s,延伸72℃ 45 s,35个循环;彻底延伸72℃ 5 min。PCR反应结束后,割胶回收Δ300cdaA片段并克隆至pET30a载体上,将pET30a-Δ300cdaA转化到DH5α感受态细胞中,PCR鉴定为阳性的菌落,抽提质粒送上海华大基因科技有限公司进行测序,将测序正确的重组质粒转化到大肠杆菌BL21(DE3)感受态细胞中。
1.2.3.3 Δ100CdaA的原核表达与可溶性分析 培养含pET30a-Δ300cdaA重组质粒的大肠杆菌BL21(DE3),37℃,200 r/min,培养至OD600nm为0.6时加入 IPTG 诱导 pET30a-Δ300cdaA表达 Δ100CdaA,IPTG终浓度0.1 mmol/L,诱导时间4 h。诱导完成后,采用一步法细菌活性蛋白提取试剂盒从大肠杆菌BL21(DE3)中提取可溶性蛋白,之后用8 mol/L尿素处理包涵体,SDS-PAGE和Western blotting鉴定重组蛋白的诱导表达情况。
1.2.3.4 Δ100CdaA的分离纯化 Δ100CdaA诱导表达完成后离心收集菌体,PBS缓冲液重悬菌体,使用超声破碎仪冰浴破碎菌体,离心弃去上清,用6 mol/L盐酸胍变性包涵体,参照Ni柱说明书纯化His标签重组蛋白并鉴定目的蛋白的纯化效果。
1.2.4 动物免疫 适应性饲养一周后,以纯化的Δ100CdaA为免疫原,采用背部皮下多点免疫的方式免疫动物,2 kg大耳兔的免疫剂量为1 mg蛋白;8周龄的小鼠的免疫剂量为60 μg的蛋白。初次免疫时弗氏完全佐剂与免疫原等体积混合乳化后免疫,之后免疫时使用弗氏不完全佐剂,间隔两周免疫一次[20]。
1.2.5 多克隆抗体效价测定及Western blotting 分析 三免后一周耳边缘取血,以纯化的Δ100CdaA包板,以梯度稀释的兔血清为一抗(稀释度为1∶1 000-1∶128 000),以HRP标记的山羊抗兔抗体为二抗,采用间接ELISA法检测血清中抗体水平[21]。溶菌酶-超声破碎-TCA-丙酮沉淀法提取单增李斯特蛋白[22],SDS-PAGE电泳并将蛋白条带印迹至NC膜上,以兔血清为一抗,以荧光标记的山羊抗兔抗体为二抗,使用双色红外荧光成像系统Odyssey扫描NC膜,分析多抗与单增李斯特菌提取蛋白的结合能力。
1.2.6 单克隆抗体的制备 三免后一周断尾采血,间接ELISA测定小鼠血清中特异性抗体水平。抗体效价最高的小鼠在冲击免疫后用于细胞融合。实验中以50% PEG(MW1500)作为诱导剂诱导小鼠脾细胞与SP2/0骨髓瘤细胞融合,用HAT培养基对杂交瘤细胞进行筛选,间接ELISA法测定孔板细胞培养液中抗体的效价,采用有限稀释法对阳性孔进行亚克隆,筛选出既由单个细胞分裂而成又能够稳定产生抗体的细胞株。将筛选的细胞株扩大培养,注射入小鼠腹腔诱导小鼠体内产生腹水,从而获得大量单克隆抗体。
1.2.7 单克隆抗体性质的测定
1.2.7.1 单克隆抗体的纯化 收集腹水,饱和硫酸铵沉淀法粗提抗体后,使用蛋白纯化仪protein G柱单抗精提,SDS-PAGE电泳测定抗体纯化效果。
1.2.7.2 单克隆抗体亚型测定及效价测定 采用间接ELISA法测定鼠源单克隆抗体的亚型,以1 000倍稀释的单抗为一抗,以6种HRP标记的山羊抗鼠抗体(IgG1、IgG2a、IgG2b、IgG3、IgM和IgA)为二抗,避光显色20 min后,蓝色孔对应的酶标二抗的亚型就是单抗的亚型。以梯度稀释的单抗为一抗(稀释度为1∶1 000-1∶512 000),以HRP标记的山羊抗鼠抗体为二抗,间接ELISA检测单抗的效价。
1.2.7.3 单克隆抗体特异性测定 培养单增李斯特菌(EGD-e、ATCC43251、ATCC13932、ATCC191-12、ATCC19114、ATCC19115、ATCC19116、ATCC-19117、CMCC 54002)、非致病李斯特菌(CICC216-72、CICC21663和CICC10297)、大肠杆菌O157∶H7(ATCC43895、ATCC43889)、金黄色葡萄球菌(ATCC27660)、鼠伤寒沙门氏菌(ATCC14028)、肠炎沙门氏菌(ATCC13076)、阪崎肠杆菌(ATCC29004)、福氏志贺氏菌(ATCC12022)共19株细菌。按溶菌酶-超声破碎-TCA-丙酮沉淀法提取细菌全蛋白,Western blotting法测定该单抗的特异性。
2 结果
2.1 进化树的构建及分析
实验室保存的26株李斯特菌基于cdaA建立NJ进化树,如图1所示,由进化树分析可知cdaA在单增李斯特菌中高度保守。将cdaA序列提交至NCBI上Nucleotide collection数据库进行比对,显示同源性>98%。
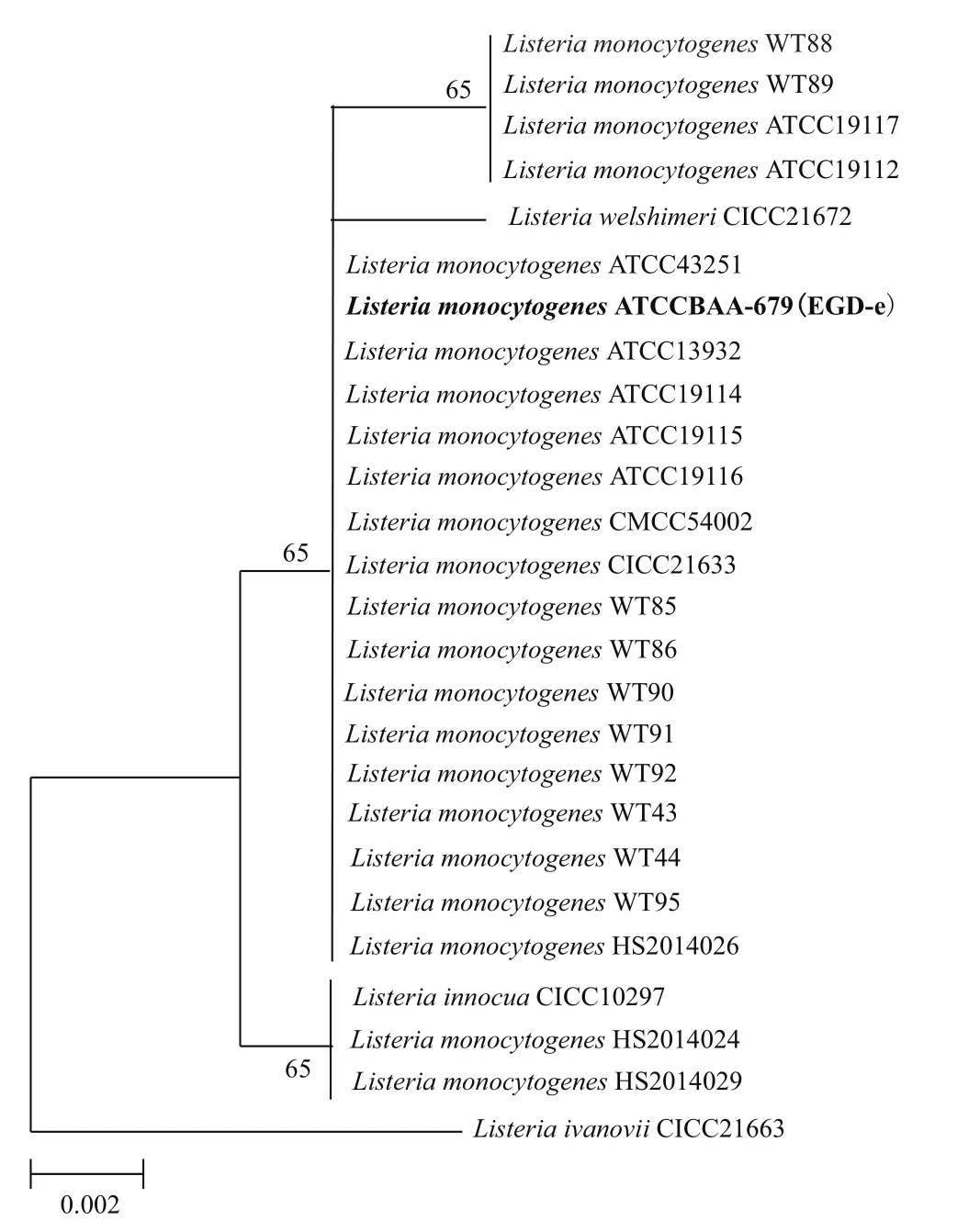
图1 基于cdaA核酸序列构建NJ进化树
2.2 CdaA的生物信息学分析
cdaA全长822 bp作为一个开放阅读框,编码273个氨基酸。经ProtParam 程序分析,CdaA分子量为30.44 kD,等电点理论值7.91,酸性氨基酸总数(Asp + Glu)为29个,碱性氨基酸总数(Arg +Lys)为30个,不稳定指数为40.83,属不稳定蛋白,脂肪族氨基酸指数为118.57,平均亲水系数为0.241,为疏水性蛋白,不可溶。
2.2.1 信号肽预测 如图2,表3所示,信号肽预测结果显示信号肽分值S平均值(mean S-score)<0.5[23],表明CdaA不存在信号肽片段,不是分泌蛋白。
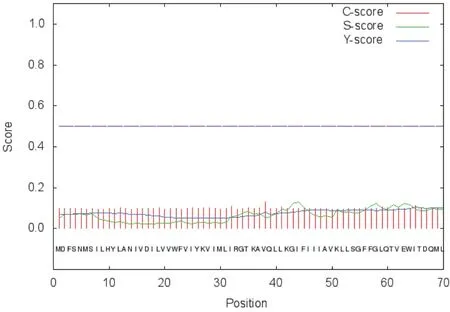
图2 CdaA信号肽预测

表3 CdaA信号肽预测的数值信息
2.2.2 跨膜结构预测 如图3,表4所示,跨膜预测结果表明CdaA 的N端大约前80个氨基酸肽链来回穿梭细胞膜存在两个跨膜区。
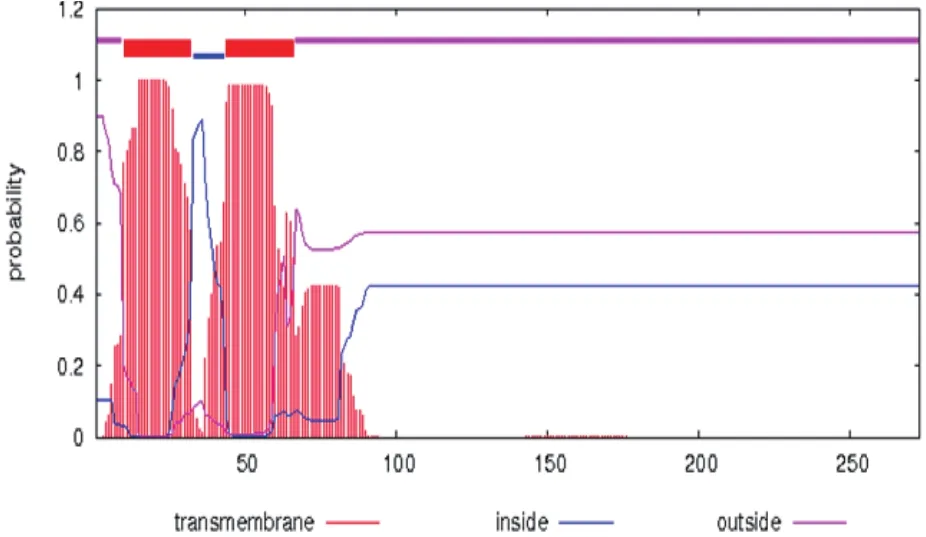
图3 CdaA跨膜结构预测

表4 CdaA跨膜结构预测的数值信息
2.2.3 线性抗原表位预测 运用DNAstar软件预测线性抗原表位的结果如图4所示,图上纵坐标表示抗原指数,得分大于0,则该位置容易形成抗原表位。可知大约前80个氨基酸不构成抗原表位,原因可能是这些氨基酸嵌入膜结构,未暴露出来构成抗原表位,与跨膜区域预测结果相符。
2.2.4 空间抗原表位预测 将CdaA空间结构数据提交至SEPPA2.0服务器预测空间抗原表位,0到1表示氨基酸打分,分值越高颜色越红,则表示该氨基酸越有可能成为抗原表位。如图5所示,红色区域裸露在外侧且分布相对集中,显示CdaA具有良好的空间抗原表位。
2.3 Δ300cdaA的扩增与pET30a-Δ300cdaA的鉴定
以单增李斯特菌EGD-e菌株为模板,以F2-R2为引物进行PCR扩增,扩增片段大小为522 bp,与预期片段大小一致(图6)。重组质粒鉴定结果如图7所示,在522 bp处出现阳性条带,与预期片段大小一致,说明Δ300cdaA克隆至pET30a载体上,并成功转化至大肠杆菌DH5α感受态细胞。测序结果与NCBI数据库公布的cdaA序列同源性100%。
2.4 Δ100CdaA的诱导表达与可溶性分析
SDS-PAGE结果(图8-A)显示,重组质粒pET30a-Δ300cdaA的诱导表达效果明显,在23 kD处有明显的蛋白条带,与预期大小一致,并且Δ100CdaA在BL21(DE3)菌体内以包涵体的形式存在。Western blotting结果(图8-B)显示在23 kD处呈现出特异性条带,表明该蛋白能与抗His抗体特异性结合,证实是Δ100CdaA。
2.5 Δ100CdaA的分离纯化
采用镍柱对Δ100CdaA 进行纯化,SDS-PAGE(图9-A)分析表明纯化效果明显,在23 kD 处出现蛋白条带;经Western blotting分析(图9-B)在23 kD处出现特异性条带,确实是Δ100CdaA。
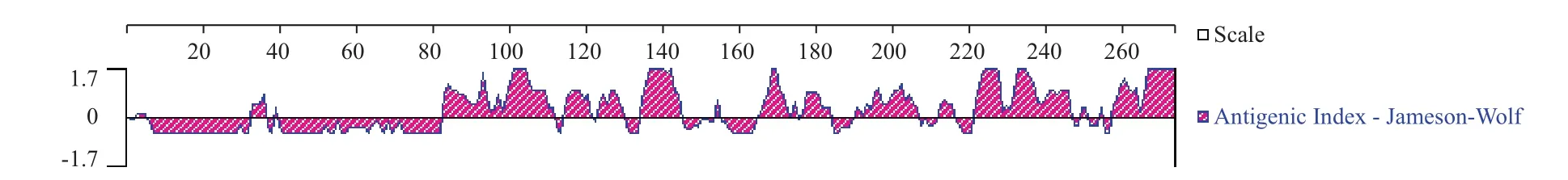
图4 CdaA线性抗原表位预测
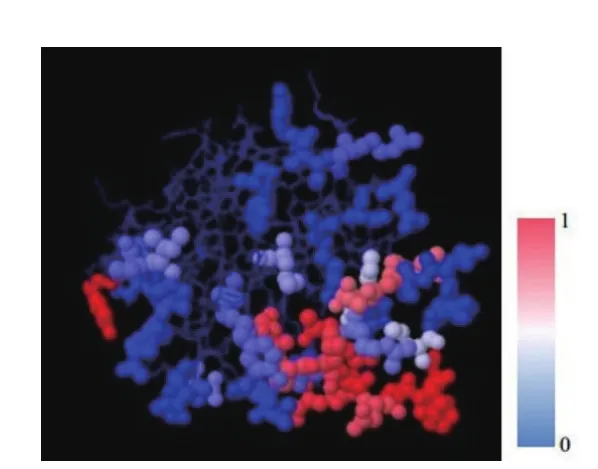
图5 CdaA空间抗原表位预测
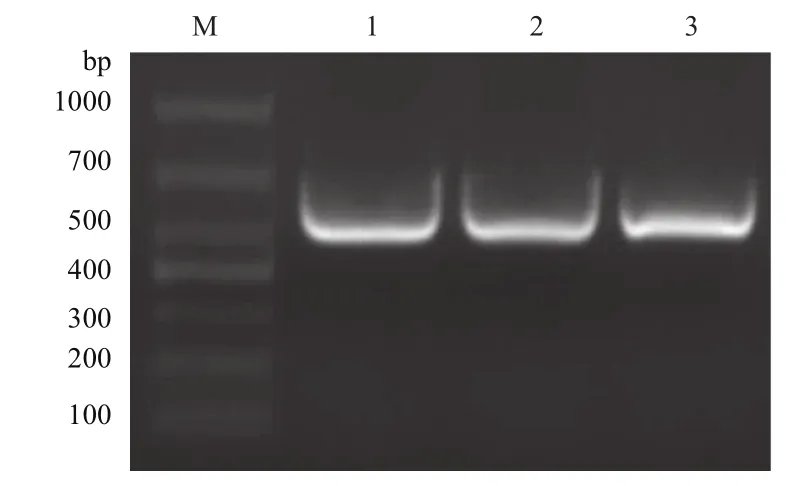
图6 Δ300cdaA的扩增
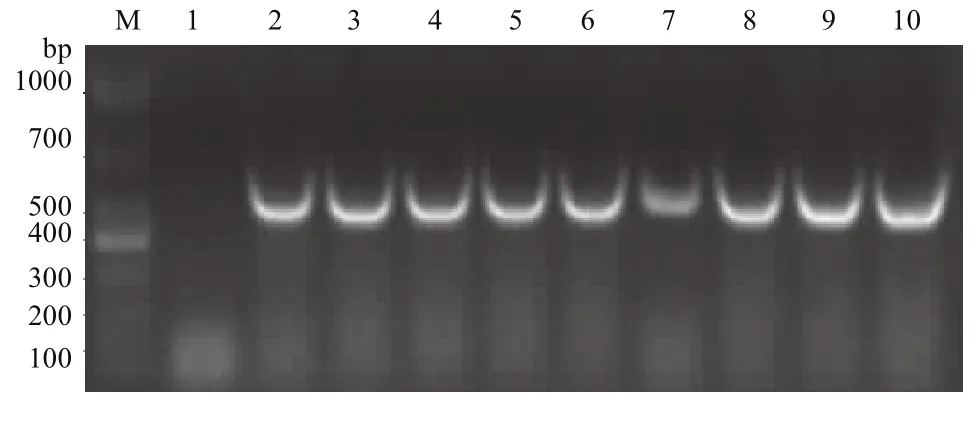
图7 重组质粒PCR鉴定
2.6 多克隆抗体效价的测定
采用间接ELISA法测兔血清效价,OD450nm值大于阴性对照的2.1倍即可认定为最终效价。由图10可知,以Δ100CdaA多次免疫大耳兔后,兔子血清抗体水平较高,效价可达到1∶128 000。

图8 Δ100CdaA的诱导表达及鉴定
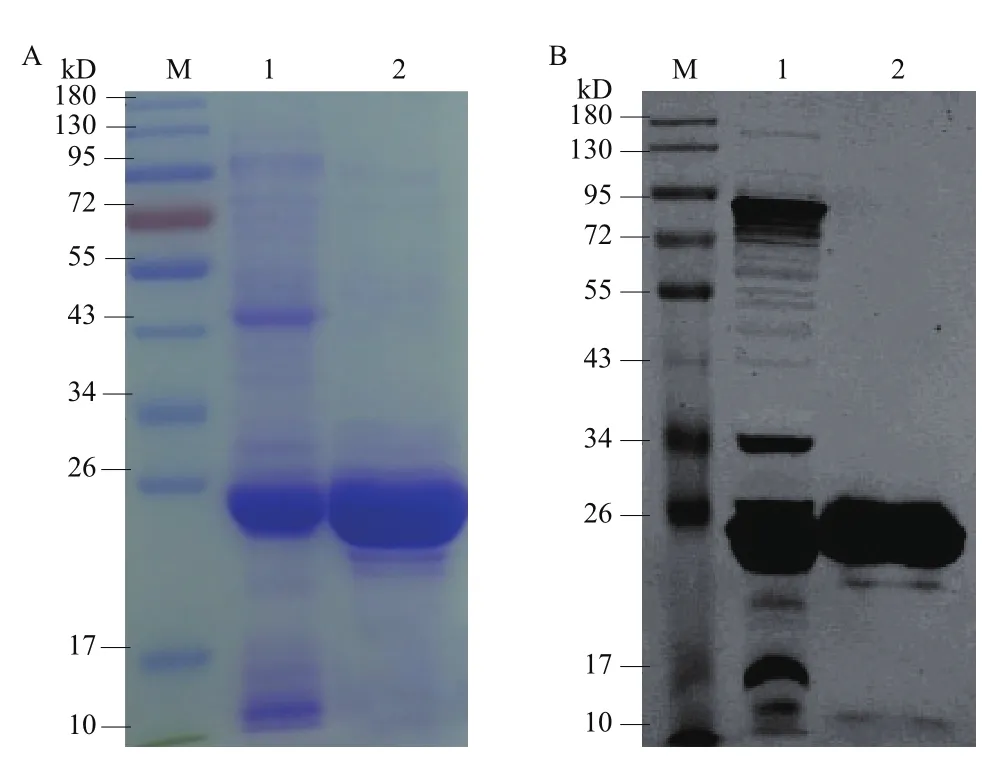
图9 Δ100CdaA的纯化及鉴定
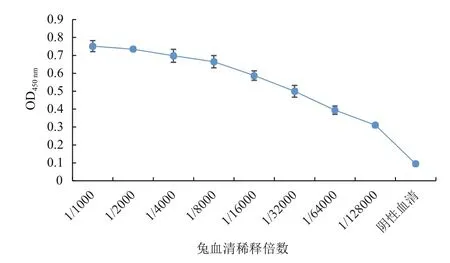
图10 兔子血清效价的测定
2.7 Western blotting检测单增李斯特菌
在单增李斯特菌中cdaA编码的CdaA分子量为30 kD,由图11可知,在大约30 kD的位置呈现出蛋白印迹,与预测大小相符,兔多抗可与从单增李斯特菌中提取的CdaA结合,表明已成功制备多抗,但是多抗与其他杂蛋白存在交叉,特异性有待提高。

图11 多抗检测单增李斯特菌
2.8 单克隆抗体的纯化
如图12所示,泳道1为饱和硫酸铵沉淀法粗提的单抗,泳道2为亲和层析柱纯化过程中的穿透液,在55 kD左右没有目标蛋白条带,表明在纯化过程中抗体没有丢失,泳道3为洗脱的单抗,在55 kD左右有一明显条带,为抗体的重链,在26 kD左右有一明显条带,为抗体轻链,除此之外没有杂带,表明纯化后单抗纯度较高。
2.9 单克隆抗体亚型的测定及效价测定
经细胞融合、有限稀释法筛选出一株杂交瘤细胞3F8F11C4D3,亚型测定结果(表5)显示抗体亚型为IgG2a。间接ELISA测定单克隆抗体的效价可达1∶512 000,如图13所示。

图12 单抗的纯化

表5 单抗亚型的测定
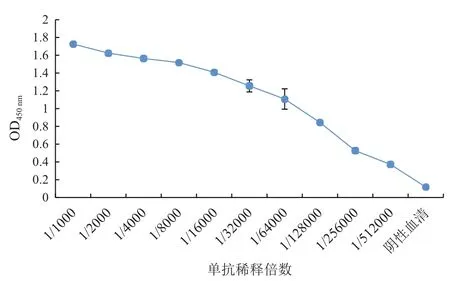
图13 单抗效价的测定
2.10 单克隆抗体特异性测定
Western blotting分析该单抗与9株单增李斯特菌、3株非致病李斯特菌以及大肠杆菌、金黄色葡萄球菌、沙门氏菌等7株其他菌种的交叉反应,结果如图14、图15所示,该单抗能够与9株致病性单增李斯特菌和2株非致病李斯特菌蛋白结合,并且与7株其他菌种的蛋白不存在交叉,因而,该抗体具有较好的特异性。
3 讨论
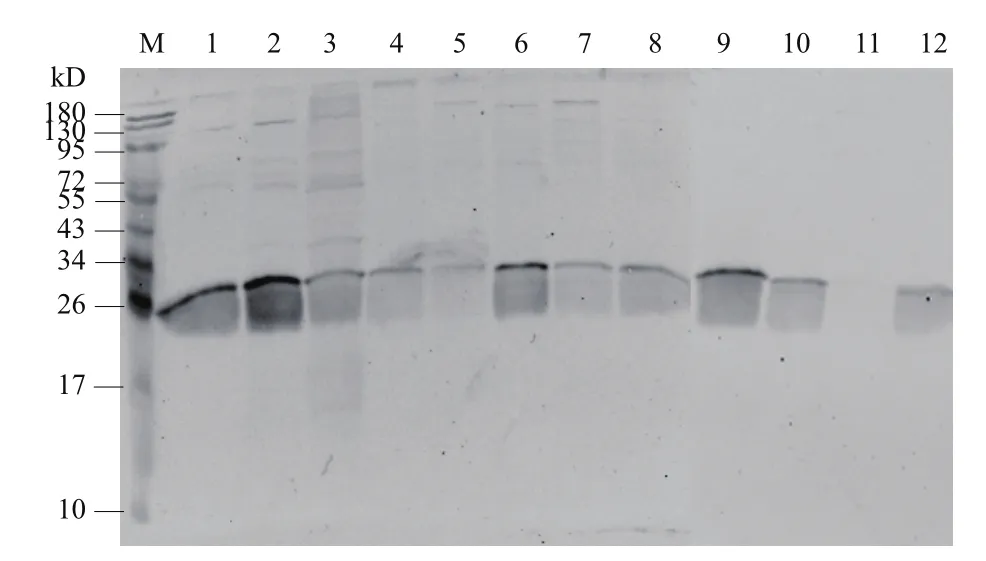
图14 单抗与李斯特菌的交叉反应结果
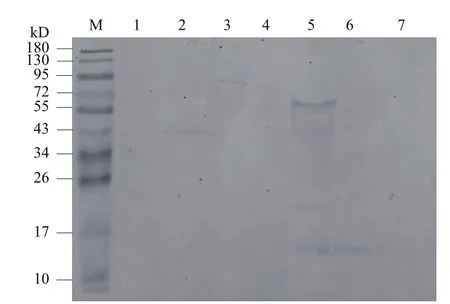
图15 单抗与其他致病菌的交叉反应结果
通过生物信息学的方法在数据库中筛选出单增李斯特菌中种内保守、种间特异的蛋白CdaA,然后用DNAstar软件和SEPPA2.0程序预测其具有良好的抗原表位,DNAstar 软件综合考虑二级结构、亲水性、柔韧性和表面可及性等多个因素预测线性抗原表位[24];SEPPA2.0程序是以蛋白三维结构为基础的预测空间抗原表位,但每种预测方法都有一定的局限性,加上体内免疫应答机制复杂,预测的抗原表位是否具有免疫原性还需要进一步免疫学验证。
前期原核表达CdaA效果不佳,优化诱导表达条件也不能提高蛋白表达量,这可能与N端存在跨膜区相关。跨膜蛋白在原核表达过程中受阻一方面是由于结构相对复杂性,镶嵌在膜中的蛋白质呈α螺旋结构;另一方面是由于功能多样性,膜蛋白作为离子通道具有一定的转运功能,也可作为信号分子具有传递信号的功能,为维持细胞内部稳定平衡,膜蛋白的合成可能受到严格调控[25-26]。跨膜区肽段嵌于膜内,呈α螺旋结构,结构规则且不易变形,决定了跨膜区氨基酸不易形成抗原表位。线性抗原表位预测显示CdaA的N端形成跨膜区的前100个氨基酸确实不易形成抗原表位,抗原表位多分布在非跨膜区,因而可采取分段表达的方式表达非跨膜区蛋白[27-28]。
在此基础上,原核表达了Δ100CdaA,以Δ100CdaA为免疫原制备的多抗效价可达1∶128 000,该多抗能够与从单增李斯特菌提取的CdaA结合,但是多抗本身具有多个结合位点,特异性有待提高。制备的单抗效价可达1∶512 000,能够检测9株单增李斯特菌和2株非致病李斯特菌,与大肠杆菌、肠炎沙门氏菌、金黄色葡萄球菌等7株其他致病菌无交叉,特异性较好。虽然制备的多克隆抗体和单克隆抗体不能直接结合单增李斯特菌,只能够通过提取细菌蛋白来检测单增李斯特菌,因而无法实现快速检测,但是这些不足是可以选择更合理的检测靶标及保持免疫原的空间结构解决。本研究对于用生物信息学筛选检测靶标以制备特异性高、广谱性好的单增李斯特菌抗体的这一想法具有重要现实意义。
4 结论
本研究通过构建cdaA进化树和序列比对发现该基因在单增李斯特菌中高度保守,运用生物信息学方法预测发现CdaA存在良好抗原表位,CdaA原核表达受阻可能与该蛋白N端存在跨膜区有关。原核表达并纯化了Δ100CdaA,Δ100CdaA蛋白具有良好的免疫原性,以Δ100CdaA制备的多抗效价可达1∶128 000,制备的单抗效价可达1∶512 000,多抗和单抗均可与从单增李斯特菌提取的CdaA结合,并且单抗具有良好的特异性。
[1]Donnelly CW.Listeria monocytogenes:a continuing challenge[J].Nutrition Reviews, 2001, 59(6):183-194 .
[2]Välimaa AL, Tilsala-Timisjärvi A, Virtanen E. Rapid detection and identification methods forListeria monocytogenesin the food chain[J]. Food Control, 2015, 55:103-114.
[3]Vongkamjan K, Fuangpaiboon J, Jirachotrapee S. Occurrence and diversity ofListeriaspp.in seafood processing plant environments[J]. Food Control, 2015, 50 :265-272.
[4]Kocot AM, Olszewska MA. Biofilm formation and microscopic analysis of biofilms formed byListeria monocytogenesin a food processing context[J]. LWT-Food Science and Technology, 2017,84:47-57.
[5]Rosenberg J, Dickmanns A, Neumann P. Structural and biochemical analysis of the essential diadenylate cyclase CdaA fromListeria monocytogenes[J]. J Biol Chem, 2015, 290(10):6596-6606.
[6]Rismondo J, Gibhardt J, Rosenberg J. et al. Phenotypes associated with the essential diadenylate cyclase CdaA and its potential regulator CdaR in the human pathogenListeria monocytogenes[J].J Bacteriol, 2015, 198(3):416-426.
[7]Commichau FM, Dickmanns A, Gundlach J. A jack of all trades:the multiple roles of the unique essential second messenger cyclic di-AMP[J]. Mol Microbiol, 2015, 97(2):189-204.
[8]Woodward JJ, Iavarone AT, Portnoy DA. C-di-AMP secreted by intracellularListeria monocytogenesactivates a host type I interferon response[J]. Science, 2010, 328(5986):1703-1705.
[9]Corrigan RM, Gründling A. Cyclic di-AMP :another second messenger enters the fray[J]. Nature Reviews Microbiology, 2013,11(8):513- 524.
[10]Witte G, Hartung S, Büttner K. Structural biochemistry of a bacterial checkpoint protein reveals diadenylate cyclase activity regulated by DNA recombination intermediates[J]. Molecular Cell, 2008, 30(2):167-178.
[11]Mehne FM, Gunka K, Eilers H. Cyclic-di-AMP homeostasis in Bacillus subtilis:both lack and high level accumulation of the nucleotide are detrimental for cell growth[J]. Journal of Biological Chemistry, 2013, 288(3):2004-2017.
[12]Witte CE, Whiteley A T, Burke T P, et al. Cyclic di-AMP is critical forListeria monocytogenesgrowth, cell wall homeostasis, and establishment of infection[J]. MBio, 2013, 4(3):e00282-13.
[13]王芬, 王海龙, 殷丽天, 等. 刚地弓形虫磷酸甘油酸酯变位酶2基因编码蛋白主要特性与抗原表位的生物信息学分析[J].中国病原生物学杂志, 2010, 5(11):840-843.
[14]胡纯秋, 高金燕, 罗春萍, 等. 花生过敏原Ara h2. 02二级结构和B细胞抗原表位预测[J]. 食品科学, 2009, 30(21):13-15.
[15]朱盼, 陈红兵, 胡纯秋, 等. 基于表位预测的花生过敏原Ara h6免疫交叉反应性研究[J]. 食品科学, 2010, 31(17):318-322.
[16]李江英, 白雪娟, 梁艳, 等. 用DNAStar软件预测Rv1410c结核分枝杆菌蛋白抗原表位[J]. 细胞与分子免疫学杂志,2015, 31(4):474-477.
[17]朱丹丹, 段义农, 陈金铃. 卡氏肺孢子虫kexin蛋白抗原表位预测[J]. 现代预防医学, 2011, 38(6):1077-1079.
[18]Qi T, Qiu TY, Zhang QC, et al. SEPPA 2. 0-more refined server to predict spatial epitope considering species of immune host and subcellular localization of protein antigen[J]. Nucleic Acids Research, 2014, 42(W1):59-63.
[19]Sun J, Wu D, Xu TL, et al. SEPPA:a computational server for spatial epitope prediction of protein antigens[J]. Nucleic Acids Research, 2009, 37:W612-W616.
[20]任晓峰, 贾文龙. 猪流行性腹泻病毒S1蛋白截短表达及多抗制备[J]. 东北农业大学学报, 2013, 44(9):46-50+2.
[21]李志清, 向军俭, 李雨辰, 等. 单增李斯特菌InternalinA的表达、纯化及多克隆抗体的制备[J]. 微生物学通报, 2012, 39(4):495-502.
[22]徐宗凯, 林青青, 周梦莹, 等. 三种李斯特菌菌体蛋白提取方法的比较[J]. 生命科学研究, 2015, 19(1):29-33.
[23]吴祖建, 高芳銮, 沈建国. 生物信息学分析实践[M]. 北京:科学出版社, 2010:112-116.
[24]李晋涛, 陈正琼, 梁志清, 等. Eppin抗原的二级结构分析B细胞表位预测[J]. 第三军医大学学报, 2008, 30(24):2254-2257.
[25]廖丹, 谢建平, 王洪海. 结核分枝杆菌膜蛋白的异源表达与纯化研究进展[J]. 微生物学报, 2007, 47(5):932-936.
[26]左利民, 康艳晶, 罗施中. α-螺旋跨膜蛋白的折叠和自组装[J]. 科学通报 , 2010, 55(15):1426- 1437.
[27]岳丽琴, 周育森, 张庶民, 等. B族链球菌C5a肽酶表位的预测、分段表达及其免疫原性[J]. 中国生物制品学杂志, 2010, 23(5):460-465.
[28]谢乐新, 李淼, 宋帅, 等. 副猪嗜血杆菌外膜蛋白P5的分段表达及免疫学性质分析[J]. 华北农学报, 2013(5):48-52.

