NOB1调控Wnt/ β-catenin信号通路影响膀胱癌细胞凋亡的实验研究
胡国森,吴晓杰
(河南科技大学第二附属医院泌尿外科,河南洛阳 471000)
膀胱癌在中国泌尿生殖系统恶性肿瘤中的发病率排名第1,其发病率在世界范围内的全部恶性肿瘤中位居第7位,手术治疗、放化疗等是目前膀胱癌治疗的主要方法,随着人们对肿瘤发病机制的不断探索,靶向基因治疗肿瘤逐渐成为肿瘤治疗的重点[1-2]。酵母基因Noblp人类同源基因(nin ond bind protein,NOB1)与核糖体形成和溶酶体的合成有关,是一种与核糖体装配有关的蛋白,其在人体组织中表达水平不同,在肺组织、肝脏等中表达水平较高,而在结肠、肾脏等组织中表达水平较低[3]。近年来的研究显示,NOB1参与恶性肿瘤的发生,在肿瘤组织中表达上调,而人为的下调肿瘤细胞中NOB1表达后,胶质瘤、结肠癌等癌细胞的增殖能力降低,凋亡水平升高[4-5]。Wnt/β-catenin是Wnt多种信号通路中的经典信号通路,参与肿瘤的发展,与细胞的凋亡等有关,参与细胞内多种癌基因或者是抑癌基因生物学功能的作用过程[6-7]。本研究以膀胱癌细胞为研究对象,下调细胞中NOB1的表达,探讨NOB1在膀胱癌细胞凋亡中的作用及机制,以期为靶向NOB1治疗膀胱癌提供理论基础。
1 材料与方法
1.1材料膀胱癌BIU-87细胞购自于上海信裕生物科技有限公司;PrimeScript RT reagent Kit、SYBR Permix Ex TaqⅡ荧光定量PCR试剂盒购自于大连Takara;RNA simple总RNA提取试剂盒购自于北京天根;BCA Protein Assay Kit购自于碧云天;Annexin V 凋亡检测试剂盒(FITC/PI双染法)购自于上海生工;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)一抗、β-连环蛋白(β-catenin)一抗购自于美国Cell Signaling CST;细胞周期蛋白D1(Cyclin D1)一抗购自于美国Abcam;甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗购自于美国Sigma;NOB1 siRNA和siRNA control由山东维真构建;NOB1、GAPDH引物由上海生工合成;Lipofectamine2000购自于美国Thermo;Wnt/β-catenin抑制剂XAV939购自于美国StemRD;电化学发光(Electro-Chemi-Luminescence,ECL)发光试剂盒购自于碧云天。
1.2细胞培养及转染膀胱癌BIU-87细胞用含有10%胎牛血清的RPMI1640培养,在饱和湿度、37℃、5% CO2培养箱中培养,0.25%胰蛋白酶消化。BIU-87细胞培养至对数期后,用Lipofectamine2000分别在细胞中转染NOB1 siRNA、siRNA control,并命名为干扰组、阴性组,同时以不做转染的细胞为对照组。
1.3qRT-PCR检测NOB1水平对照组、阴性组、干扰组转染后培养2 d,收集细胞,提取细胞RNA,步骤参照RNA simple总RNA提取试剂盒。反转录合成cDNA,用SYBR Permix Ex TaqⅡ试剂盒进行PCR反应。反应条件为:95℃预变性30s,(95℃ 5 s,60℃ 30 s)×40个循环。内参为GAPDH,2-△△Ct法分析NOB1水平。NOB1 F:5′-GAAAGAACAACGCCCTGGAG-3′,R:5′-CAGCCTTGAGATGACCTAAGC-3′。GAPDH F:5′-CG GAGTCAACGGATTTGGTCGTAT-3′,R:5′-AGC CTTCTCCATGGTGGTGAAGAC-3′。
1.4Westernblot检测NOB1水平对照组、阴性组、干扰组转染后培养2 d,提取细胞蛋白,用BCA Protein Assay Kit对蛋白样品进行定量。在蛋白样品中加入1/4体积的5×上样缓冲液,煮沸5 min。选用10%的分离胶和5%的浓缩胶进行电泳。蛋白上样量为50 μg,80 V电压观察上样缓冲液进入到分离胶和浓缩胶的交界处,把电压升高到120 V,待蛋白marker彻底分离后,停止电泳。转膜:90 V 转膜60 min。将膜放在5%脱脂奶粉中,摇床孵育60 min。按照NOB1一抗1∶800稀释、GAPDH一抗1∶1 000稀释,将膜放在一抗中,4℃孵育过夜。1∶2 000稀释山羊抗兔二抗,室温孵育60 min。ECL发光后,用Quantity-One分析条带的吸光度值,以GAPDH为内参进行半定量分析。
1.5流式细胞术检测细胞凋亡对照组、阴性组、干扰组转染后培养2 d,加入500 μL的Binding Buffer混合后,加入5 μL的碘化丙啶(propidium iodide,PI)和膜联蛋白 V-FITC(annexin V-FITC),避光反应15 min。在1 h内用流式细胞仪检测细胞凋亡情况。同时收集培养2 d的对照组、阴性组、干扰组细胞,Western blot检测细胞中Cleaved Caspase-3和Wnt/β-catenin信号通路关键蛋白β-catenin、cyclinD1水平,步骤同1.4。Cleaved Caspase-3一抗1∶600稀释、β-catenin一抗1∶1 000稀释、Cyclin D1一抗1∶800稀释。
1.6抑制Wnt/β-catenin信号通路对膀胱癌细胞凋亡的影响干扰组细胞加入10μmol/L的Wnt/β-catenin抑制剂XAV939记为干扰+XAV939组,培养2 d后,流式细胞术检测细胞凋亡,Western blot检测Cleaved Caspase-3、β-catenin、CyclinD1蛋白水平,步骤同1.4和1.5。

2 结 果
2.1NOB1siRNA降低细胞中NOB1mRNA和蛋白水平阴性组细胞中NOB1 mRNA和蛋白水平与对照组相比差异均没有统计学意义(P>0.05)。干扰组细胞中NOB1 mRNA和蛋白水平与对照组相比明显降低,差异具有统计学意义(P<0.05)。NOB1 siRNA可以下调膀胱癌细胞中NOB1水平(图1、表1)。
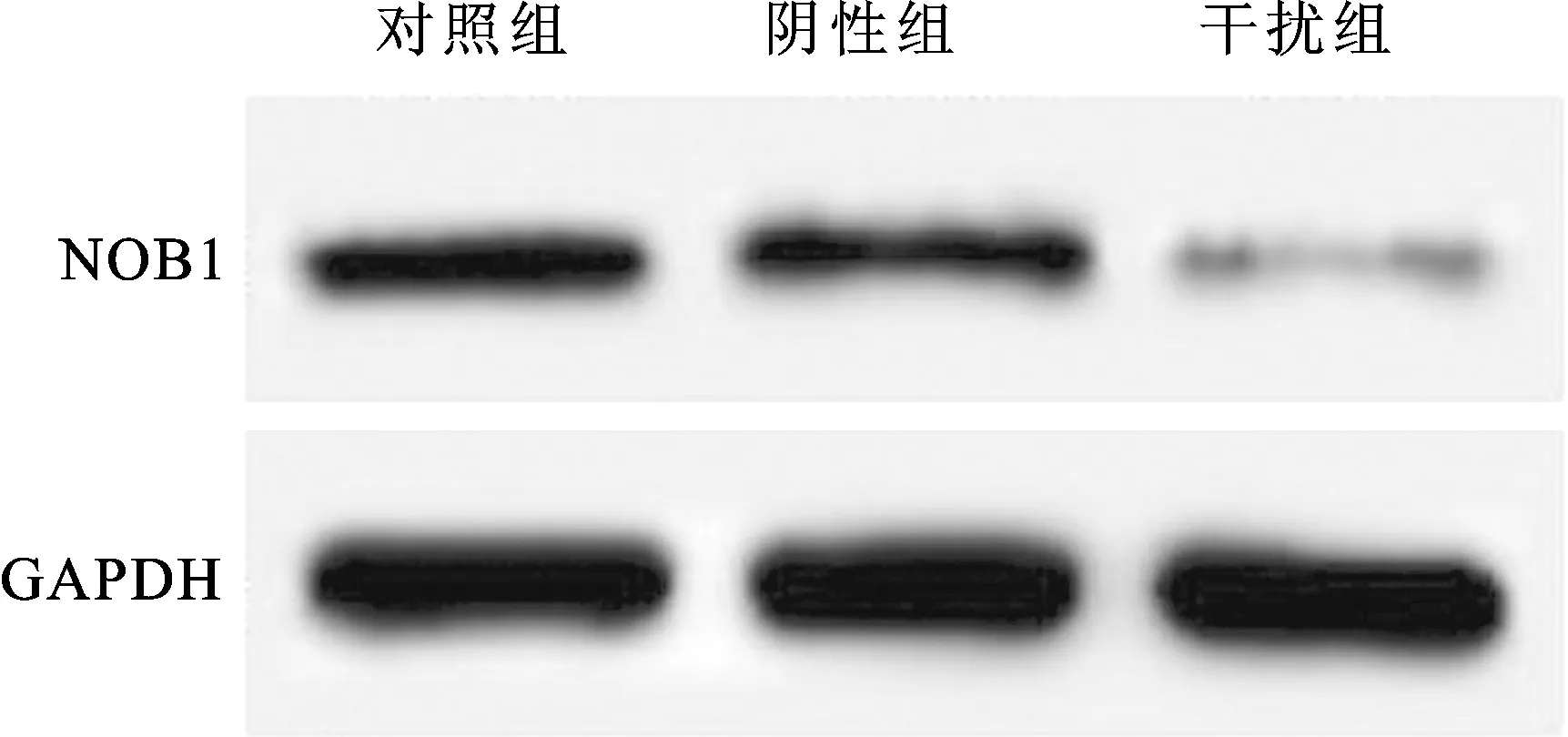
图1Westernblot检测NOB1siRNA降低细胞中蛋白表达
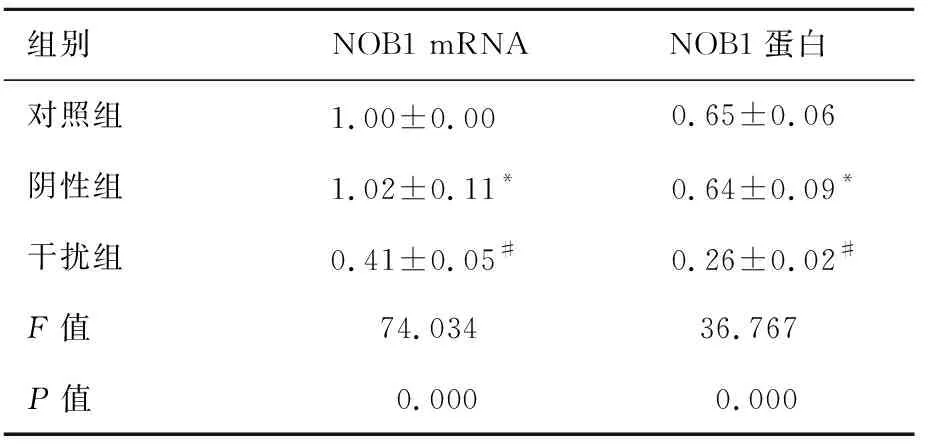
组别 NOB1 mRNANOB1蛋白对照组 1.00±0.00 0.65±0.06阴性组 1.02±0.11* 0.64±0.09*干扰组 0.41±0.05# 0.26±0.02#F值74.03436.767P值0.0000.000
注:与对照组比,t1=0.351,t2=0.193,*P>0.05;与对照组比,t1=10.358,t2=7.521,#P<0.05。
2.2下调NOB1促进Caspase-3介导的细胞凋亡阴性组细胞凋亡率和Cleaved Caspase-3水平与对照组相比差异均没有统计学意义(P>0.05)。干扰组细胞凋亡率和Cleaved Caspase-3水平与对照组相比明显升高,差异具有统计学意义(P<0.05)。下调NOB1促进膀胱癌细胞凋亡,诱导膀胱癌细胞中Caspase-3活化(图2、表2)。
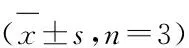
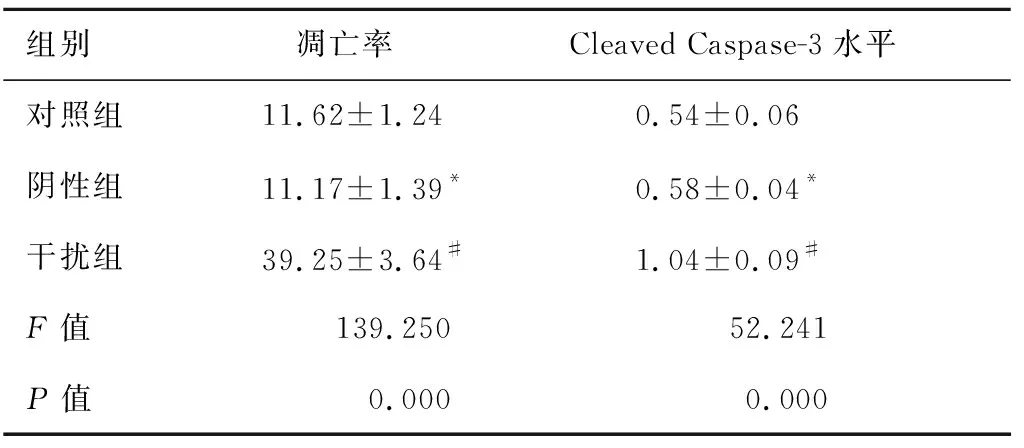
组别 凋亡率Cleaved Caspase-3水平对照组11.62±1.24 0.54±0.06阴性组11.17±1.39* 0.58±0.04*干扰组39.25±3.64# 1.04±0.09#F值139.25052.241P值0.0000.000
注:与对照组比,t1=0.234,t2=0.736,*P>0.05;与对照组比,t1=14.334,t2=9.197,#P<0.05。

图2 下调NOB1促进Caspase-3介导的细胞凋亡
2.3下调NOB1抑制Wnt/β-catenin信号通路激活阴性组细胞β-catenin、Cyclin D1水平与对照组相比差异均没有统计学意义(P>0.05)。干扰组细胞β-catenin、Cyclin D1水平与对照组相比明显降低,差异具有统计学意义(P<0.05)。下调NOB1降低膀胱癌细胞中β-catenin、Cyclin D1表达水平,抑制Wnt/β-catenin信号通路激活(图3、表3)。
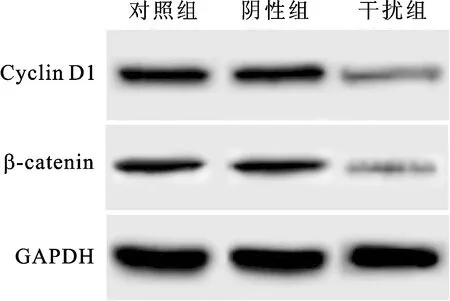
图3Westernblot检测下调NOB1细胞中Wnt/β-catenin信号通路关键蛋白的表达
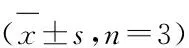
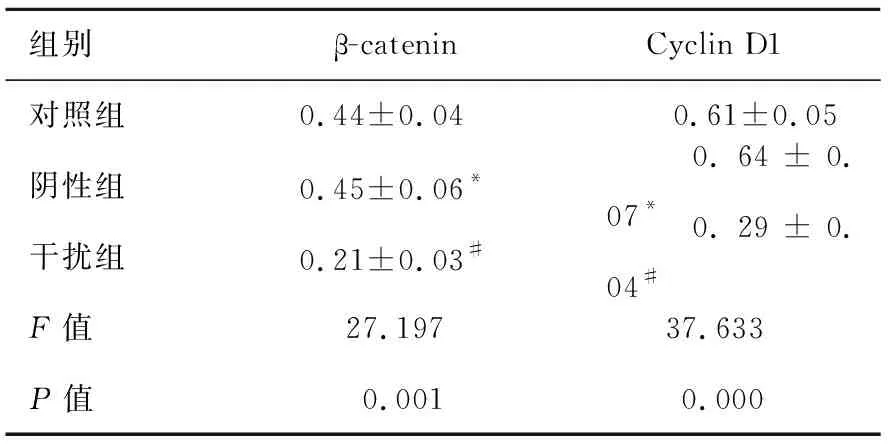
组别β-cateninCyclin D1对照组0.44±0.04 0.61±0.05阴性组0.45±0.06* 0.64±0.07*干扰组0.21±0.03# 0.29±0.04#F值27.19737.633P值0.0010.000
注:与对照组比,t1=0.272,t2=0.671,*P>0.05;与对照组比,t1=6.247,t2=7.155,#P<0.05。
2.4Wnt/β-catenin抑制剂XAV939促进细胞凋亡干扰+XAV939组细胞凋亡率和Cleaved Caspase-3水平与干扰组相比明显升高,差异具有统计学意义(P<0.05)。Wnt/β-catenin抑制剂XAV939促进NOB1下调诱导的膀胱癌细胞凋亡,下调NOB1和抑制Wnt/β-catenin信号通路具有协同作用,均能够促进膀胱癌细胞凋亡(图4、表4)。

图4Wnt/β-catenin抑制剂XAV939对细胞凋亡影响
A:流式细胞术检测细胞凋亡;B:Western blot检测细胞中Cleaved Caspase-3水平。
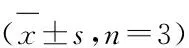

组别凋亡率Cleaved Caspase-3水平干扰组35.26±3.170.95±0.08干扰+XAV939组47.72±3.94#1.37±0.12#
注:与干扰组比,t1=4.268,t2=5.044,#P<0.05。
2.5Wnt/β-catenin抑制剂XAV939下调β-catenin、CyclinD1蛋白水平干扰+XAV939组细胞β-catenin、Cyclin D1水平与干扰组相比明显降低,差异具有统计学意义(P<0.05)。Wnt/β-catenin抑制剂XAV939能够进一步降低NOB1下调对β-catenin、Cyclin D1的抑制作用,下调NOB1和Wnt/β-catenin抑制剂XAV939具有协同作用,均能够抑制膀胱癌细胞中Wnt/β-catenin信号通路的激活(图5、表5)。

图5 Western blot检测抑制Wnt/β-catenin信号通路后细胞中β-catenin、Cyclin D1蛋白的水平
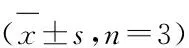

组别β-cateninCyclin D1干扰组0.26±0.040.31±0.04干扰+XAV939组0.15±0.02#0.12±0.03#
注:与干扰组比,t1=4.260,t2=6.582,#P<0.05。
3 讨 论
NOB1基因有8个内含子、9个外显子,位于16号染色体上,其编码的蛋白质由412个氨基酸组成,在其N端含有一个PIN结构,该结构由100个氨基酸组成,在其C端含有一个锌带结构,PIN结构与核糖体蛋白的生成有关,锌带结构参与基因转录过程[8-9]。NOB1在处于生长期的细胞中大量表达,而在静止的细胞中几乎不表达,当细胞进入静止期时,NOB1蛋白能够被26S蛋白酶体分解[10-13]。后续的研究报道表明,NOB1还参与40S核糖体的转运,其PIN结构还可以与RNA酶结合,除此以外,NOB1在骨肉瘤等肿瘤细胞周期、增殖、凋亡等过程中均具有重要作用[14-17]。黄伟翼等[18]的研究显示,下调NOB1表达后的乳腺癌细胞恶性程度降低。本研究在膀胱癌细胞中转染了NOB1小干扰RNA,并通过qRT-PCR和Western blot结果验证成功构建了NOB1下调的膀胱癌细胞,通过流式细胞术检测发现,下调NOB1后的膀胱癌细胞凋亡率下降,说明抑制NOB1可以诱导膀胱癌细胞凋亡,这与之前的研究报道相符合,说明NOB1表达下调后抑制肿瘤发展。
Caspase与细胞凋亡有关,该蛋白家族含有多个蛋白成员,根据在级联反应中的作用可以分为凋亡起始因子、执行因子等,Caspase-3是Caspase级联反应的凋亡执行因子,正常状态下,Caspase-3没有活性,以酶原的形式存在,当受到相关因子刺激后,活化水平升高,促进细胞凋亡的发生,Caspase-3活化也是细胞凋亡进入不可逆阶段的标志[19]。本研究结果显示,下调NOB1表达后的膀胱癌细胞中Caspase-3活化水平升高,说明下调NOB1可以诱导Caspase-3介导的细胞凋亡。
Wnt/β-catenin在胚胎发育、细胞内环境稳定维持等过程中具有重要作用,是Wnt中经典的信号通路,该信号通路包含低脂密度蛋白受体相关蛋白、卷曲蛋白、β-catenin等多个组成部分,其中β-catenin是关键蛋白,β-catenin在正常的细胞中与细胞膜上的E-cadherin形成复合物,该复合物能够被糖原合成激酶、酪蛋白酶等降解,当Wnt/β-catenin信号通路被激活后,糖原合成激酶、酪蛋白酶等活性降低,导致β-catenin不能被及时降解,积累在细胞质中的β-catenin进入细胞核,促进下游靶基因cyclinD1的表达[20-21]。研究显示,Wnt/β-catenin在膀胱癌组织中过度激活,肿瘤组织中β-catenin、Cyclin D1水平升高,用Wnt/β-catenin抑制剂处理肿瘤细胞,细胞的生长能力降低,细胞凋亡增多[22-23]。本研究结果显示,下调NOB1后膀胱癌细胞中β-catenin、Cyclin D1水平下降,Wnt/β-catenin信号通路被抑制,用Wnt/β-catenin抑制剂作用后,细胞凋亡水平更高,说明Wnt/β-catenin抑制剂和下调NOB1具有协同作用。
我们的实验证明,下调NOB1可以通过抑制Wnt/β-catenin信号通路促进膀胱癌细胞凋亡,促进膀胱癌细胞中Caspase-3的活化,为研究NOB1在肿瘤中的作用提供了理论依据,对于研究肿瘤的发病机制具有重要意义。靶向基因治疗具有准确性高、安全等优点,NOB1可能是治疗膀胱癌的潜在靶点。
参考文献:
[1] LEVIN D,BELL S,SUND R,et al.Pioglitazone and bladder cancer risk:a multipopulation pooled,cumulative exposure analysis[J].Diabetologia,2015,58(3):493-504.
[2] KURTOVA A V,XIAO J,MO Q,et al.Blocking PGE2-induced tumour repopulation abrogates bladder cancer chemoresistance[J].Nature,2015,517(7533):209-213.
[3] LIU K,GU M M,CHEN HL,et al.NOB1 in non-small-cell lung cancer:expression profile and clinical significance[J].Pathol Oncol Res Por,2014,20(2):461-466.
[4] 贺孝文,陶峰,骆珊珊,等.慢病毒介导的NOB1基因沉默对人结肠癌细胞增殖及凋亡的影响[J].中华胃肠外科杂志,2012,15(11):1182-1186.
[5] 王洪亮,李平,赵兵.NOB1影响胶质瘤细胞增殖、凋亡的实验研究[J/OL].中华临床医师杂志,2013,7(4):142-145.
[6] BENARY U,KOFAHL B,HECHT A,et al.Mathematical modelling suggests differential impact of β-TrCP paralogues on Wnt/β-catenin signalling dynamics[J].Febs J,2015,282(6):1080-1096.
[7] GHAHHARI NM,BABASHAHS.Interplay between microRNAs and WNT/β-catenin signalling pathway regulates epithelial-mesenchymal transition in cancer[J].Eur J Canc,2015,51(12):1638-1649.
[8] LIU K,CHEN HL,GU MM,et al.Relationship between NOB1 expression and prognosis of resected non-small cell lung cancer[J].Int J Biol Markers,2015,30(1):43-48.
[9] LIN S,MENG W,ZHANG W,et al.Expression of the NOB1 gene and its clinical significance in papillary thyroid carcinoma[J].J Int Med Res,2013,41(3):568-572.
[10] 裴振,霍小蕾,李代强.NOB1基因及其与肿瘤的研究进展[J].齐齐哈尔医学院学报,2011,32(22):3688-3690.
[11] MA Y,ZHOU W,HONG L,et al.Establishment of a novel monoclonal antibody L6 specific to NOB1[J].Monoclon Antib Immunodiagn Immunother,2016,35(2):100-103.
[12] HUANG W,ZHONG W,XU J,et al.Lentivirus-mediated gene silencing of NOB1 suppresses non-small cell lung cancer cell proliferation[J].Oncol Rep,2015,34(3):1510.
[13] XIAO W,FENG,QIAO L,et al.NOB1 is essential for the survival of RKO colorectal cancer cells[J].World J Gastroenterol,2015,21(3):868-877.
[14] LIU K,CHEN HL,GU MM,et al.NOB1 expression predicts early response to cisplatin-based chemotherapy in patients with advanced non-small cell lung cancer[J].J Chemotherapy,2016,28(3):225-229.
[15] WANG J,CAO L,WU J,et al.Long non-coding RNA SNHG1 regulates NOB1 expression by sponging miR-326 and promotestumorigenesis in osteosarcoma[J].Int J Oncol,2018,52(1):77-88.
[16] 陈炳鹏.NOB1 在骨肉瘤中的功能和作用机制研究[D].吉林大学,2014:10-30.
[17] Lamanna A C,Karbstein K.Nob1 binds the single-stranded cleavage site D at the 3′-end of 18S rRNA with its PIN domain[J].Proceed National Acad Sci,2009,106(34):14259-14264.
[18] 黄伟翼,李宁,陈栋晖.靶向沉默NOB1基因对乳腺癌细胞MCF-7生长和周期分布的影响[J].中国癌症杂志,2012,22(6):452-457.
[19] 刘安,刘龙强,张建勋.硒化麒麟菜多糖对膀胱癌细胞生长、凋亡的作用及Bax、Bcl-2、caspase-3蛋白表达的影响[J].现代泌尿外科杂志,2017,22(9):700-704.
[20] LIAN X,ZHANG J,AZARIN SM,et al.Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions[J].Nature protocols,2013,8(1):162-175.
[21] CHOI Y S,ZHANG Y,XU M,et al.Distinct functions for Wnt/β-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis[J].Cell Stem Cell,2013,13(6):720-733.
[22] JANG G B,HONG I S,KIM R J,et al.Wnt/β-catenin small-molecule inhibitor CWP232228 preferentially inhibits the growth of breast cancer stem-like cells[J].Canc Res,2015,75(8):1691-1702.
[23] YU T,LIU K,WU Y,et al.MicroRNA-9 inhibits the proliferation of oral squamous cell carcinoma cells by suppressing expression of CXCR4 via the Wnt/β-catenin signaling pathway[J].Oncogene,2014,33(42):5017-5027.