荧光定量RT-PCR检测高致病性PRRSV接触感染仔猪增殖动态
夏文龙, 余树培, 吴 植, 郭长明, 卢会鹏, 孙怀昌, 朱善元
(1.江苏农牧科技职业学院/江苏省兽用生物制药高技术研究重点实验室,江苏泰州 225300;2.扬州大学兽医学院/江苏省重要动物疫病与人兽共患病协同创新中心,江苏扬州 225009)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)引起的一种高度接触性传染病,以母猪繁殖障碍和仔猪及育肥猪呼吸道疾病为主要特征[1]。该病于1987年在美国和加拿大首次发现并迅速蔓延到世界各地,给全球养猪业造成了巨大经济损失[2]。2006年,我国大规模暴发以高热、高死亡率为主要特征的PRRS疫情,研究表明其主要病原为高致病性PRRSV变异株[3],鉴于PRRSV具有复杂的感染及免疫逃避机制[4],目前防控手段无法将其净化和根除。
PRRS主要依靠疫苗接种进行预防控制,近年来,有许多学者利用micro-RNA[5]、干扰素[6]、受体阻断[2]等新策略进行抗病毒研究,而这些研究前提是具备稳定、可靠的动物模型,以便评价其保护效果。目前,PRSSV人工感染仔猪主要是通过肌肉注射和滴鼻方式接种[7-8],缺少接触感染的相关研究资料,为了模拟PRRSV在猪群内的自然扩散,本试验通过同居饲养方式在健康猪中引入PRRS病猪,并建立荧光定量RT-PCR方法,动态监测感染仔猪的病毒血症和排毒水平,为进一步了解PRRSV的传播机制和建立防治PRRSV感染的仔猪模型提供了参考依据。
1 材料与方法
1.1 主要试剂
AxyPrep质粒DNA小提试剂盒和DNA凝胶回收试剂盒购自AXYGEN公司;rTaqDNA聚合酶、pMD-18T载体、MiniBEST Viral RNA/DNA Extraction Kit、PrimeScript RT Master Mix、SYBR Premix ExTaqⅡ为日本TaKaRa公司产品;PRRS ELISA检测试剂盒为美国IDEXX公司产品;引物由上海生工生物工程有限公司合成。
1.2 病毒和试验动物
猪圆环病毒2型(PCV2)、猪伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、高致病性PRRSV JXA1毒株均由笔者所在实验室保存;PRRS阴性仔猪购于江苏省如东某养殖场,动物试验在江苏农牧科技职业学院新兽药研发临床试验中心进行。
1.3 标准品制备
按照TaKaRa MiniBEST Viral RNA/DNA Extraction Kit操作说明,从PRRSV JXA1病毒液中提取RNA,参考TaKaRa PrimeScript RT Master Mix试剂盒提供的反应体系进行反转录,将获得的cDNA作为模板,利用针对PRRSV ORF7编码序列的特异性引物(F:5′-GGGGAATGGCCAGYCAGTCAA-3′,R:5′-GCCAGRGGAAAATGKGGCTTCTC-3′),进行PCR扩增,回收目的片段后,连接pMD-18T载体,转化DH5α感受态细胞,挑选阳性克隆并送测序,鉴定正确的重组质粒作为标准品。
1.4 标准曲线绘制
将标准品10倍梯度倍比稀释作为模板,按照TaKaRa SYBR Premix ExTaqⅡ试剂盒说明书配制反应体系并在ABI 7300仪器上进行荧光定量PCR反应条件的设置,优化后的反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火并延伸31 s,共扩增40个循环,延伸结束收集荧光信号;最后于60~95 ℃过程中制作熔解曲线。
1.5 重复性试验
为验证该方法重复性,随机选取3个不同稀释度的标准质粒作为模板,重复3次扩增,记录各模板CT值,计算其变异系数,变异系数=标准偏差/平均数。
1.6 敏感性、特异性试验
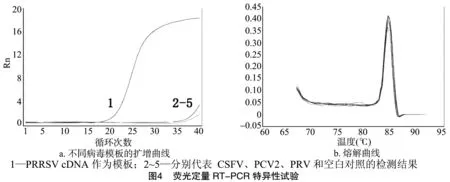
将不同稀释度的标准品作为模板,分别进行常规RT-PCR扩增以及实时荧光PCR试验,以确定2种方法所能检测的最低拷贝数,进行灵敏度比较;分别以猪繁殖与呼吸综合征病毒(PRRSV)和猪瘟病毒(CSFV)RNA反转录得到的cDNA,猪圆环病毒2型(PCV2)和猪伪狂犬病毒(PRV)DNA为模板,并设立空白对照,在相同条件下进行实时荧光PCR反应,分析扩增曲线及CT值,验证本方法的特异性;将PRRSV cDNA和标准品质粒作为模板进行荧光定量PCR反应后,观察溶解曲线,确保无引物二聚体及非特异扩增。
1.7 动物试验分组
将8头28日龄断奶仔猪平均分为2组,每组4头,置于2个负压隔离器中饲养3~5 d,观察无异样表现,前腔静脉采集血液并分离血清,经ELISA检测PRRSV特异性抗体为阴性;提取RNA后,通过上述RT-PCR方法检测PRRSV抗原阴性。第1组作为攻毒组,随机选择1头仔猪肌肉注射和滴鼻接种PRRSV JXA1(1×105TCID50),与其余3头健康仔猪同居饲养;第2组作为空白对照组,接种相同量DMEM细胞培养液;试验期间每日观察并记录各仔猪临床症状。
1.8 病毒血症检测
在同居饲养后1、3、5、7、10、13 d,前腔静脉采集每组仔猪血液5 mL并分离血清,取200 μL提取病毒RNA,根据上述定量RT-PCR方法,检测各血清样品中病毒基因组拷贝数。
1.9 粪便排毒检测
在同居饲养后1、3、5、7、10、13 d,采集每组仔猪粪便1 g并用10 mL PBS溶液重悬,8 000g离心10 min后取200 μL上清,根据上述定量RT-PCR方法,检测各粪便样品中PRRSV基因组拷贝数。
2 结果与分析
2.1 标准质粒鉴定
通过常规RT-PCR成功扩增预期大小的130 bp目的片段(图1),克隆至pMD-18T载体,获得重组质粒pMD-ORF7,测序结果表明,扩增的cDNA基因片段和已发表PRRSV ORF7(GenBank登录号:EF112445)编码序列的同源性为99.7%。利用紫外分光光度计测其D260 nm值,根据计算公式[9]:质粒拷贝数(拷贝/μL)=6.02×1023×质粒浓度/平均分子量,换算标准质粒拷贝数为2.18×109拷贝/μL。
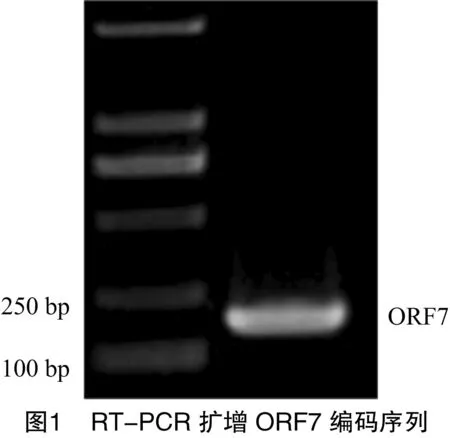
2.2 标准曲线建立和重复性试验
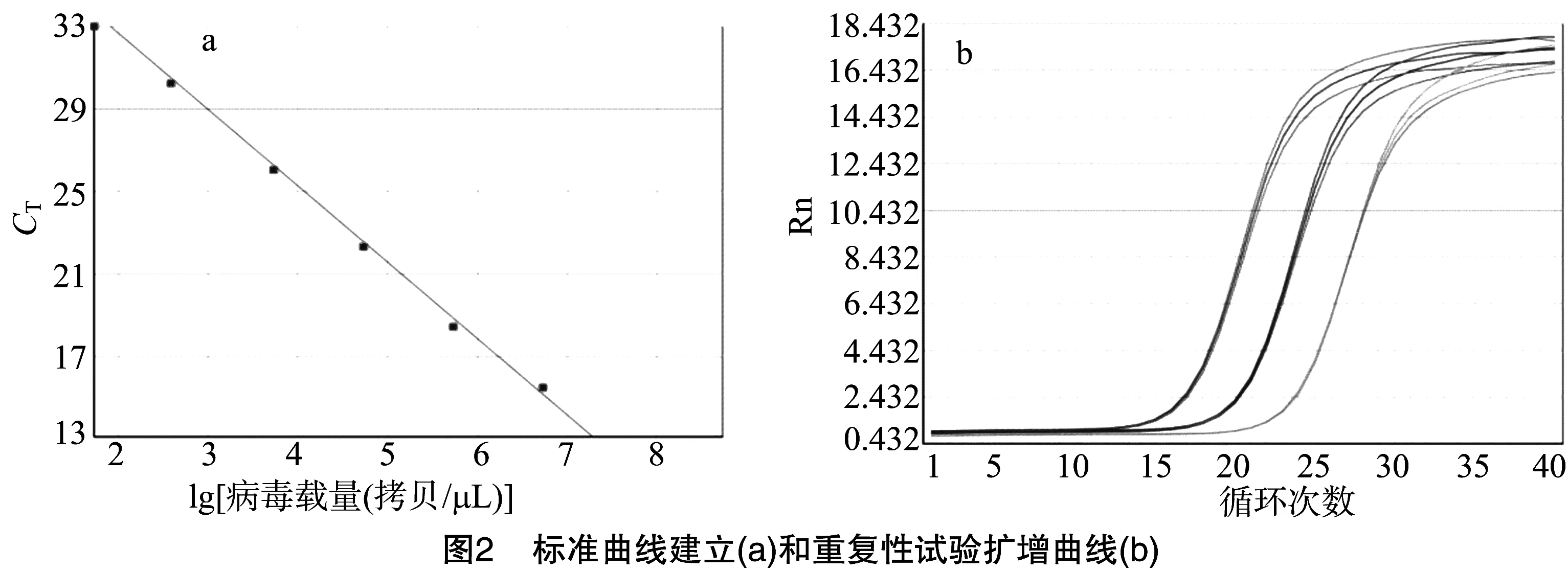
将标准质粒连续10倍系列稀释,分别取2.18×101~2.18×106拷贝/μL共6个稀释度作为模板进行荧光定量PCR反应,以CT值为纵坐标、模板拷贝数为横坐标,获得标准曲线(图2-a),回归方程为y=33.855-3.16x,r2=0.996,结果表明,其线性关系良好、相关系数较高。随机选取3个不同稀释度作为模板重复扩增3次,结果表明,每个稀释度之间的CT值误差非常小(图2-b),变异系数均小于 0.005,表明该方法具有较高的准确性和重复性。
2.3 灵敏度比较
以不同稀释度的标准质粒为模板,分别进行常规RT-PCR和荧光定量RT-PCR试验,结果表明,常规RT-PCR方法的最小检出量为2.18×104拷贝(图3-a),荧光定量PCR方法的最小检出量为2.18×101拷贝(图3-b),比常规方法高1 000倍。
2.4 特异性分析
分别以PRRSV、CSFV RNA反转录产物,PCV2和PRV的DNA为模板,相同条件下进行定量RT-PCR反应,结果显示:仅PRRSV基因组出现扩增曲线,其余样品检测结果均为阴性(图4-a);随后以PRRSV反转录产物和标准质粒作为模板进行荧光PCR扩增,反应后的熔解曲线波峰单一,无引物二聚体或非特异扩增(图4-b),说明本方法具有较好的特异性。
2.5 临床症状观察
人工接种猪于攻毒后2 d开始即出现体温升高,并于5 d左右出现呼吸困难、咳嗽等PRRS典型症状,持续至11d死亡; 同居接触后仔猪于4~5d开始体温升高,7~8d表现出相应临床症状,并分别于12、13 d全部死亡。

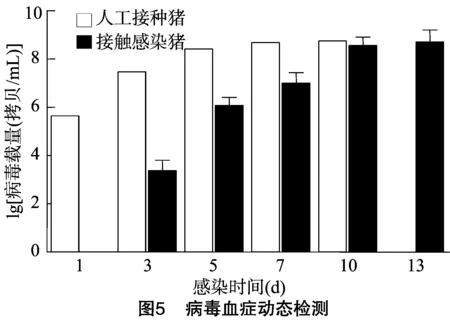
2.6 病毒血症检测
定期采集仔猪血清样品,利用建立的荧光定量RT-PCR方法对病毒血症进行检测,检测结果见图5。人工接种仔猪在1 d时即为PRRSV检测阳性,随后病毒载量逐渐上升,并维持较高水平,病毒载量为108.4~108.7拷贝/mL直至11 d死亡;接触感染后仔猪在3 d首次检出PRRSV,7 d内迅速升高至 108.5拷贝/mL,并稳定在较高含量,至13 d时3头仔猪全部死亡;空白对照组仔猪全部血清样品均检测为PRRSV阴性。
2.7 粪便排毒检测
定期采集试验仔猪粪样,荧光定量RT-PCR检测结果见图6。人工接种后仔猪在3 d为PRRSV检测阳性,随后病毒含量呈上升趋势并维持较高水平,病毒载量为104.5拷贝/g至 11 d 死亡;同居后感染仔猪于5 d PRRSV检测阳性,7 d排毒量迅速上升至104.0拷贝/g,并稳定在较高水平至13 d死亡;空白对照组仔猪粪便检测结果均为阴性。
3 讨论
常规RT-PCR方法检测PRRSV在动物体内动态分布时,仅能做定性或半定量分析,而荧光定量PCR(FQ-PCR)可以确定病毒在动物组织内的精确拷贝数,因此该技术已越来越多地应用于病毒定量分析的研究中[10],另外,相比传统的TCID50法检测病毒含量,FQ-PCR方法更加快速、稳定[11]。本试验建立的PRRSV FQ-PCR检测方法灵敏度比常规RT-PCR高1 000倍,并且特异性强,和其他常见病毒无交叉反应,具有良好的重复性和稳定性,为PRRSV接触感染仔猪后的增殖动态检测提供了技术支持。
PRRSV动物感染试验不易成功,与宿主、病毒和试验环境等方面密切相关[12]。猪是PRRSV感染和出现临床症状的唯一宿主,用于PRRSV动物试验的理想模型是SPF、CDCD(cesarean-derived colostrum-deprived)猪和PRRS阴性猪[13],前2种试验猪获取比较困难,因此,本试验首先通过RT-PCR和ELISA方法从某PRRS非免疫猪场筛选获得PRRSV抗原和抗体双阴性猪,用于感染试验,而所用PRRSV毒株为高致病代表株JXA1[14],能够引起PRRS典型病变;另外,动物试验均在负压隔离器中进行,免受外界环境干扰。以上因素均保证了PRRSV能够通过接触传播感染仔猪。
为模拟自然状态下的PRRSV传播,本试验首先向1头易感仔猪肌肉注射和滴鼻接种PRRSV JXA1,随后将其和另外3头健康仔猪同居饲养,研究结果表明,人工接种猪于攻毒后2 d开始即出现体温升高,并于5 d左右出现呼吸困难、咳嗽等PRRS典型症状,至11 d死亡,同居接触仔猪的发病时间推迟2~3 d,并分别于12、13 d全部死亡;通过荧光定量RT-PCR对接触感染仔猪的病毒血症和粪便排毒进行动态监测,结果表明,其血清和粪便分别于3、5 d首次检测PRRSV阳性,相比人工接种猪推迟2 d左右,病毒在仔猪体内增殖动态和人工接种猪相似,感染后7 d迅速上升并维持在较高水平,说明仔猪确实死于PRRSV感染。综上所述,本试验为建立PRRSV接触感染仔猪模型奠定了基础,为高致病性PRRS新型疫苗的研发及免疫效果评价等研究提供了参考数据。
参考文献:
[1]Done S H,Paton D J. Porcine reproductive and respiratory syndrome:clinical disease,pathology and immunosuppression[J]. Veterinary Record,1995,136(2):32-35.
[2]Chen Y,Guo R,He S,et al. Additive inhibition of porcine reproductive and respiratory syndrome virus infection with the soluble sialoadhesin and CD163 receptors[J]. Virus Research,2014,179(1):85-92.
[3]童光志,周艳君,郝晓芳,等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J]. 中国预防兽医学报,2007,29(5):323-327.
[4]Lunney J K,Fang Y,Ladinig A,et al. Porcine reproductive and respiratory syndrome virus (PRRSV):pathogenesis and interaction with the immune system[J]. Annual Review of Animal Biosciences,2016,4(1):129-154.
[5]Zhu L,Bao L,Zhang X,et al. Inhibition of porcine reproductive and respiratory syndrome virus replication with exosome-transferred artificial microRNA targeting the 3′ untranslated region[J]. Journal of Virological Methods,2015,223:61-68.
[6]王彦彬,孙向丽,魏战勇,等. 猪干扰素α和γ在杆状病毒中共表达及对PRRSV抑制作用[J]. 中国农业科学,2011,44(9):1931-1938.
[7]Lin H,Ma Z,Hou X,et al. Construction and immunogenicity of a recombinant swinepox virus expressing a multi-epitope peptide for porcine reproductive and respiratory syndrome virus[J]. Scientific Reports,2017,7:43990.
[8]Park C,Seo H W,Han K,et al. Evaluation of the efficacy of a new modified live porcine reproductive and respiratory syndrome virus (PRRSV) vaccine (Fostera PRRS) against heterologous PRRSV challenge[J]. Veterinary Microbiology,2014,172(3/4):432-442.
[9]Zhou G,Cai W,Liu X,et al. A duplex real-time reverse transcription polymerase chain reaction for the detection and quantitation of avian leukosis virus subgroups A and B[J]. Journal of Virological Methods,2011,173(2):275-279.
[10]Xiao S,Chen Y,Wang L,et al. Simultaneous detection and differentiation of highly virulent and classical Chinese-type isolation of PRRSV by real-time RT-PCR[J]. Journal of Immunology Research,2014(9):809656.
[11]Martínez E,Riera P,Sitjà M,et al. Simultaneous detection and genotyping of porcine reproductive and respiratory syndrome virus (PRRSV) by real-time RT-PCR and amplicon melting curve analysis using SYBR Green[J]. Research in Veterinary Science,2008,85(1):184-193.
[12]Martínezlobo F J,Díezfuertes F,Segalés J,et al. Comparative pathogenicity of type 1 and type 2 isolates of porcine reproductive and respiratory syndrome virus(PRRSV)in a young pig infection model[J]. Veterinary Microbiology,2011,154(1/2):58-68.
[13]Rose N,Renson P,Andraud M,et al. Porcine reproductive and respiratory syndrome virus (PRRSV) modified-live vaccine reduces virus transmission in experimental conditions[J]. Vaccine,2015,33(21):2493-2499.
[14]Tian K,Yu X,Zhao T,et al. Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J]. PLoS One,2007,2(6):e526.

