洋桔梗Ceremony Orcmge品种辐射诱变育种
陈淑英, 王玉英, 李叶芳, 何文俊, 宗积意, 宋 莲, 张宇欢, 李枝林,2
(1.云南农业大学花卉研究所,云南昆明 650201; 2.生物多样性与云南特色农业协同创新中心,云南昆明 650201)
洋桔梗(Enstomagrandiflorum)别称草原龙胆、大花桔梗、丽钵花,是龙胆科龙胆属1年生观赏植物[1],原生长于美国南部至墨西哥之间的石灰岩地带,是遍布北美草原的野花,后引种到欧洲和日本,经园艺工作者们多年的培育、杂交改良,近10年间洋桔梗的育种与生产有了迅速的发展,尤以日本为盛,现已成为花形、花色多样,株型妖媚多姿的鲜切花品种[2]。洋桔梗种子细小,价格昂贵,且种子萌发缓慢、幼苗生长缓慢,从播种到定植(3对叶)有2~3个月时间,其间受环境的影响很大,育苗技术要求很高,种苗供应受限制,我国洋桔梗育种工作仍处于停滞阶段[3]。
辐射可以提高植物的突变率,在较短的时间内获得更多的优良变异植株,为进一步良种选育提供材料,缩短育种时间[4]。相关报道表明,至今世界上已经有50多个国家在150多种植物上应用核诱变育种,已成功育成了1 737个品种,其中农作物比例最高,达74%,约1 275个品种[5]。我国已对40多种花卉进行核辐射育种改良,且已成功获得60多个突变种,主要集中在菊花[6]、兰花[7]、百合[8]、月季[9]、观赏性海棠[10]、水仙[11]和蝴蝶兰[12]等。有关洋桔梗物理诱变育种的研究,目前国内尚未见任何报道。因此,本试验以洋桔梗组培苗为材料,进行不同剂量的60Coγ射线照射,探索适宜的处理剂量,为洋桔梗辐射育种提供技术依据和试验方法基础,以期创造出新、奇、特的洋桔梗变异类型,丰富洋桔梗种质资源。
1 材料与方法
1.1 材料
云南农业大学花卉研究所提供的洋桔梗品种Ceremony Orcmge组培苗,平均株高4 cm。
1.2 方法
2015年10月对处理材料在云南华源辐射有限公司进行60Coγ射线处理,剂量为0、5、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150 Gy,剂量率为1 Gy/min,急性照射后培育4个月,统计死亡数,进行形态观察和记录,直到损伤苗稳定为止。其中,变异指叶片变厚、扭曲、呈圆筒状、叶色变深或黄化等形态异常现象;变异率指变异苗数与处理苗数的比值。
1.3 数据分析
应用Excel 2003整理数据,SPSS 20.0计算半致死剂量,LSD法进行多重比较。
2 结果与分析
2.1 不同剂量 60Co γ射线对洋桔梗组培苗死亡率的影响
在4个月内连续对辐射处理后的洋桔梗进行观察,其生长和死亡统计情况见表1。
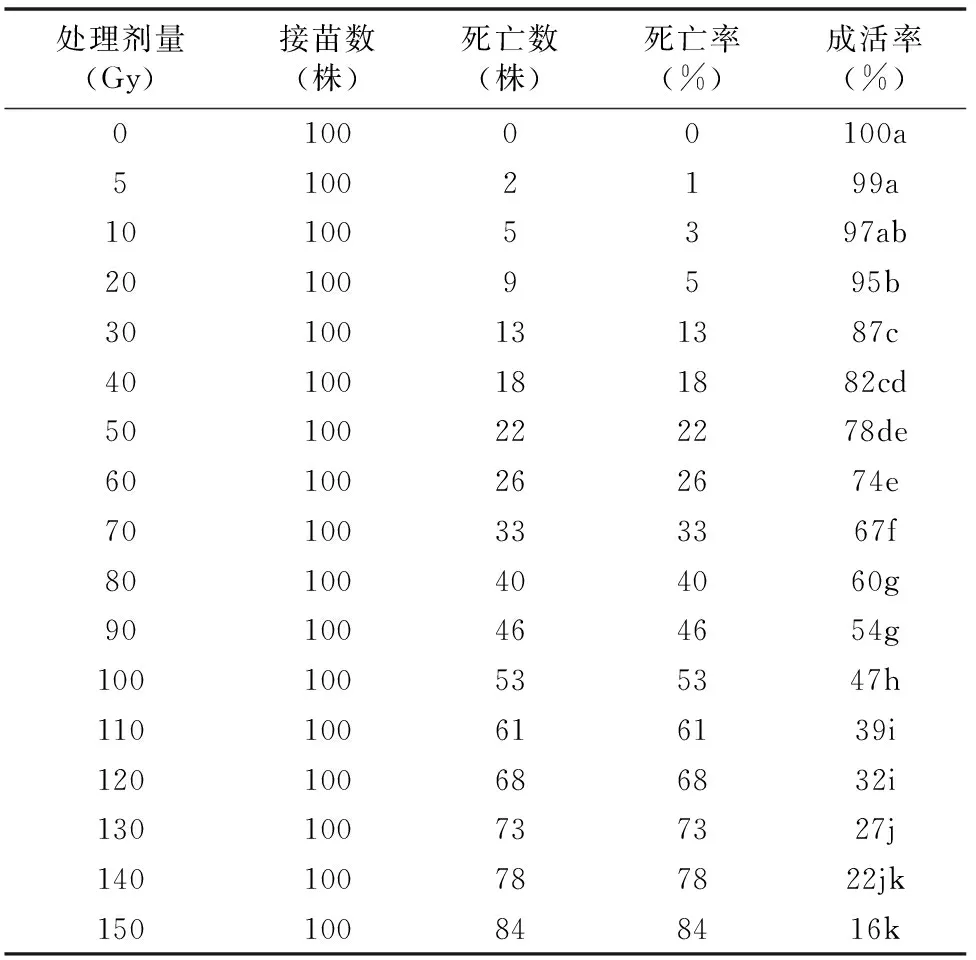
表1 不同剂量 60Co γ射线对洋桔梗组培苗死亡率的影响
注:同列数据后不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。下同。
由表1可知,不同剂量射线对洋桔梗组培苗成活率[成活率=(1-死亡株数/总株数)×100%]影响显著。处理剂量为90、100 Gy时,成活率分别显著低于对照组46、53百分点(P<0.05)。随着辐射剂量的增加,影响程度变大,两者呈正相关关系。辐射剂量越小,死亡的植株越少,成活率越高;辐射剂量越大,死亡植株越多,成活率越低。高剂量不仅增加了洋桔梗的死亡率,而且加快了植株的死亡速度,死亡首先从植株的茎尖部开始,然后叶片死亡,最后整株死亡,幼嫩的植株最先死亡。上述结果表明,辐射对幼嫩的器官组织损伤最大,成熟组织损伤较小。
2.2 洋桔梗组培苗的半致死剂量
为了达到较多变异,又不致过于损伤植株,实际应用中经常用半致死剂量(semi-lethal dose)作为衡量指标。计算半致死剂量,常用概率单位回归法分析死亡率与辐射剂量之间的关系。通过卢纹岱SPSS软件得到辐射效果模型为:Probit(P)=-2.00+0.019[lg(dose)]。得出洋桔梗的半致死剂量计算式lg(semi-lethaldose)=2.00/0.01,得到半致死剂量为103.63。皮尔逊拟合优度的卡方检验显示,它们的显著水平为0.978(大于0.15,SPSS默认),由此判断方程式满足数据的拟合优度。
表2表明,辐射效果模型所期望观察到的每个剂量的死亡数与实际观察到的死亡数完全在误差允许范围内, 由此可以判断辐射效果模型是可靠的。
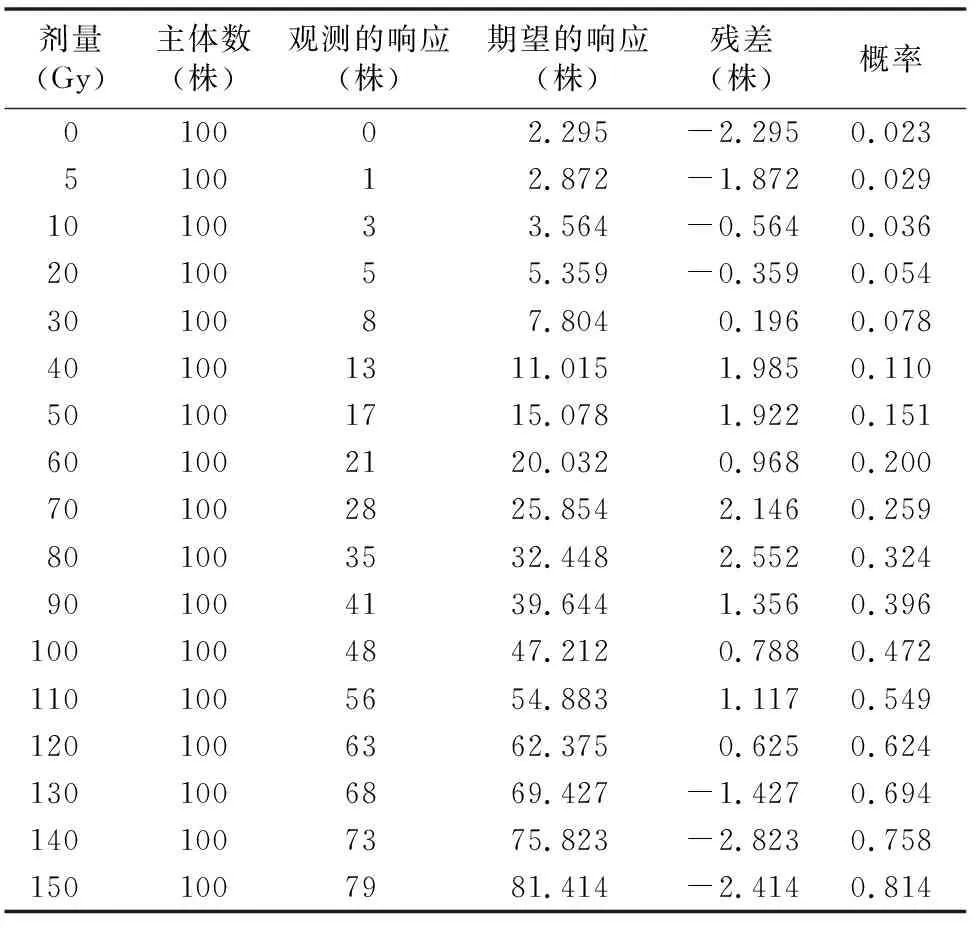
表2 观测与期望数频
由辐射效果的模型在95%置信区间内求得的各死亡率的辐射剂量见表3,由此可知各辐射剂量都在上限与下限之间。
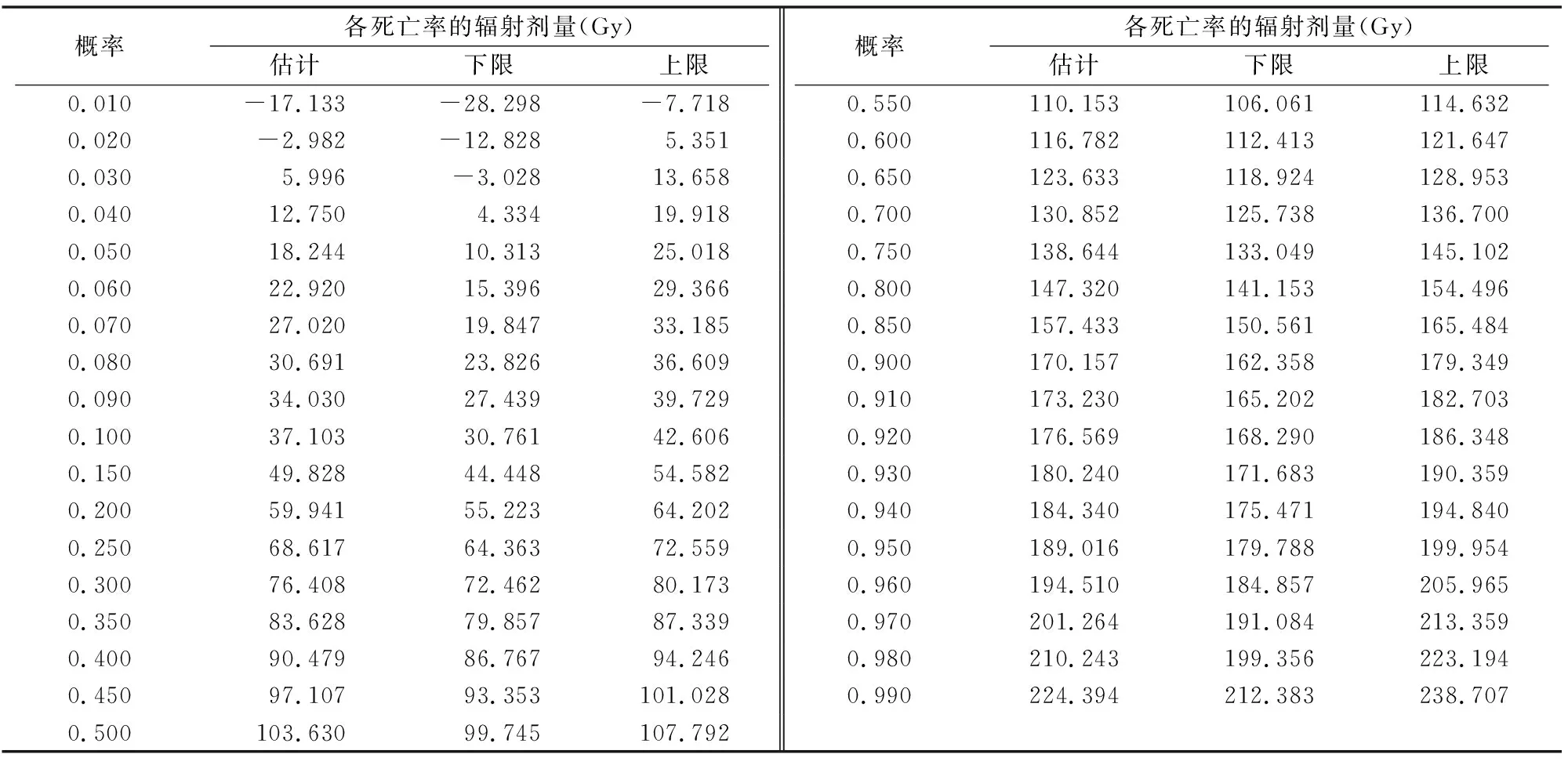
表3 因子变量95%的置信区间
从图1可知,不同剂量的散点图呈线性关系,说明用Log Base10的选项进行转换是合适的。
2.3 60Co γ射线辐射处理对洋桔梗组培苗表型的影响
由图2可知,经过辐射后,对洋桔梗植株的形态等会产生一定程度的影响,辐射剂量越大,对植株的影响程度越大,辐射剂量越小,对植株的影响程度越小。没有经过辐射的洋桔梗苗叶色是绿色的,植株形态正常,经过辐射的植株出现了黄化,叶片变小、变厚、变黑、有斑,有的叶片像水浸状,植株出现畸形等现象。随着辐射剂量的增加,黄化、叶片变黑情况加重,叶色黄绿或黄白。从表型变化上看,60Coγ射线对洋桔梗组培苗的诱变效果明显。
由表4可知,不同剂量射线对洋桔梗组培苗株高的影响差异显著。处理剂量为90、100 Gy时株高分别显著低出对照组47%、50%(P<0.05)。随着处理剂量的升高,洋桔梗组培苗株高逐渐降低,可见60Coγ射线对矮化植株有明显效果。
2.4 不同剂量的 60Co γ射线对洋桔梗组培苗变异率的影响
由表5可知,不同剂量射线对洋桔梗组培苗变异率的影响差异显著。处理剂量为90、100 Gy时,变异率分别显著高出对照组51%、45%(P<0.05)。随着处理剂量的升高,洋桔梗组培苗的变异率先升高后降低。植株变异率的峰值出现在90~100 Gy,50 Gy后升高的趋势比较明显,100 Gy后随剂量的升高变异率降低。由于死亡率随剂量的升高而增加,故变异率并非随着剂量升高而增加。但相对变异率(处理后存活苗中变异苗数与存活苗数的比值)随着剂量的升高而升高。原因是辐射剂量越高,损伤越重,分化出来的芽体越容易发生变异。但过高剂量处理后存活的材料常因细胞严重损伤造成劣性突变或致死突变而掩盖其他突变,不利于辐射育种。


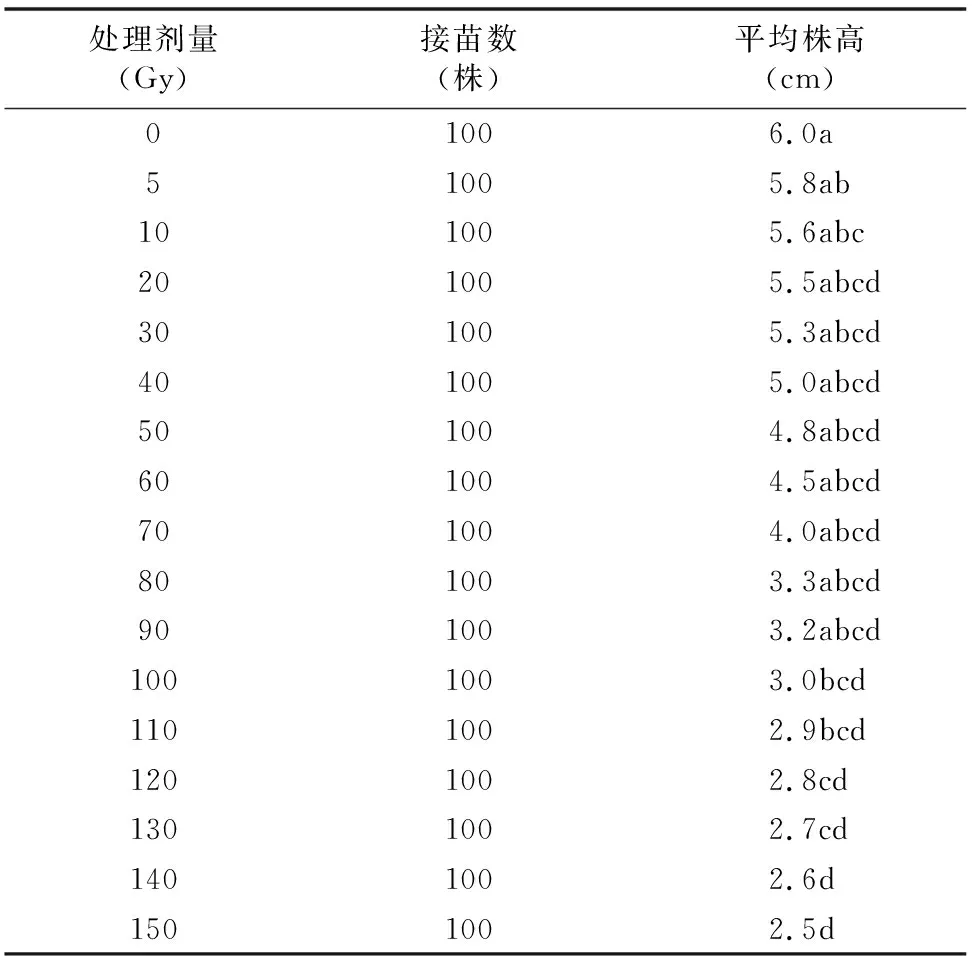
表4 不同剂量射线对洋桔梗组培苗株高的影响
2.5 不同剂量的 60Co γ射线对洋桔梗组培苗增殖率的影响
由表6可知,不同剂量射线对洋桔梗组培苗增殖率的影响差异显著。处理剂量为90、100 Gy时,增殖率分别显著低出对照组49%、59%(P<0.05)。随着处理剂量的升高,洋桔梗组培苗的增殖率逐渐降低。这应该是因为辐射后表面的细胞造成较严重的损伤,从而使其恢复生长的能力受到严重的破坏,分化能力也随之下降。
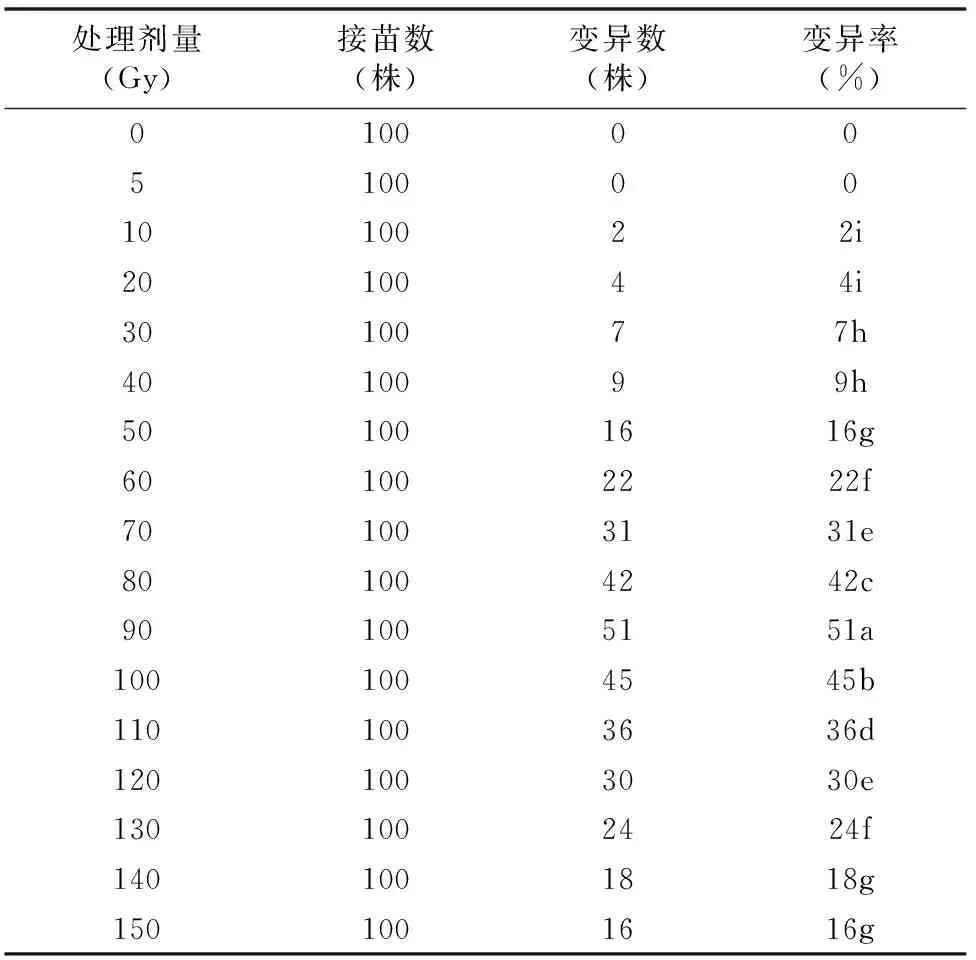
表5 不同剂量射线对洋桔梗组培苗变异率的影响
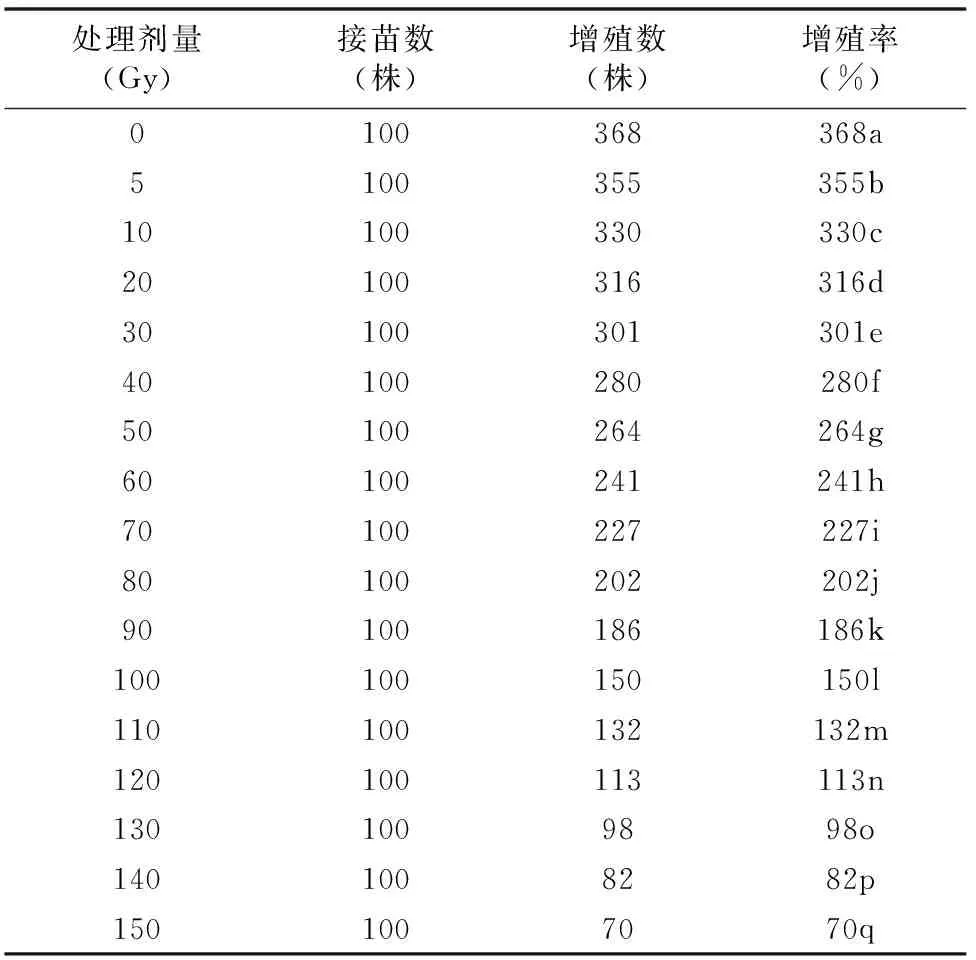
表6 不同剂量射线对洋桔梗组培苗增殖率的影响
3 讨论与结论
不同材料对射线的敏感性不同,对射线的敏感性大小依次为愈伤组织>试管苗>田间苗>根芽>插条>种子。组培苗含水量较高,在射线处理下会产生很多氧自由基,破坏核酸和蛋白质等生物大分子,是辐射诱变育种的理想材料。此外,辐射育种与组织培养结合可以提高变异保存率,克服扦插分离不彻底的缺点,加快变异的纯合,从而缩短育种周期。王晶等研究60Coγ射线对菊花的诱变效应选用的是组培苗[13];潘宏用兰花组培苗进行兰花辐射诱变育种[14];张兴等进行丰花月季60Coγ辐射育种选用材料也是月季组培苗[15]。因此,本试验选用洋桔梗组培苗为处理材料。
辐射产生诱变有2个方面主要原因:一是辐射后引起遗传物质的突变,如染色体的畸变、DNA分子的变异;二是RNA、蛋白质的生物合成受到抑制,生长素及酶等生理活性物质的代谢受到破坏,表现出细胞死亡、细胞突变,从而对生物产生抑制作用。刘丽强等在探讨60Coγ辐射对观赏海棠组培苗的辐射诱变效应时发现,生根和继代组培苗的生根率、平均根长、苗高、增殖等随着60Coγ射线剂量的增加而明显下降[10]。高年春等用60Coγ辐射非洲菊组培苗,结果发现,经辐射处理后非洲菊的株高、生根率、黄化率与辐射剂量呈负相关[16]。本试验发现,在0~150 Gy射线范围内,洋桔梗组培苗死亡率随照射射线剂量增加而增加,而增殖率与变异率呈负相关,这与前人的研究结果一致。
由于辐射诱变是随机事件,因此对一定的靶标照射剂量越大,引起诱变的概率越大,并且电离辐射对植物的损伤和抑制作用也越大。因此有一些学者建议,其诱变成功率由植物成活率与突变率的乘积决定,对应最大概率积的剂量才是最适剂量。本次试验中辐照剂量为90 Gy时,洋桔梗的死亡率为46%,变异率为51%,达到最高,因此90 Gy作为洋桔梗的辐射剂量更适宜。彭绿春等用60Coγ射线对4种兰花作辐照处理,结果发现,冬凤兰、竹叶兰、碧玉兰、西藏虎头兰组培苗的半致死剂量分别为20.72、26.31、29.88、41.04 Gy[17]。杨静坤等用60Coγ射线作诱变剂发现,碧玉兰组培苗半致死剂量为28.88 Gy[18]。而本试验发现,洋桔梗组培苗半致死剂量为103.63 Gy。彭绿春等选用的材料是兰花原球茎[17-18],而本试验的辐照材料是具有根、茎、叶的组培苗,这可能与植物种类、不同组织器官对辐射敏感不同有关。
参考文献:
[1]李 群,刘光勇,王 丽. 激素对洋桔梗植株再生的影响及生根培养的研究[J]. 广西植物,2004,24(1):40-42.
[2]李尚旺. 浅谈洋桔梗的离体培养[J]. 福建热作科技,2012,37(1):37-40.
[3]凌 青,孙启文,白 丽. 洋桔梗701品种组培快繁技术研究[J]. 现代农业,2011(9):5-9.
[4]王少平. 辐射育种在园林植物育种中的应用[J]. 种子,2008,27(12):63-68.
[5]赵利坤,强继业.60Co-γ射线辐射对花卉的影响研究[J]. 安徽农业科学,2013(30):11950-11951,11993.
[6]王 晶,刘录祥,赵世荣,等.60Coγ射线对菊花组培苗的诱变效应[J]. 农业生物技术学报,2006,14(2):241-244.
[7]陈秀兰,孙 叶,包建忠,等. 君子兰辐射诱变育种研究初报[J]. 江苏农业科学,2006(6):226-228.
[8]孙丽娜.60Coγ射线辐照百合诱变育种研究[D]. 南京:南京林业大学,2009.
[9]李惠芬,陈尚平,李倩中,等. 月季的辐照育种及其新品种霞晖[J]. 江苏农业科学,1997(3):50-51.
[10]刘丽强,刘军丽,张 杰,等.60Co-γ辐射对观赏海棠组培苗的诱变效应[J]. 中国农业科学,2010,43(20):4255-4264.
[11]高 健.60Coγ射线辐照中国水仙的诱变效应和机理研究[D]. 北京:北京林业科学研究院,2000.
[12]章 宁,苏明华,刘福平,等. 蝴蝶兰60Coγ射线诱变育种研究(简报)[J]. 亚热带植物科学,2005,34(2):63,62.
[13]王 晶,刘录祥,赵世荣,等.60Coγ射线对菊花组培苗的诱变效应[J]. 农业生物技术学报,2006,14(2):241-244.
[14]潘 宏. 兰花辐射诱变与组织培养技术初步研究[D]. 福州:福建农林大学,2008.
[15]张 兴,唐焕伟,车代第. 丰花月季60Coγ辐射育种研究及后代变异的初分析[J]. 国土与自然资源研究,2010(3):73-74.
[16]高年春,蒋贤权,房伟民,等.60Co-γ辐射对非洲菊组培苗苗期生长的影响[J]. 广东农业科学,2007(12):40-42.
[17]彭绿春,黄丽萍,余朝秀,等. 四种兰花辐射诱变育种研究初报[J]. 云南农业大学学报,2007,22(3):333-336.
[18]杨静坤,黄丽萍,唐 敏,等. 碧玉兰试管植株辐射诱变初探[J]. 现代园艺,2008(10):6-9.
——辨别味之苦甜

