胃癌与神经内分泌瘤共存1例
忻笑容 陈 平* 吴云林 罗方秀(080)
病例:患者男,34岁,因“4 d内黑便3次、呕血2次”于2017年11月24日收治入院。患者入院前1月余出现乏力、头晕,经血清学检测、骨髓穿刺、影像学检查等考虑为自身免疫性溶血性贫血(autoimmune hemolytic anemia, AIHA),1个月前开始服用泼尼松龙(15 mg tid),奥美拉唑(20 mg qd),碳酸钙D3片(1片qd),持续服用,药物未减量。入院前4 d开始出现呕血、黑便,至我院急诊就诊后停用上述药物,急诊上腹部CT平扫示胆囊可疑泥沙样结石,副脾结节可能,胃腔充盈欠佳,胃窦部胃壁增厚。急诊电子胃镜检查示胃窦巨大增殖性病灶,胃多发隆起性病灶,慢性非萎缩性胃炎(贫血期改变)。因患者处于急性消化道出血期,未予活检。患者经补液、输血后收治入院,查体示贫血貌,神情合作,心率110次/min,呼吸16次/min,血压98/60 mm Hg(1 mm Hg=0.133 kPa);腹软,无压痛、反跳痛,肝脾肋下未及,移动性浊音(-),肠鸣音4次/min。近期体质量无明显变化。否认其他慢性疾病史,否认肝炎、结核等传染病史,否认手术外伤史,否认药物、食物过敏史;吸烟史10年,饮酒史10年,戒烟酒1个月;父亲有胃癌病史。入院当天血液科会诊考虑AIHA为主,伴有胃部多发占位病变,首先考虑淋巴瘤可能性大,已暂停皮质激素治疗,以防再次出血和病灶缩小,建议合适时取胃镜病理活检明确诊断,动态监测血常规、网织红细胞、乳酸脱氢酶、肝功能,查肝脾、淋巴结超声,免疫球蛋白、溶血全套、T细胞亚群、血尿微球蛋白、铁代谢、ESR。实验室检查示Hb 53 g/L,网织红细胞计数2.9%,外周血涂片描述:红细胞大小不均,偏小,可见嗜多色性、不规则形和椭圆形红细胞;红细胞G6PD活性7.40 U·gHb-1·min-1,血清铁1.4 μmol/L,铁饱和度1.8%;肿瘤指标:非小细胞肺癌相关抗原21~14.10 ng/mL;余检查指标阴性。经奥美拉唑抑酸、输血、补液支持等治疗后症状好转。3 d后复查电子胃镜示黏膜苍白,胃体大弯侧、小弯侧近胃窦、胃底近贲门可见多处隆起增生性病灶,大小约0.4 cm×0.4 cm~1.0 cm×1.2 cm,中央黏膜凹陷伴溃疡形成,胃窦见一巨大增殖性病灶,表面呈结节状,质地脆,易出血,其上可见黏膜糜烂充血水肿,未见明显活动性出血,堵塞幽门和部分胃窦腔,镜身无法通过(图1),分别于胃底、胃体、胃窦处取多块组织行活检。胃镜活检病理:胃窦非萎缩性黏膜慢性炎,活动期,肠化生(+),Hp(-);胃体活检标本示神经内分泌瘤(neuro-endocrine tumors, NETs),G2型;胃底活检标本示非萎缩性黏膜慢性炎。免疫组化染色:肿瘤细胞AE1/AE3(+),CD56(-),CgA(+),NSE(-),SYN(+),Vimentin(-),LCA(-),Ki-67(约10%+)。进一步行全身浅表淋巴结超声阴性;胸腹部增强CT示左肺舌段少许斑片影,胃窦占位,贲门胃底部胃壁增厚,左肾小囊肿,盆腔少许积液;结肠镜检查无明显异常。血液科再次会诊考虑AIHA证据不足。
普外科会诊建议:患者诊断为上消化道出血,胃窦占位,有手术指征,建议限期手术。遂转普外科治疗,行全麻下腹腔镜全胃切除术+肠粘连松解术,术后标本肉眼可见胃小弯长15 cm,大弯长20 cm,间距5 cm,距上切端9 cm,距下切端1 cm。胃窦小弯侧见一隆起型肿块,大小10 cm×10 cm×3 cm,肿块累及胃窦前后壁,表面菜花样,切面灰白质韧,小弯侧可见结节9枚,直径0.1~1.5 cm,大弯侧结节5枚,直径0.3~0.8 cm(图2)。病理检查示:胃窦小弯侧腺癌Ⅱ级(隆起型),浸润至浆膜层,侵犯神经,脉管内见癌栓;大弯侧淋巴结1/5枚可见癌细胞转移;下切缘、网膜、另送“上切缘”、“第6组淋巴结”1枚、找到小弯侧淋巴结9枚,均未见癌细胞累及或转移;免疫组化:肿瘤细胞CK20(灶+),CDX-2(+),Her2(-),Ki-67(30%+)。对胃壁结节进一步检查提示“胃体结节”为胃体NETs(直径1.5 cm),G2型,浸润至黏膜下层,脉管内见瘤栓;免疫组化:肿瘤细胞AE1/AE3(+),CD56(-),CgA(+),SYN(+),CD34(-),Ki-67(约10%+)(图3、图4)。余结节均为腺癌转移结节。患者最终诊断为胃腺癌、胃体NETs、贫血,术后行生长抑素受体显像阴性,术后3个月复查胸腹部增强CT阴性。

A:胃体见多发隆起增生性病灶,中央黏膜凹陷伴溃疡形成;B:胃窦见一巨大增殖性病灶,表面呈结节状,堵塞幽门和部分胃窦腔,镜身无法通过;C:胃底见多发隆起性病灶,中央凹陷糜烂
图1本例患者胃镜检查图
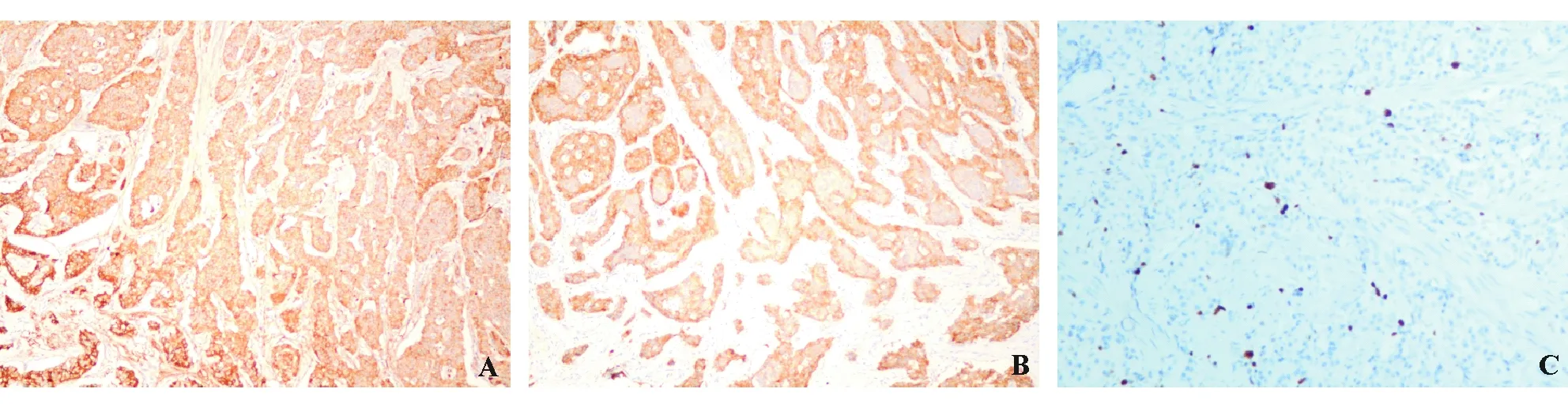
A:CgA(+);B:SYN(+);C:Ki-67(约10%+)
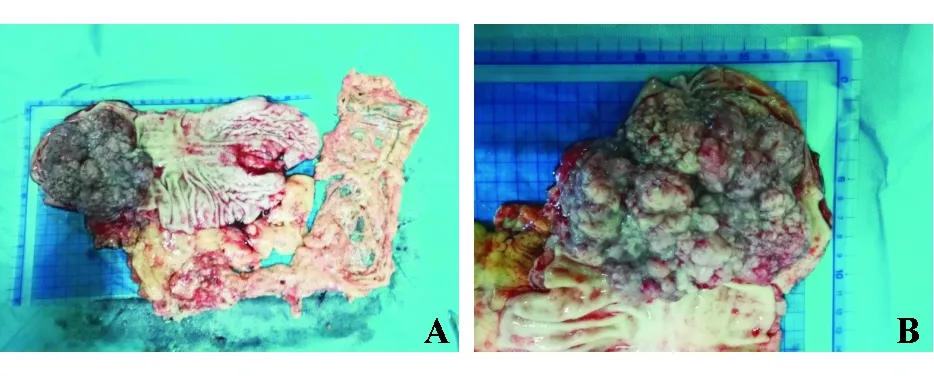
A:全胃切除标本胃小弯长15 cm,大弯长20 cm,间距5 cm,距上切端9 cm,距下切端1 cm;B:胃窦见一隆起型肿块,大小10 cm×10 cm×3 cm,肿块累及胃窦前后壁,表面菜花样,切面灰白质韧
图2本例患者全胃切除术标本的大体图
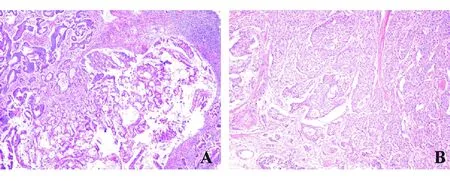
A:腺癌;B:NETs(G2型)
讨论:1907年德国病理学家Oberndorfer提出了类癌这一概念[1],神经内分泌肿瘤(neuroendocrine neoplasms, NENs)为一种罕见的疾病,目前认为其是一类起源于干细胞且具有神经内分泌标记物、能产生生物活性胺和(或)多肽激素的肿瘤。其中胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs)主要发生在消化道或胰腺,占NENs中的多数。近年多国流行病学研究显示GEP-NENs发病率明显上升[2]。我国NENs的报道亦逐渐增多,但缺乏系统性流行病学和临床特征的资料。据报道,我国以胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, pNENs)最为多见,其次为胃肠道神经内分泌肿瘤(gastro-intestinal neuroendocrine neoplasms, GI-NENs)[3-4]。GI-NENs可发生于消化道各个部位,其中回肠、直肠、阑尾NENs最为常见。
胃NENs临床少见,周琴等[5]报道了1例胃多发性NENs,经内镜和手术治疗后出现复发。NENs的发现多依赖于影像学、内镜检查等,但确诊需依靠病理学检查。目前认为胃NENs起源于肠嗜铬细胞,属于分泌非肽类激素的神经内分泌细胞,分布于胃底和胃体,在胃泌素刺激下可分泌组胺。病理学上根据肿瘤分化程度不同,NENs分为高、中分化的NETs和低分化的神经内分泌癌(neuroendocrine carcinoma, NEC),NEC又分为小细胞和大细胞两个类型[6]。同时,依据核分裂象和免疫组化染色Ki-67指数予以分级,G1:低级别,核分裂象为1/10HPF或Ki-67指数≤2%;G2:中级别,核分裂象2~20/10HPF或Ki-67指数3%~20%;G3:高级别,核分裂象>20/10HPF或Ki-67指数>20%。胃NENs临床上可分为四型:1型占70%~80%,肿瘤直径<1~2 cm,常多发,78%息肉样,分化程度良好,多为G1型;2型占5%~6%,肿瘤直径<1~2 cm,多发,息肉样,分化程度良好,多为G1~G2型;3型占14%~25%,肿瘤直径>2 cm,单发,有息肉、溃疡表现,分化程度良好,分级为G1、G2或 G3型;4型少见,表现为巨大溃疡或球形息肉,分化差,分级为NEC、混合性腺-神经内分泌癌(mixed adeno-neuroendocrine carcinoma, MANEC)[7]。
本例患者为青年男性,服用激素治疗1个月后出现上消化道出血,无上腹不适、腹痛、体质量下降等表现,有贫血表现,一度考虑为AIHA,后进一步检查考虑依据不足而排除。胃镜检查示胃多发隆起增生性病灶、胃窦巨大增殖性病灶,内镜活检病理虽提示NETs(G2型),但当时首先考虑胃内病灶为同一来源,故NEC、MANEC不能除外。MANEC系指具有腺癌特征,且同时具有NENs形态特征的上皮性肿瘤,每种成分至少各占30%以上,且均为恶性,应分别进行组织学分级[8]。因患者胃窦病灶伴梗阻,故进一步行腹腔镜全胃切除术+肠粘连松解术。但术后病理示胃窦小弯侧腺癌Ⅱ级(隆起型),浸润至浆膜层,侵犯神经,脉管内见癌栓,大弯侧淋巴结1/5枚见癌转移;“胃体结节”为胃体NETs(直径1.5 cm),G2型,浸润至黏膜下层,脉管内见瘤栓,免疫组化:肿瘤细胞AE1/AE3(+),CD56(-),CgA(+),SYN(+),CD34(-),Ki-67(约10%+)。然而,部分腺癌经神经内分泌通用型的标记物(如CgA、突触素、CD56等)的免疫组化染色示有散在分布或灶性分布的阳性细胞,比例不超过30%,且为一致腺癌背景,并不具有独立的神经内分泌成分,称为腺癌伴神经内分泌分化。但本例患者不符合这一诊断。最终病理诊断为胃窦腺癌与胃体NETs共存,患者预后差。
随着内镜技术的发展,对NENs的诊断水平不断提高,电子内镜、超声内镜、超声内镜引导下细针穿刺术(endoscopic ultrasonography guided fine needle aspiration, EUS-FNA)、胶囊内镜等对诊断起重要作用。由于NETs均具有潜在恶性,故GI-NENs的内镜下治疗需严格掌握适应证,同时应加强术后监测和管理[9]。本例患者胃体NETs的直径<2 cm,分级为G2型,但病理示脉管内见瘤栓,具有转移风险,需加强术后内镜、影像学随访和监测。目前g-NENs的基础研究和转化研究是近年的一大热点,有研究[10]显示血清CEA水平高、肿瘤组织表达CgA和(或)CD56可作为Ⅲ型g-NENs患者预后差的标记物。一项回顾性研究[11]显示CD73可能可作为判断g-NENs预后和评估PD-1疗效的标记物。总之,对NENs的流行病学、临床特征的研究还处于初始阶段,需以统一的标准有效累积资料。此外,NENs发病机制、病理诊断、靶向治疗等方面还有待于进一步研究。
1 Oberndorfer S. Karzinoide tumoren des Dünndarms [J]. Frankf Z Pathol, 1907, 1: 425-429.
2 Fraenkel M, Kim M, Faggiano A, et al; Knowledge NETwork. Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature[J]. Endocr Relat Cancer, 2014, 21 (3): R153-R163.
3 郭林杰, 唐承薇. 中国胃肠胰神经内分泌肿瘤临床研究现状分析[J]. 胃肠病学, 2012, 17 (5): 276-278.
4 Wang YH, Lin Y, Xue L, et al. Relationship between clinical characteristics and survival of gastroenteropancreatic neuroendocrine neoplasms: A single-institution analysis (1995-2012) in South China[J]. BMC Endocr Disord, 2012, 12: 30.
5 周琴, 李斌, 汪泳. 胃多发性神经内分泌肿瘤1例[J]. 中国肿瘤临床, 2016, 43 (7): 314-315.
6 Osamura RY. Current concept of neuroendocrine tumors (NET): its changes for the past 20 years[J]. Pathology, 2014, 46 (Suppl2): S1-S2.
7 中国临床肿瘤学会神经内分泌肿瘤专家委员会. 中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J]. 中国肿瘤学杂志, 2016, 21 (10): 927-946.
8 吴湘萍. 胃肠胰腺癌伴神经内分泌分化和胃肠胰混合性腺-神经内分泌癌的临床病理研究[J]. 中国生化药物杂志, 2017, 37 (9): 403-406.
9 陈慧珊, 陈烨. 胃肠胰神经内分泌肿瘤内镜诊治共识与争议[J]. 中华胃肠外科杂志, 2017, 20 (9): 982-986.
10 Li Y, Bi X, Zhao J, et al. CEA Level, Radical Surgery, CD56 and CgA Expression Are Prognostic Factors for Patients With Locoregional Gastrin-Independent GNET[J]. Medicine (Baltimore), 2016, 95 (18): e3567.
11 Ono K, Shiozawa E, Ohike N, et al. Immunohistochemical CD73 expression status in gastrointestinal neuroendocrine neoplasms: A retrospective study of 136 patients[J]. Oncol Lett, 2018, 15 (2): 2123-2130.

