神经内分泌肿瘤合并疑似IgG4相关硬化性胆管炎1例并文献复习*
蔡美洪 盛 黎 苗 琪 肖 潇 王绮夏 马 雄 ()
病例:患者女性,28岁,因“腹泻半年,发现肝功能异常4个月”于2017-08-10收治入上海交通大学医学院附属仁济医院。患者入院前半年无明显诱因下出现腹泻,每日3次,粪便不成形,色黄无异味,未引起重视。4个月前体检发现ALT、AST≥2倍正常值上限,肝炎病毒抗体全套、自身免疫性肝病抗体全套均阴性。初诊血清IgG4 2.13 g/L,AST 103 U/L,γ-GT 98.2 U/L,PAB 107 mg/L,Alb 44.7 g/L,PT 13.3 s,APTT 28.3 s,PT INR 1.16。腹部B超检查示肝脏质地增粗;瞬时弹性成像肝脏硬度值22.0 kPa;MRCP示肝内外胆管僵硬伴局部粗细不均,肝门区和胆总管上段局部胆管狭窄最为明显(图1)。门诊拟诊“IgG4相关硬化性胆管炎疑似”,予泼尼松龙(15 mg bid)、熊去氧胆酸(1 000 mg tid)口服治疗。随访过程中患者腹泻伴肝区疼痛进行性加重,结肠镜检查示结肠、盲肠未见异常,予逐步递减激素(至5 mg/d)和熊去氧胆酸用量。入院前20 d患者出现反复发作性心悸伴大汗、意识模糊,餐后4~5 h和凌晨频发,进食后明显缓解,否认二便失禁、胸闷胸痛、晕厥等不适。发作时急诊测随机血糖1.41 mmol/L,生命体征平稳,予输注葡萄糖后症状缓解。发病以来患者神清,饮食、睡眠可,小便正常,体质量未见明显变化。既往体健,无药物服用史、疫水疫区接触史、饮酒史,否认肝胆疾病和肿瘤相关家族史,父母、姐妹、女儿均体健。月经不调1年余。
入院查体:体温36.6 ℃,脉搏110次/min,呼吸25次/min,血压111/67 mm Hg(1 mm Hg=0.133 kPa);身高156 cm,体质量47 kg,BMI 19.3 kg/m2,腹围78 cm,臀围82 cm;神清,气急,全身皮肤黏膜无黄染,无满月脸、水牛背、皮肤色素沉着,未及全身浅表淋巴结肿大;腹部膨隆,无Gray-Turner征和Cullen征,肠鸣音4次/min,未闻及血管杂音,移动性浊音(±),无压痛和反跳痛,肝脾肋下未触及,肝颈静脉回流征(-);双下肢无凹陷性浮肿。住院期间表现为明显的Whipple三联征,腹围进行性增大伴腹痛、腹泻和面色潮红,发热待查(最高体温39.3 ℃)。延长糖耐量试验示高峰延迟,胰岛素释放指数(胰岛素/血糖比值)始终小于0.3,排除高胰岛素血症性低血糖。各类激素测定排除肾上腺皮质或垂体功能减退所致的低血糖。住院期间肝功能:PAB、Alb分别进行性下降至19.8 mg/L和28.2 g/L,AST升高至238 U/L,γ-GT 110~129 U/L;出凝血系列:PT、APTT、PT INR 分别升高至19.5 s、45.6 s和1.75;血清IgG4升高至3.7 g/L;血清淀粉酶114 U/L;血清肿瘤标记物:AFP 179.50 ng/mL,CEA 10.71 ng/mL,CA125 268.20 U/mL,NSE 228.60 ng/mL,SCC、CA50、CA19-9正常;铜蓝蛋白和风湿全套阴性;血常规:WBC (7.68×109~20.2×109)/L,N (5.89×109~16.3×109)/L;CRP 3.61~31.1 mg/L,ESR 22~37 mm/h;PCT 4.28~12.13 μg/L。瞬时弹性成像肝脏硬度值升至69.1 kPa。肺CT平扫大致正常。上腹部MR平扫+增强示肝肿大,肝脏内弥漫结节状异常信号影,定性困难,胰头前方、胰尾上方、腹腔系膜内多发结节状异常灶,后腹膜多发淋巴结,腹水,胰腺略肿大(图2)。由于患者需持续静脉输注葡萄糖,无法进一步完善PET-CT检查。ECT示TOC显像全身平面+腹盆部断层未见放射性摄取异常增高灶;肝脏明显增大,胰腺增粗,胰周多发结节影,腹腔和腹膜后多发肿大淋巴结,腹膜增厚,均未见放射性异常摄取;腹盆腔积液。腹腔镜探查术中见肝脏重度肿胀,被膜下多发灰白色结节(图3);腹壁散在灰黄色结节。肝活检病理(图4):免疫组化:“肝肿瘤”肿瘤细胞嗜铬粒蛋白A(CgA)(+)、突触素(Syn)(+)、CD56(+)、Ki-67(+,40%)、CK(+)、CD99(+)、p53(+)、CK19(+)、AE1/AE3(+)、生长抑素受体2(SSTR2)(+/-)、AB(+/-)、vimentin(-)、TTF1(-)、HSA(-)、Hepatocyte(-)、CK7(-)、CK20(-)、Insulin(-)、PAS(-)。结合HE染色切片核分裂象计数 27个/10 HPF,符合“肝肿瘤”神经内分泌肿瘤(G3),结合 临床排查转移可能。血清腹水白蛋白梯度(SAAG)17.2 g/L,提示门静脉高压性漏出液。术后使用奥曲肽治疗,顽固性低血糖明显缓解但腹泻加重。后相继发生循环、呼吸衰竭,患者于2017-09-11去世。
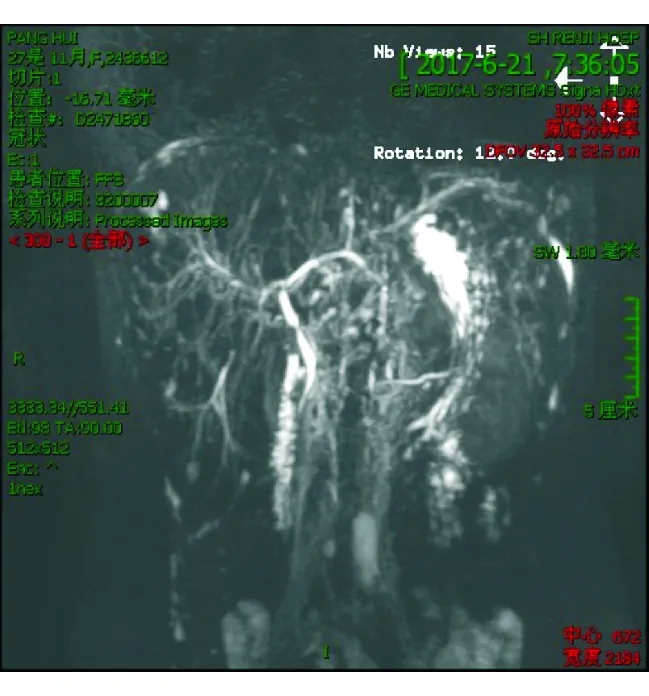
图1 MRCP图像
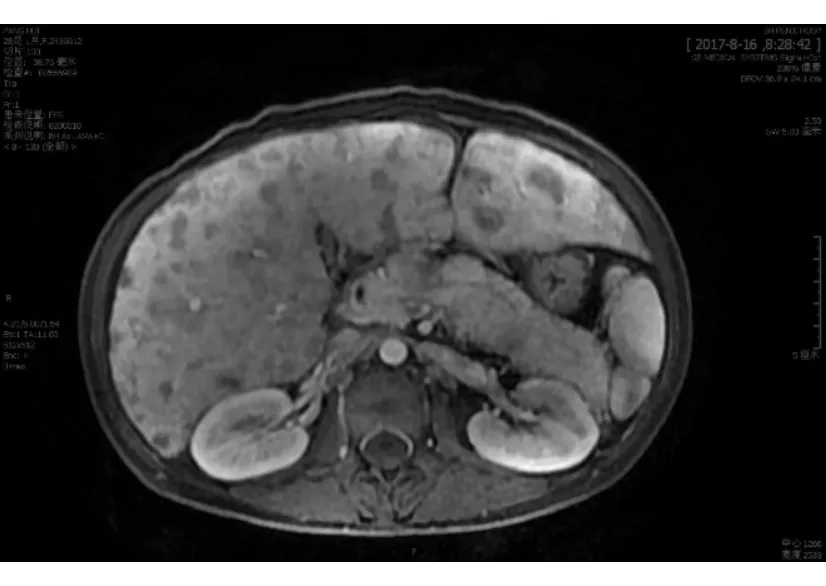
图2 上腹部MR平扫+增强图像(动脉相)
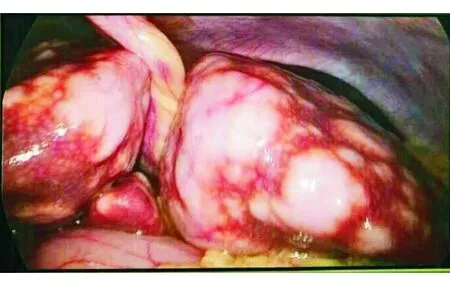
图3 腹腔镜探查术中所见
讨论:神经内分泌肿瘤(neuroendocrine tumors)是一组罕见的异质性肿瘤,起源于肽能神经元和神经内分泌细胞,其中胃肠胰神经内分泌肿瘤最为常见,按生物学行为可分为神经内分泌瘤、神经内分泌癌、混合性腺神经内分泌癌、部位特异性和功能性神经内分泌肿瘤四大类;按组织学和增殖活性(细胞核分裂象计数和Ki-67指数),可分为高分化的低级别(G1)、中级别(G2)和低分化的高级别(G3)三级[1],G3为一组侵袭性恶性肿瘤。神经内分泌肿瘤临床表现个体差异大、缺乏特异性,给诊断带来一定困难。本例患者确诊系依据组织病理学和免疫组化结果:“肝肿瘤”肿瘤细胞呈CgA(+)、Syn(+)、Ki-67(+,40%),核分裂象计数27个/10 HPF。
本例患者以类癌综合征、肝肿大、腹痛、低血糖为主要临床表现。①类癌综合征:患者以慢性腹泻起病,病程中出现面色潮红,是由肿瘤分泌5-羟色胺以及其他血管活性物质至体循环中所致。类癌综合征主要与能产生5-羟色胺的起源于远端小肠和近端结肠的转移性肿瘤有关[2],广谱细胞角蛋白AE1/AE3(+),可推测原发肿瘤的肠上皮性质。然而本例患者不像大多数胃肠胰神经内分泌肿瘤患者一样存在SSTR2(SSTR2 +/-),故TOC无特异性显像,给诊断造成障碍。回顾治疗过程中奥曲肽明显缓解低血糖而加重腹泻,极可能与其胰岛素抑制作用,而非与SSTR结合有关。②肝肿大和右上腹疼痛:低分化肿瘤的迅速转移使肝脏快速增大,不仅产生压迫性疼痛,还导致门静脉压力增高。③低血糖:患者肝脏储备能力差,糖原生成、糖异生不足导致基础血糖水平极低; 同时门静脉高压导致胰岛素分泌后聚积于肝前,无法完全进入体循环而使餐后血糖高峰延迟。
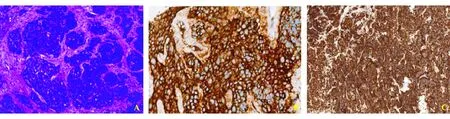
A:HE染色(×100);B:CgA免疫组化染色阳性(×200);C:Syn免疫组化染色阳性(×200)
IgG4相关硬化性胆管炎(IgG4-related sclerosing cholan-gitis, IgG4-SC)是1型自身免疫性胰腺炎(IgG4相关)最常见的胰腺外表现,较少独立发病,一般有血清IgG4水平升高,病理学可见胆管壁广泛席纹状纤维化形成伴IgG4阳性浆细胞密集浸润,患者大多对糖皮质激素治疗应答良好。本例患者未进行胆管活检,按2012年日本学者提出的临床诊断标准(表1),符合血清IgG4水平升高和特征性胆管影像学表现,可拟“IgG4-SC疑似”[3]。有研究表明恶性肿瘤自身抗原的表达可能触发IgG4相关疾病[4],亦有研究显示IgG4相关疾病是恶性肿瘤的高危因素[5],二者间的因果关系尚存争议[6-7]。临床医师仅根据胆管造影结果鉴别IgG4-SC与原发性硬化性胆管炎、胰腺癌和胆管癌较为困难,血清学和病理学检查可提供进一步的支持。同时,IgG4-SC的诊断和随访过程中须注意恶性肿瘤的筛查。

表1 IgG4-SC 2012年临床诊断标准
总之,肿瘤合并IgG4相关疾病临床罕见。本病例为首例神经内分泌肿瘤合并疑似IgG4-SC的报道,肿瘤恶性程度高,患者预后差。鉴于神经内分泌肿瘤临床表现的非特异性和G3的侵袭性,临床上应高度警惕类癌综合征和早期肿瘤筛查,对于转移性神经内分泌肿瘤,应尽快转诊进行姑息性化疗。而在IgG4-SC的诊断和治疗过程中,除需血清学、影像学、病理学检查支持外,对恶性肿瘤的筛查亦至关重要。
1 Bosman FT, Carneiro F, Hruban RH, et al. WHO Classification of Tumours of the Digestive System[M]. 4th ed. Lyon: IARC Press, 2010.
2 Feldman JM. Carcinoid tumors and syndrome[J]. Semin Oncol, 1987, 14 (3): 237-246.
3 Ohara H, Okazaki K, Tsubouchi H, et al; Research Committee of IgG4-related Diseases; Research Committee of Intractable Diseases of Liver and Biliary Tract; Ministry of Health, Labor and Welfare, Japan; Japan Biliary Association. Clinical diagnostic criteria of IgG4-related sclerosing cholangitis 2012[J].J Hepatobiliary Pancreat Sci, 2012, 19 (5): 536-542.
4 Wallace ZS, Wallace CJ, Lu N, et al. Association of IgG4-Related Disease With History of Malignancy[J]. Arthritis Rheumatol, 2016, 68 (9): 2283-2289.
5 Asano J, Watanabe T, Oguchi T, et al. Association Between Immunoglobulin G4-related Disease and Malignancy within 12 Years after Diagnosis: An Analysis after Longterm Followup[J]. J Rheumatol, 2015, 42 (11): 2135-2142.
6 Della-Torre E, Lanzillotta M, Doglioni C. Immunology of IgG4-related disease[J]. Clin Exp Immunol, 2015, 181 (2): 191-206.
7 Inoue D, Yoshida K, Yoneda N, et al. IgG4-related disease: dataset of 235 consecutive patients[J]. Medicine (Baltimore), 2015, 94 (15): e680.

