黄芪发酵前后黄酮含量及指纹图谱比较研究
侯美如,尹珺伊,王 岩,刘 宇,陈楠楠,秦平伟,史同瑞,杨淑萍
(黑龙江省兽医科学研究所,黑龙江齐齐哈尔 161006)
黄芪是我国一种传统药材,为豆科植物蒙古黄芪或膜荚的干燥根。性温、味甘,为常用补气药。黄芪含黄酮类、多糖类、皂苷类、氨基酸及多种微量元素等活性成分。其中,黄酮类是含量较高的一类成分,具有清除自由基、调节免疫、抗病毒等多方面的药理作用,是黄芪中重要的有效成分,因此黄酮类成分常作为黄芪药材的质量控制指标之一,黄酮化合物主要包括毛蕊异黄酮苷、毛蕊异黄酮、刺芒柄花苷及芒柄花素等[1]。为此,选择以上4种黄酮作为参考指标,用于评价固体发酵对黄芪成分的影响。
中药发酵作为中药加工的一种炮制工艺已具有悠久的历史,目前,应用现代生物技术发酵转化中药也已成为中药领域的研究热点。应用具有分解和转化能力的微生物发酵中药,可保护中药活性成分免受煎、煮、熬、炼、蒸、浸等传统工艺造成的破坏,能够提高中药有效成分的提取率,降解中药大分子物质,产生新的活性物质,降低中药毒副作用[2-4]。然而,发酵中药作为中药产品的一种新型制剂尚无规范性的质量标准,这严重影响了发酵中药质量的有效控制和临床应用。随着,液相色谱技术的发展,为探究中药发酵前后成分及含量的变化提供了有效手段。在适宜的色谱条件下,可将中药中不同成分在不同时间节点洗脱,并由检测器检测,从而直观的显示出中药不同成分及相对含量,这为比较发酵前后成分差异提供了可靠依据[5]。研究应用HPLC-UV方法,对产纤维素酶解淀粉芽胞杆菌发酵黄芪散剂中4种黄酮含量及色谱图进行了比较,旨在为其质量控制提供技术支撑,为生产应用提供质量保障。
1 材料与方法
1.1 仪器 日本岛津SPD-20A紫外检测器,LC-20AT二元泵,Labsolution色谱工作站,日本岛津公司产品;KQ5200B超声清洗仪,昆山市超声仪器有限公司产品;电子天平,梅特勒-托利多仪器(上海)有限公司产品;ZNCL-S自能恒温磁力搅拌器,上海羌强仪器设备有限公司产品;PINE-TREE帕恩特标准试剂级超纯水机,北京湘顺源科技有限公司产品;恒温振荡器HZQ-FX型,哈尔滨市东联电子技术开发有限公司产品。
1.2 菌株与试剂 产纤维素酶解淀粉芽胞杆菌SSYB株,由本研究室分离鉴定并保存;刺芒柄花苷、芒柄花黄素含量、毛蕊异黄酮苷含量、毛蕊异黄酮(含量均≥98%,批号分别为:R04J6F2、KO1014CB14、PS0912SA13、P29M6R2),上海源叶生物科技有限公司产品;黄芪,河北凯达药业有限公司产品;乙腈(色谱纯,批号:20161210),天津市科密欧化学试剂有限公司产品;甲醇(色谱纯,批号:20161108),天津市科密欧化学试剂有限公司产品。
1.3 方法
1.3.1 标准品制备 精密称取标准品毛蕊异黄酮苷7.9 mg,刺芒柄花苷3.2 mg,毛蕊异黄酮2.9 mg,芒柄花素6.1 mg,置于10 mL容量瓶中,加入适量甲醇,超声溶解,定容至刻度,备用。
1.3.2 发酵黄芪及对照品制备 发酵黄芪:按照黄芪粉30%、黄豆粉10%、CaCO30.2%、水59.8%组分制备发酵培养基。取解淀粉芽孢杆菌种子液,以2%接种量接种黄芪发酵培养基,在37 ℃发酵培养72 h,发酵物中活菌数约为7.67×108CFU/g。
对照黄芪:另外取无菌肉汤,按2%接种量接种黄芪固态发酵培养基,按照发酵黄芪制备方法进行处理。
1.3.3 成分提取 取发酵黄芪与非发酵黄芪各5 g,分别加入甲醇30 mL,超声提取30 min,重复提取3次,合并提取液,于70 ℃水浴挥干溶剂,加8 mL甲醇溶液超声溶解,待完全溶解后定容至10 mL,摇匀,经0.45 μm滤膜过滤,超声除气,备用。
1.3.4 检测方法建立
1.3.4.1 色谱条件 Inertsustain C18色谱柱(150 mm×4.6 mm,5 μm),流动相:乙腈和水,检测波长:254 nm,柱温:25℃,流速:1 mL/min,进样量:20 μL,梯度洗脱程序见表1。

表1 梯度洗脱条件Tab 1 Conditions of gradient elution
1.3.4.2 适应性考察 取标准品溶液,经超声,过0.45 μm滤膜后进样20 μL,考察4种黄酮对上述色谱条件的适应性。
1.3.4.3 线性关系考察 用甲醇稀释标准品溶液,分别为原浓度的1、1/2、1/4、1/8、1/16、1/32、1/64倍,摇匀,经0.45 μm滤膜过滤,超声除气,备用。按上述色谱条件对毛蕊异黄酮苷、刺芒柄花苷、毛蕊异黄酮、芒柄花素4种黄酮含量进行测定,以液相色谱峰峰面积(A)对浓度(mg/L)(C)绘制标准曲线。
1.3.4.4 精密度试验 精密吸取标准品溶液20 μL,
重复进针6次,测定4种黄酮峰面积,对精密度试验进行考察。
1.3.4.5 稳定性试验 取标准品溶液分别于放置0、2、4、6、8、10 h 进针1次,测其峰面积,对稳定性试验进行考察。
1.3.5 黄酮含量的测定 取发酵黄芪及对照黄芪提取液各20 μL,按上述色谱条件对两种提取液样品中的黄酮含量进行测定。
2 结 果
2.1 检测方法建立
2.1.1 适应性考察 取标准品溶液,经超声,过0.45 μm滤膜后进样20 μL,结果见图1。毛蕊异黄酮苷、刺芒柄花苷、毛蕊异黄酮、芒柄花素标准品分别在13.024、21.102、26.900、40.749 min出现独立峰Ⅰ、Ⅱ、Ⅲ和Ⅳ。发酵组及对照组中的目标峰分离效果较好,且对不同成分峰的分离程度较为理想,可用于比较黄芪发酵前后成分的变化。

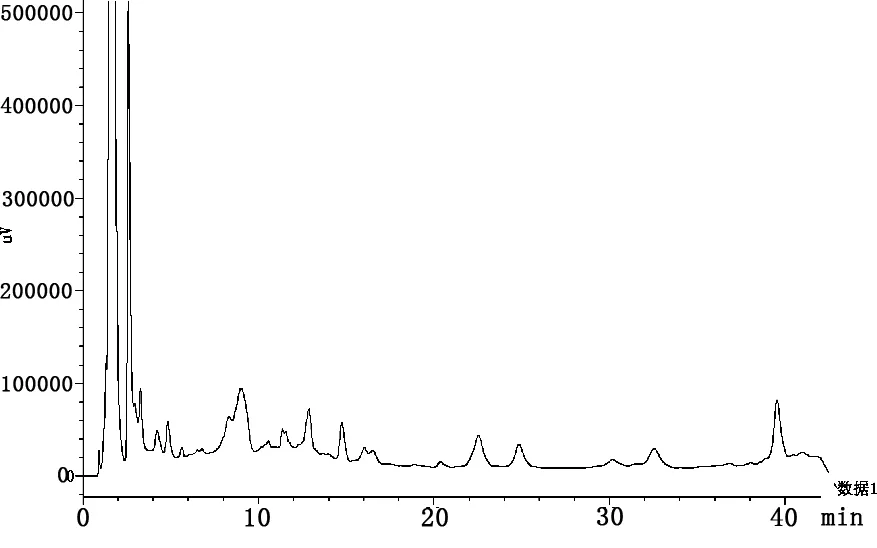

Ⅰ:毛蕊异黄酮苷;Ⅱ:刺芒柄花苷;Ⅲ:毛蕊异黄酮;Ⅳ:芒柄花素Ⅰ:Calycosin 7-O-glucoside;Ⅱ:Ononin;Ⅲ:Calycosin;Ⅳ:Formononetin图1 标准品(A)、黄芪发酵组(B)及黄芪对照组(C)色谱图Fig 1 Standard product chromatogram (A), Astragalus fermentation chromatogram (B) and Radix astragalus chromatogram(C).
2.1.2 线性关系考察 按上述色谱条件对毛蕊异黄酮苷、刺芒柄花苷、毛蕊异黄酮、芒柄花素4种黄酮含量进行测定,以液相色谱峰峰面积(A)对浓度(mg/L)(C)绘制标准曲线。建立回归方程,分别为:AⅠ=640.91C+246.75(r=0.9992);AⅡ=716.96C+174.57(r=0.9991);AⅢ=119.86C+253.17(r=0.9995);AⅣ=1270.93C+194.64(r=0.9992)。结果表明,4种黄酮色谱峰面积与浓度呈良好线性的浓度范围分别是12.34~790、5.0~320、4.53~290、9.53~610 mg/L。
2.1.3 精密度试验 精密吸取标准品溶液20 μL,重复进针6次,测定4种黄酮峰面积。RSD分别为1.21%、0.98%、1.64%和1.12%。结果表明,进样精密度良好。
2.1.4 稳定性试验 取标准品溶液分别于放置0、2、4、6、8、10 h进针1次,测其峰面积。4种黄酮峰面积的RSD分别为1.42%、1.03%、1.83%和1.34%。结果表明,供试品溶液在10 h内稳定。
2.2 黄酮含量的测定 取发酵黄芪及对照黄芪提取液各20 μL,按上述色谱条件对两种提取液样品中的黄酮含量进行测定。由表2可知,发酵黄芪与对照黄芪提取液中均含有黄酮中的3种成分,即毛蕊异黄酮苷、毛蕊异黄酮和芒柄花素。发酵黄芪含量分别为12.236±0.232、0.201±0.021和0.737±0.041 mg/g;对照黄芪含量分别为0.327±0.013、5.453±0.078和12.847±0.118 mg/g。发酵黄芪中毛蕊异黄酮苷含量显著高于对照黄芪(P<0.01),而毛蕊异黄酮和芒柄花素含量显著低于对照黄芪(P<0.01)。

表2 黄芪发酵前后4种黄酮含量Tab 2 The content of four flavonoids before and after
“-”未在相对保留时间出现色谱峰
2.3 发酵黄芪色图谱比对 发酵黄芪与对照黄芪色谱图比较发现,两者指纹图谱差异较大,相似度低,说明黄芪经发酵后成分发生了很大变化,见图2。经比对分析可知,发酵黄芪与对照黄芪保留时间点一致的吸收峰(RSD<1%)共有15个,占出峰总数的30%~33%,但相同保留时间点的吸收峰面积差异较大,其中,在0.928、1.326、9.017、14.762、22.538、24.850、41.657 h 7个保留时间点,发酵黄芪的吸收峰面积均较对照黄芪有所增大,增大幅度为170%~810%,差异极显著(P<0.01)。而另8个保留时间点的吸收峰面积均较对照黄芪缩小,其中,有1个保留时间点的吸收峰面积缩小69.08%,其它7个保留时间点均缩小90%以上。
以大于色谱峰总面积2%的单峰为目标峰,发酵黄芪中有8个,而对照黄芪有15个,其中,发酵黄芪在1.560、1.752、2.604、3.279、8.338、39.546 h出现6个新的吸收峰,而在1.675、1.965、2.417、5.240、7.779、17.988、20.109 h的7个原有吸收峰消失。此外,与对照黄芪比较,发酵黄芪在1.560、1.752 h新出现2个极高峰,其峰面积分别占总面积的33.4%、22.2%,而在1.965 h点处峰面积占总面积23.29%的1个原有极高峰消失,见图3、图4。试验结果表明,黄芪发酵后产生了许多新的特征吸收峰,同时原有的多数吸收峰消失,这说明黄芪经发酵后,原有成分及含量发生了变化,一些原有成分消失,同时也产生了新的物质。
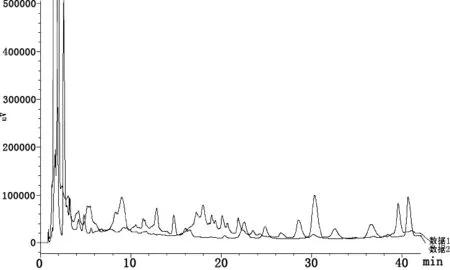
数据1:发酵黄芪色谱图;数据2:对照黄芪色谱图Data1 Fermentation of astragalus chromatogram;Data2 Control of astragalus chromatogram图2 黄芪发酵前后液相色谱对比图Fig 2 Comparison diagram of liquid chromatography before and after fermentation of astraglus
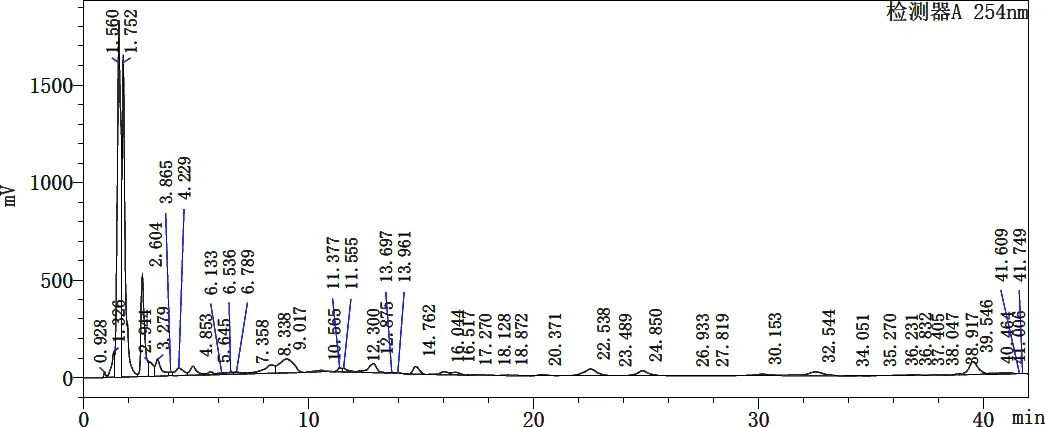
图3 发酵黄芪色谱图Fig 3 Fermentation of astragalus chromatogram

图4 黄芪色谱图Fig 4 Astragalus chromatogram
3 讨论与小结
中药发酵制品多以主要有效成分及其含量为质量控制制备,然而由于中药成分繁多,生物发酵过程复杂,仅以中药主要活性成分含量作为质量控制指标难以保证中药制品质量。一些学者提出,采用中药色谱指纹图谱技术,对中药及其制品进行整体性的质量控制与评价。史玉霞[6]运用检测波长254 nm,乙腈-磷酸为流动相,梯度洗脱,对何首乌提取液益生菌发酵前后化学成分进行研究,各共有峰相对保留时间的RSD均小于0.7%,该方法稳定性好,为评价何首乌药材不同炮制品的质量奠定了基础。李岗[7]等运用HPLC法对消栓口服液发酵前后指纹图谱进行比较,发现二者指纹图谱间差异较大,相似度低,采用国家药典委员会“中药色谱指纹图谱相似度评价系统”对15批样品进行相似度评价,结果符合指纹图谱研究的技术要求。本试验采用乙腈和水为流动相,梯度洗脱,检测波长254 nm,柱温25 ℃;流速1 mL/min,在此条件下,检测发酵黄芪与对照黄芪样品,结果目标峰及其他成分峰分离效果好,适于比较发酵黄芪成分的变化。
依据标准品在液相色谱中形成的目标峰,可以判断样品对应色谱峰的物质[8]。试验选择了黄芪中4种黄酮成分作为参考指标,评估生物发酵对黄芪成分及其含量的影响。在检测的4种黄酮成分中,发酵黄芪毛蕊异黄酮苷含量显著升高,而毛蕊异黄酮和芒柄花素含量显著降低。这说明黄芪发酵后,一些物质转化生成为毛蕊异黄酮苷,而毛蕊异黄酮和芒柄花素基本被转化为其他物质。黄芪经发酵后,虽然有15种成分未被全部转化利用,但其含量发生了显著变化,其中,有7种成分含量较对照黄芪升高了1.7~8.1倍,而另8种成分含量却显著降低,且其中7种成分近于消失。在单峰面积大于色谱峰总面积2%的15种成分中,黄芪经发酵后有7种成分消失,其中包括一种含量占23.29%的主要物质,同时又生成6种新物质,且有两种新生主要物质,含量分别为33.4%、22.2%,为进一步考察黄芪中其他主要成分的变化,实验也分别运用紫外分光光度法及液相色谱法对黄芪多糖、黄芪甲苷发酵先后质量变化进行了测定,对比发现,发酵后黄芪多糖及黄芪甲苷的含量均有升高,分别为升高了39.59%[9]、37.59%。由此推测,解淀粉芽孢杆菌生长代谢能将黄芪成分转化、利用,同时也产生了一些新物质,这一结果被许多学者研究证实。阮鸣等[10]研究表明,在黄芪发酵过程中,黄芪甲苷被转化形成6-O-B-D-葡萄糖基-环黄芪醇,该转化物具有显著的抗氧化效应,具有增效的作用。肖丽丽等[11]经薄层层析检测证实,生物发酵可将黄芪总皂苷中的部分皂苷转化为黄芪甲苷。
发酵中药作为一种中药新产品尚无规范性的质量标准,这严重影响了发酵中药质量的有效控制和临床应用,本文运用HPLC法,通过对解淀粉芽孢杆菌发酵黄芪有效成分及色谱图对比,发现黄芪发酵前后其成分发生了很大变化,但究竟转化利用了何物质,以及产生了何种新物质及其发生机理还有待进一步研究。中药成分复杂,要准确测定其各成分及含量难度较大,测定中药指纹图谱,可初步确定中药化学组成及含量差异。在中药指纹图谱测定中,高效液相色谱法具有流动相选择广,色谱柱可反复利用,简便,快速等特点,因此,本文对产纤维素酶解淀粉芽胞杆菌发酵黄芪的一些成分及色谱图进行了研究,旨在为发酵黄芪制品质量控制提供技术参考。
参考文献:
[1] 李小兵, 谢晓梅, 周铜水. 高效液相色谱法同时测定黄芪中4种异黄酮的含量[J]. 安徽医药, 2008, 12(5): 413-414.
Li X B, Xie X M, Zhou T S,etal. Simultaneous determination of four isoflavonoids in radix astragali by HPLC[J]. Anhui Medical and Pharmaceutical Journal, 2008, 12(5): 413-414.
[2] 赵雯玮, 陈祥贵, 李 鑫, 等. 微生物发酵在中药研究中的应用[J]. 生命科学仪器, 2008, 6(10): 3-5.
Zhao W W, Chen X G, Li X,etal. Microbial fermentation in the application of traditional Chinese medicine research[J].Life Science Instruments, 2008, 6(10): 3-5.
[3] Amachandra S R, Ravishankar G A. Plantcell cultures: Chemical Facories of secondary metabolites[J]. Biotechnology Advances, 2002, 20(2): 101-103.
[4] 张冬青, 揭广川. 现代发酵技术在提高中药药用效能方面的作用[J]. 广东轻工职业技术学院学报, 2005, 4(1): 34-37.
Zhang T Q, Jie G C. The role of modern fermentation technology in improving the medicinal potency of traditional chinese medicine[J]. Journal of Guangdong Industry Technical College, 2005, 4(1): 34-37.
[5] 戴 焱. 中草药混菌发酵生产新型生物制剂的研究[D]. 安徽: 安徽农业大学, 2013.
Dai Y. Study on the fermentation of chinese herbal medicine with mixed bacteria to produce new biologics[D]. Anhui: Anhui Agricultural University, 2013.
[6] 史玉霞, 周洪雷, 王 真, 等. 何首乌提取液益生菌发酵前后化学成分变化研究[J]. 山东中医药大学学报, 2014, 38(2): 161-163.
Shi Y X, Zhou H L, Wang Z,etal. studies on the changes of chemical components of polygonum multiflorum extract before and after fermentation[J]. Journal of Shandong University of TCM, 2014, 38(2): 161-163.
[7] 李 岗, 周洪累, 史玉霞, 等. 不同制备工艺消栓口服液发酵前后HPLC指纹图谱的比较研究[J]. 时珍国医国药, 2015, 26(5): 1127-1130.
Li G, Zhou H L, Shi Y X, Comparative research on HPLC fingerprint of xiaoshuan oral liquid prepared by diferent processes before and after fermentation[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(5): 1127-1130.
[8] 胡芳弟, 赵健雄, 封士兰, 等. 黄芪的高效液相色谱指纹图谱及主成分含量测定[J]. 中药材, 2004, 27(11): 831-834.
Hu F D, Zhao J X, Feng S L,etal. Studies on chromatography fingerprint of huangqi by HPLC[J]. Journal of Chinese Medicinal Materials, 2004, 27(11): 831-834.
[9] 侯美如, 刘 宇, 王 岩, 等. 解淀粉芽孢杆菌固态发酵黄芪中有效成分的变化[J]. 中国兽医杂志, 2017, 53(3): 64-68.
Hou M R, Liu Y, Wang Y,etal. Changs of effective components of Astragalus in the solid fermentation of bacillus amyloliquefaciens[J]. Chinese Journal of Veterinary Medicine, 2017, 53(3): 64-68.
[10] 阮 鸣, 张李阳, 喻 斌, 等. 黄芪双向性固体发酵过程中黄芪甲苷的转化研究[J]. 中药材, 2010, 33(3): 339-343.
Ruan M, Zhang L Y, Yu B, Transformation of astragaloside Ⅳ in bidirectional solid fermenting of astragalus membranaceus[J], Journal of Chinese Medicinal Materials, 2010, 33(3): 339-343.
[11] 肖丽丽, 吴晓倩, 鱼红闪. 黄芪皂苷生物转化物质的分离提取[J]. 大连轻工业学院学报, 2006, 25(2): 86-88.
Xiao L L, Wu X Q, Yu H S. Separation and purification of astragaloside product from biotransformation[J]. Journal of Dalian Polytechnic University, 2006, 25(2): 86-88.

