利用蟹壳制备乳酸钙和甲壳素的技术研究
韩晓梅,王晨笑,杨鑫,王博,桑亚新,孙纪录,*
(1.河北农业大学食品科技学院,河北保定071001;2.中粮营养健康研究院有限公司营养健康与食品安全北京市重点实验室,北京102209;3.中粮营养健康研究院有限公司老年营养食品研究北京市工程实验室,北京102209)
随着人工养殖技术的发展,我国螃蟹产量逐年递增,在加工或食用过程中产生大量的蟹壳。长期以来,蟹壳除少量被低值化利用之外,多是作为垃圾扔掉,既浪费资源,又污染环境。实际上,蟹壳中含有丰富的化学物质,其中包括蛋白质、矿物质和甲壳素,矿物质含量约占50%,甲壳素含量约为15%~25%。
甲壳素(chitin)又称几丁质,广泛存在于甲壳类海洋节肢动物中[1]。甲壳素是一种高分子的糖化合物,吸湿性强,能够吸附重金属离子,无毒无味,可以作为食品填充剂、稳定剂、脱色剂等,已在医药、农业、轻纺、环保等领域广泛应用[2-4]。在工业上从蟹壳中提取甲壳素,主要过程为在机械搅拌下用盐酸对蟹壳脱钙,用碱脱蛋白质[5],目前,甲壳素及其衍生物的制备广受关注[6-9],如王金香等以华溪蟹蟹壳为原料,采用稀盐酸脱钙和稀碱脱蛋白,甲壳素收率为13%[10]。在本文中用碱性电解水(basic electrolyzed water,BEW)代替传统的碱处理脱蛋白,BEW通过电解稀盐(通常是NaCl)溶液从阴极产生,其pH值可达12左右,氧化还原电位约为-80 mV。关于BEW的应用,已有诸多研究报道[11],如BEW可以作为去污剂等。BEW和传统碱液脱蛋白工艺中使用的NaOH溶液在酸碱性方面具有极高的相似性,且电解水对人体健康和环境无害,安全性好,可现场生产,操作简便,价格低廉[12]。因此研究BEW处理蟹壳对开发一种新型的绿色环保的蟹壳脱蛋白技术工艺具有一定现实意义。
除此之外,蟹壳中的矿物质含量高达50%,主要以碳酸钙的形式存在,是一种天然的绿色钙源。然而,碳酸钙不易被人体吸收利用,而乳酸钙以其高溶解度、高吸收率和高安全性等优点成为补钙剂的优选[13],可以作为一种营养增补剂[14]、稳定剂及增稠剂[15]等,还可以用作面包发酵粉的膨松剂和缓冲剂。本研究拟利用乳酸,采用直接中和的方法将虾蟹壳中的碳酸钙转变为乳酸钙[16-17],使其广泛应用于工业、食品及医疗行业等,并结合碱性电解水相继处理脱蛋白质提取甲壳素,从而为综合利用蟹壳资源提供一条高效途径。
1 材料与方法
1.1 材料与仪器
蟹壳:河北省黄骅市产梭子蟹;其他试剂:均为分析纯。
电解水发生器:河北农业大学食品科技学院食品微生物学实验室自制;PHS-3DW型pH计:安徽合肥桥斯仪器设备有限公司;3K15型低温冷冻离心机:SIGMA;FA1004型电子天平:上海良平仪器仪表有限公司;XL-100型马弗炉:河南市鹤壁亿欣仪器仪表有限公司;JJ-1型电动搅拌器:常州国宇仪器制造有限公司。
1.2 试验方法
1.2.1 蟹壳粉的制备
蟹壳清洗,然后放入50℃电热鼓风干燥器中干燥12 h,将烘干的蟹壳粉碎,过筛,制备120目蟹壳粉末备用。
1.2.2 乳酸钙的制备
称取10 g蟹壳粉置于250 mL锥形瓶中,缓慢加入一定量的乳酸与其发生中和反应。为了防止发生溢液现象,需边加乳酸边搅拌。利用恒温水浴摇床控制反应温度,当不再有气泡产生时,则表明反应完全。待反应完全后,将反应溶液加热升温至70℃,溶解产生的乳酸钙,趁热抽滤得到乳酸钙母液。利用旋转蒸发仪于65℃下加热浓缩,收集浓缩液并冷却静置结晶24 h。分离晶体与母液,由于乳酸钙在水中的溶解度比较大,结晶后母液中仍留有大量的乳酸钙,需要浓缩后再次结晶,合并晶体。加入适量无水乙醇,洗涤反应生成的乳酸钙晶体,除去未反应的乳酸及表面附着的其他残留物。将无水乙醇洗后的乳酸钙置于电热鼓风干燥箱进行低温静态干燥,干燥温度为80℃,干燥时间8 h,将样品粉碎、过筛、包装得到白色粉末状乳酸钙成品。
1.2.3 乳酸钙制备条件优化
遵循单一因素变量的原则,研究蟹壳粉粒径大小、反应温度、反应时间、料液比、乳酸稀释倍数对乳酸钙产率的影响,从而设计单因素试验,确定实现产率最大化的最佳反应条件。
1.2.3.1 蟹壳粉粒径大小的确定
固定条件:蟹壳粉使用量为10 g,反应温度为25℃,反应时间为1 h,料液比为1∶10(g/mL),乳酸稀释倍数为9倍。蟹壳粉粒径大小分为3个水平:80、120、160目。待反应完全后,经浓缩,洗涤,干燥即得产品,分别测定乳酸钙产率。
1.2.3.2 乳酸稀释倍数的确定
固定条件:蟹壳粉使用量为10 g,蟹壳粒径大小为120目,反应温度为25℃,反应时间为1 h,料液比为1 ∶10(g/mL)。乳酸稀释倍数分为4 个水平:4、9、14、19倍。待反应完全后,经浓缩,洗涤,干燥即得产品,分别测定乳酸钙产率。
1.2.3.3 料液比的确定
固定条件:蟹壳粉使用量为10 g,蟹壳粒径大小为120目,反应温度为25℃,反应时间为1 h,乳酸稀释倍数为9倍。料液比分为4个水平:1∶6、1∶8、1∶10、1 ∶12(g/mL)。待反应完全后,经浓缩,洗涤,干燥即得产品,分别测定乳酸钙产率。
1.2.3.4 中和反应温度的确定
固定条件:蟹壳粉使用量为10 g,蟹壳粒径大小为120 目,反应时间为1 h,料液比为1 ∶10(g/mL),乳酸稀释倍数为9倍。中和反应温度分为4个水平:25、40、55、70℃。待反应完全后,经浓缩,洗涤,干燥即得产品,分别测定乳酸钙产率。
1.2.3.5 中和反应时间的确定
固定条件:蟹壳粉使用量为10 g,蟹壳粒径大小为120目,反应温度为25℃,料液比为1∶10(g/mL),乳酸稀释倍数为9倍。中和反应时间分为4个水平:1.0、1.5、2.0、2.5 h。待反应完全后,经浓缩,洗涤,干燥即得产品,分别测定乳酸钙产率。
1.2.4 乳酸钙产品的理化指标检测
对于使用乳酸处理蟹壳粉制得的乳酸钙产品,依据GB 1886.21-2016《食品安全国家标准食品添加剂乳酸钙》,分别测定其乳酸钙含量、加热减量及砷、铅、镁的含量。
1.2.5 碱性电解水后继处理蟹壳粉脱蛋白质提取甲壳素
蟹壳粉经乳酸处理脱矿物质后剩余的残渣经过滤、干燥后备用。取10 g残渣放入碱性电解槽中,加入不同浓度NaCl(1%和0.1%)水溶液1 L,静置10min测定初始pH值。接通电源电解,将电压设定为20 V,随着碱性电解水产生,其对蟹壳粉脱蛋白质作用也同步进行。连续处理期间,不间断搅拌,并按照一定时间间隔测定电解液pH值,6 h后停止电解,抽滤除去电解液,然后,将蟹壳粉残渣洗涤至中性,5 000 r/min离心10min,于60℃干燥8 h,称重测定样品的收率、灰分含量及蛋白质含量。
1.2.6 NaOH后继脱蛋白从蟹壳中提取甲壳素
蟹壳粉经乳酸处理脱矿物质后的残渣经过滤、干燥后备用。取10 g残渣,加入一定量的2 mol/LNaOH溶液,于70℃下反应4 h,以除去所有蛋白质。过滤,将蟹壳粉残渣洗涤至中性,5 000 r/min离心10min,于60℃下干燥8 h,即得甲壳素粗品。
以乳酸和NaOH联合处理提取的甲壳素做参照,计算经乳酸和碱性电解水联合处理蟹壳后蛋白质的含量及脱除率。
1.2.7 灰分含量测定方法
参照国标GB 5009.4-2016《食品安全国家标准食品中灰分的测定》的方法,测定甲壳素产品的灰分含量。
1.2.8 蛋白质含量及蛋白质脱除率测定方法
蛋白质脱除率测定的原理:由于蟹壳中的甲壳素同样含有氮元素,单纯使用凯氏定氮法并不能准确地计算出样品中蛋白质的含量,因此,本研究利用凯氏定氮法测定碱性电解水处理后的样品及传统无机酸碱法提取的甲壳素中的含氮量,通过前者样品中的氮含量减去后者甲壳素中的氮含量,即为蛋白质中的氮含量,然后乘以蛋白质转换系数,即可计算出样品中的蛋白质含量及蛋白质脱除率。
凯氏定氮法:称取充分混匀的固体样品0.1 g,精确至0.001 g,移入定氮瓶中,加入0.2 g硫酸铜,6 g硫酸钾及10 mL浓硫酸,用消化炉消化3 h至液体呈蓝绿色并澄清透明后,取下冷却,用凯氏定氮仪蒸馏滴定,记录试验数据。
蛋白质含量ω及蛋白质脱除率η,分别按式(1)、(2)计算:

式中:m1为碱性电解水处理蟹壳脱蛋白后残渣样品的质量,g;m2为传统无机酸碱法处理蟹壳提取甲壳素的质量,g;ω0为20 g蟹壳样品中蛋白质含量,%;ω1为碱性电解水处理蟹壳脱蛋白后残渣样品的含氮量,%;ω2为传统无机酸碱法处理蟹壳提取甲壳素的含氮量,%。
2 结果与分析
2.1 乳酸钙制备条件优化
控制单一因素变量,研究蟹壳粒径大小、反应温度、反应时间、料液比、乳酸稀释倍数对乳酸钙产率的影响,从而确定实现产率最大化的最佳反应条件,试验结果如图1所示。

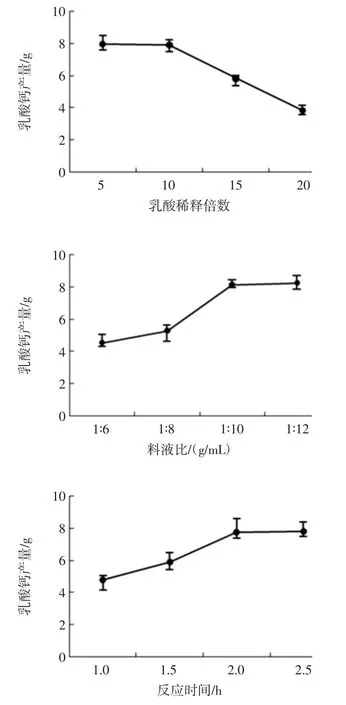
图1 乳酸钙制备的条件优化Fig.1 Conditional optimization for preparation of calcium lactate
乳酸钙提取的单因素试验结果表明,蟹壳粒径的大小与中和反应温度对乳酸钙提取的影响没有明显差异,选择120目蟹壳在25℃下与乳酸中和提取乳酸钙,随着乳酸稀释倍数的增加,乳酸浓度越低,提取的乳酸钙产量越低,乳酸适宜的稀释倍数为9倍稀释,此时乳酸的浓度为1.14 mol/L,料液比为1∶10(g/mL)时,乳酸钙的产量明显增加,继续增加乳酸的量时则达到一个相对平衡的状态,由图1中反应时间对乳酸钙产量的影响从而确定中和反应的时间为2 h。
综合以上分析的结果,以蟹壳作为原料采用直接中和的方法制备乳酸钙的最优条件为:120目蟹壳粉20 g,9倍稀释的乳酸(1.14 mol/L)以 1 ∶10(g/mL)的料液比于25℃下与蟹壳中的钙盐发生中和反应,反应时间为2 h,经过浓缩、结晶、洗涤、重结晶后,最终的得到的乳酸钙的最高产量为0.89 g/g蟹壳粉。
2.2 乳酸钙产品的质量评价
利用乳酸中和蟹壳中的钙盐从而实现脱矿物质及制备乳酸钙,对乳酸钙的各项指标进行检测,试验结果如表1所示。
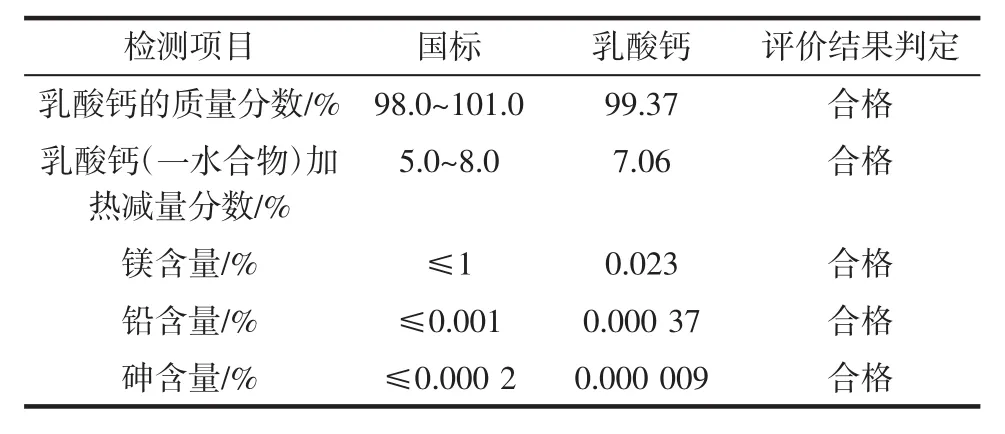
表1 乳酸钙各项产品指标Table 1 The product indicators of the calcium lactate
表1结果表明,制备的乳酸钙质量分数达到99.37%,加热减量分数为7.06%,镁、铅和砷含量均在国标规定范围内,乳酸钙的各项指标均符合国家标准。
2.3 碱性电解水后继脱蛋白质过程中pH值变化
分别用0.1%和1%的NaCl溶液制备碱性电解水,在碱性电解槽中加入一定量乳酸脱矿物质后的蟹壳残渣,连续电解,保持OH-的不断产生,使得蟹壳粉中的蛋白质得以持续脱除。定时测定电解过程(脱除过程)中的pH值变化,结果如图2。

图2 不同浓度NaCl制备的碱性电解水在连续处理蟹壳粉过程中的pH值变化Fig.2 The pH changes of BEW prepared with different concentrations of NaCl during the continuous treatment for crab shell powder
由图2可见,在用碱性电解水处理蟹壳脱蛋白过程中,分别用1%和0.1%的NaCl溶液制备的碱性电解水,在相同的反应时间下电解液的pH值均有所上升,且在第1个小时之内上升最快并逐渐趋于稳定,其中由1%NaCl制备的的碱性电解水在脱蛋白过程中pH值变化趋势更显著,从7.07上升到12.84,而由0.1%NaCl制备的碱性电解水在相同的脱蛋白时间下其pH值从7.08上升到12.18。从图中可以明显看出利用1%NaCl制备的碱性电解水能够在较快的时间内达到较高的碱度,并且在电解水电解过程中伴随着产热,有利于碱性电解水对蟹壳的脱蛋白质作用。
2.4 碱性电解水后继脱蛋白质提取甲壳素
蟹壳经过乳酸脱矿物质后,取脱矿物质后的样品10 g,分别用1%NaCl和0.1%NaCl溶液制备的碱性电解水脱蛋白,并用NaOH处理作对照,研究乳酸和碱性电解水联合处理提取甲壳素的效果,试验结果如表2所示。

表2 乳酸和碱性电解水联合处理蟹壳提取的甲壳素常规指标Table 2 Standard test results for chitin extracted by lactic acid and BEW treatment from crab shell powder
数据表明,用1%NaCl溶液制备的碱性电解水对乳酸脱矿物质后的样品进行脱蛋白,蛋白质含量由52%减少到7.53%,蛋白质脱除率为90.54%,测得甲壳素的灰分含量为0.81%,表明用乳酸和碱性电解水联合处理能较好的实现脱矿物质和脱蛋白提取甲壳素,并且,高浓度的NaCl溶液制备的碱性电解水脱蛋白质程度更高。
3 结论和讨论
为了实现蟹壳中钙源与甲壳素的综合利用,研究了乳酸与碱性电解水联合处理对矿物质和蛋白质的脱除程度的影响,并对制备的乳酸钙进行检测,经过乳酸钙制备条件的优化,9倍稀释的乳酸(1.14 mol/L)以1∶10(g/mL)的料液比于25℃下与蟹壳中的钙盐发生中和反应,反应时间为2 h,最终乳酸钙的最高产量为0.89 g/g蟹壳粉,矿物质脱除率为94.37%,Zakaria等利用副干酪乳杆菌A3发酵螯虾废料,5 d后矿物质脱除率为61.0%[18];Rao M S等用酸调节发酵体系的pH,并维持在6.0,结果发现植物乳杆菌脱除虾壳中矿物质达88%[19],由此可见,相对于乳酸菌发酵法而言,利用乳酸脱矿物质效果更好,矿物质脱除程度更高。并且制备的乳酸钙质量分数达到99.37%,加热减量分数为7.06%,镁、铅和砷元素含量以及水溶解试验、游离酸和游离碱试验、挥发性脂肪酸试验均符合国家标准。然后将乳酸脱矿物质后的残渣用1%NaCl溶液制备的碱性电解水脱蛋白,蛋白质含量由52%减少到7.53%,蛋白质脱除率为90.54%,灰分含量为0.81%,该试验结果要优于W.J.Jung等从蟹壳中筛选出的产蛋白酶菌株粘质沙雷氏菌-FS3的脱矿物质和脱蛋白效果[20]。并且1%NaCl溶液制备的碱性电解水较0.1%NaCl溶液制备的碱性电解水脱蛋白程度更高。试验表明,用乳酸和碱性电解水联合处理能较好的实现脱矿物质和脱蛋白质制备乳酸钙和甲壳素,实现蟹壳资源的有效利用。
[1]Yang S F,Zhang H C,Shi Y X,et al.The new technologies in chitin/chitosan preparation[J].Advanced Materials Research,2013,666:143-150
[2]孟凡欣,吴丽艳,徐盼菊,等.虾壳甲壳素提取工艺优化及其辅助降血糖活性研究[J].食品研究与开发,2016,37(5):95-100
[3]简慧兰.甲壳素/壳聚糖的制备及其在食品工业中的应用[J].南通职业大学学报,2003,17(1):56-58
[4]蒋小姝,莫海涛,苏海佳,等.甲壳素及壳聚糖在农业领域方面的应用[J].中国农学通报,2013,29(6):170-174
[5]顾正桂,林军,顾美娟.甲壳素系列产品生产过程的优化及装置的改进[J].现代化工,2009,29(1):62-65,67
[6]蔚鑫鑫,刘艳,吴光旭.小龙虾壳中甲壳素的提取及壳聚糖的制备[J].湖北农业科学,2013,52(13):3120-3123
[7]许庆陵,曾庆祝.虾壳甲壳素及壳聚糖提取工艺的研究[J].中国食品添加剂,2013(6):104-109
[8]权静.蟹壳制备壳聚糖的工艺研究[J].广州化工,2012,40(15):105-107
[9]Mohammed M H,Williams P A,Tverezovskaya O.Extraciton of chitin from prawn shells and conversion to low molecular mass chitosan[J].Food Hydrocolloids,2013,31(2):166-171
[10]王金香,王兰.华溪蟹几丁质的提取与壳聚糖的制备[J].食品工业科技,2005,26(3):109-111
[11]Sun J L,Zhang S K,Chen J Y,et al.Efficacy of acidic and basic electrolyzed water in eradicating Staphylococcus aureus biofilm[J].Canadian Journal of Microbiology,2012,58(4):448-454
[12]Tanaka N,Fujisawa T,Daimon T,et al.The effect of electrolyzed strong acid aqueous solution on hemodialysis equipment[J].Artificial Organs,1999,23(12):1055-1062
[13]江敏,李鉴,梁洁玲,等.牡蛎壳合成L-乳酸钙的工艺研究[J].食品科技,2008,33(3):123-125
[14]Daengprok W,Garnjanagoonchorn W,Mine Y.Fermented pork sausage fortified with commercial or hen eggshell calcium lactate[J].Meat Science,2002,62(2):199-204
[15]白海涛.鸡蛋壳制备食品级乳酸钙的新工艺研究[D].西安:西北大学,2006
[16]Rubilar O E,Healy M G,Healy A.Bioprocessing of avian eggshells and eggshell membranes using lactic acid bacteria[J].Journal of Chemical Technology&Biotechnology,2006,81(6):900-911
[17]Lee Y K,Kim S D.Preparation and characteristics of calcium lactate from black snail[J].Journal of Food Science&Nutrition,2003,8(2):166-172
[18]Zakaria Z,Hall G M,Shama G.Lactic acid fermentation of scampi waste in a rotating horizontal bioreactor for chitin recovery[J].Process Biochemistry,1998,33(1):1-6
[19]Rao M S,Stevens W F.Chitin production by Lactobacillus,fermentation of shrimp biowaste in a drum reactor and its chemical conversion to chitosan[J].Journal of Chemical Technology&Biotechnology,2005,80(9):1080-1087
[20]Jo G H,Jung W J,Kuk J H,et al.Screening of protease-producing Serratia marcescens FS-3 and its application to deproteinization of crab shell wastefor chitin extraction[J].Carbohydrate Polymers,2008,74(3):504-508

