hRAMP1基因修饰BMSCs对心脏的保护作用及其机制
许官学 王正龙 赵然尊 龙仙萍 陈文明 石 蓓
(遵义医学院附属医院心血管内科,贵州 遵义 563003)
急性心肌梗死(AMI)是临床常见的急危重症,患者易发生心力衰竭,预后差,严重影响患者生命质量〔1〕。骨髓间充质干细胞(BMSCs)是一种具有自我增殖和多种分化潜能的干细胞〔2〕,目前在细胞治疗、组织和器官修复等方面呈现出巨大优势。近年来,通过干细胞移植重建损毁心肌显示良好的应用前景。研究表明,人受体活性修饰蛋白(hRAMP)1基因修饰间充质干细胞(MSC)可以有效改善梗死后心脏功能及促进损伤血管内皮修复〔3〕。本研究主要观察hRAMP1基因修饰的BMSCs在血管内皮细胞定向分化及其对心功能的保护作用。
1 材料和方法
1.1实验动物 新西兰大白兔购自遵义医学院科学实验动物中心。
1.2主要仪器试剂 增强型绿荧光蛋白报告基因(EGFP)、hRAMP1基因重组腺病毒载体,均由本课题组完成构建;胎牛血清(FBS)、L-DMEM培养基、胰蛋白酶购自美国Gibco公司;兔骨髓淋巴细胞分离液购自北京Mairybio,戊巴比妥钠为美国Sigma公司;血小板-内皮细胞黏附分子CD29、CD31、CD45、CD90多克隆抗体为英国Abcam公司;兔血管内皮生长因子(VEGF)和核因子(NF)-κB酶联免疫吸附(ELISA)检测试剂盒购自上海西唐生物科技公司;倒置荧光显微镜为日本Nikon Ti-S;流式细胞仪为BD FACSCalibur。
1.3实验方法
1.3.1BMSCs分离与培养 以3%戊巴比妥钠(30 mg/kg)对新西兰兔进行麻醉,无菌条件下抽取骨髓3~4 ml。用等体积磷酸盐缓冲液(PBS)混匀稀释,1 000 r/min离心5 min,弃上清及脂肪层,留细胞悬液。将其缓慢加到等体积兔淋巴细胞分离液中,2 000 r/min离心18 min,分离、收集单个核细胞(BMNCs)。将收集到的BMNCs重复洗涤2次,以DMEM培养基,37℃、5%CO2饱和湿度培养箱中进行原代培养。10 d左右,当细胞铺瓶底满80%~90%,用0.25%胰蛋白酶消化后制成细胞悬液,以一传二的形式进行传代。后续正式实验使用第3~4代细胞。
1.3.2BMSCs鉴定 应用BD流式细胞仪,以CD29-异硫氰酸荧光素(FITC)、CD45-藻红蛋白(PE)、CD90-PE荧光染料标记的抗体鉴定BMSCs。将1.0×106个培养BMSCs用PBS制成单细胞悬液,设置对照组、CD29-FITC+CD45-PE组和CD90-PE组;3组相应加入兔免疫球蛋白(Ig)G-FITC 10 μl、鼠抗兔CD29-FITC和CD45-PE抗体各10 μl、鼠抗兔CD90-PE抗体10 μl,后置于暗处避光反应30 min,1 200 r/min,离心5 min后收集细胞沉淀。使用无菌1×PBS重悬细胞,上机检测并分选、计数表面阳性标记细胞。
1.3.3腺病毒载体构建和转染 构建Ad-EGFP-hRAMP1和Ad-EGFP重组腺病毒载体,并通过RT-PCR、Western印迹及测序鉴定。取第3代BMSCs,以1×105个/ml接种6孔板,37℃、5%CO2培养箱中孵育,当瓶底细胞密度为70%~80%,更换无血清培养基,参考预实验转染条件,病毒Ad-EGFP-hRAMP1按照复感染指数(MOI=800)转染BMSCs。转染后培养6 h,吸弃培养液,PBS洗孔板一次,加入含10%FBS培养基3 ml/孔,继续于37℃、5%CO2培养箱中孵育。实验设计24 h、48 h及72 h 3个时间节点,在荧光倒置显微镜下对转染情况进行观察,计数200个细胞中绿色荧光染色细胞数,观察并估计转染效率。将转染细胞消化离心,经1×PBS冲洗两遍后制备密度为1×105个/ml细胞悬液,应用流式细胞仪检测培养BMSCs的转染率。
1.3.4心肌梗死再灌注模型建立 实验新西兰兔按照1 ml/kg量经由耳缘静脉注射3%戊巴比妥钠进行麻醉,于胸骨左缘第2~4肋间断肋,游离肋间组织。暴露心包膜、充分暴露心脏,于左心耳下方5~10 mm处用6.0号丙烯线予贯穿持续结扎左室支90 min,心脏再灌注恢复后关闭胸腔。观察模型建立情况。
1.3.5转染BMSCs和细胞移植 移植前3 d,按照复感染指数(MOI=800)加入Ad-EGFP-hRAMP1和Ad-EGFP重组腺病毒,转染BMSCs。转染3 d后消化BMSCs细胞,制备细胞悬液密度为1.0×108个/ml,行耳缘静脉移植,实验设置Ad-EGFP-hRAMP1-BMSCs(hRAMP1-BMSCs组)、Ad-EGFP-BMSCs(BMSCs组)和对照组,每组各6只。
1.3.6ELISA检测VEGF和NF-κB 用兔耳缘静脉血2 ml,室温3 000 r/min离心10 min分离血清,按照试剂盒操作说明测定血清VEGF和NF-κB含量。酶标仪读取450 nm处样品吸光度值(OD),根据标准曲线计算相应VEGF和NF-κB含量。
1.3.7超声心动图的检测 BMSCs移植后28 d,心脏超声检测3个连续的心动周期内左心室舒张末径(LVDd)、左心室收缩末径(LVSd)、短轴缩短率(LVFS)及左心室射血分数(LVEF),取平均值。
1.4统计学方法 应用SPSS16.0软件进行单因素方差分析。
2 结 果
2.1骨髓BMSCs的分离培养、鉴定及细胞转染 骨髓细胞分离24 h后开始贴壁,由开始多角形或长梭形逐渐变成稳定长梭形,导致显微镜下视野呈现成纤维细胞外观。EGFP标记的重组腺病毒载体成功转染细胞后,在倒置荧光显微镜视野下可见绿色荧光。Ad-EGFP-hRAMP1和Ad-EGFP在转染BMSCs 72 h后,有大约80%细胞可观察到绿色荧光。见图1。

图1 BMSCs原代培养及细胞转染
流式细胞术检测间充质干细胞表面标记CD29、CD45和CD90,结果显示,有95.79% 呈现出CD29阳性表达,12.49% 有CD45阳性表达,而有98.58%出现CD90阳性表达。
2.2建立新西兰兔心肌梗死模型评价 实验新西兰兔心脏左室支结扎前,正常心肌颜色红润,左室支而结扎90 min后心肌逐渐变为苍白色。心电图测定显示,结扎后与结扎前相比ST段弓背向上抬高,提示已成功建立心肌缺血再灌注模型。兔心肌梗死模型建立28 d,制备心肌组织切片并进行苏木素-伊红(HE)染色,可见正常的新西兰兔心肌纤维排列整齐有序,中央为心肌纤维细胞核;梗死的新西兰兔的心肌纤维排列紊乱,细胞核多数出现溶解,并见少量中性粒细胞浸润,同时多数梗死区胶原纤维演变为瘢痕组织。见图2。

图2 新西兰兔心肌梗死模型评价
2.3移植BMSCs向损伤血管归巢并分化为血管内皮细胞 以心肌缺血再灌注实验动物模型手术损伤侧血管和未损伤侧血管作比较,发现BMSCs移植后损伤侧血管腔面可观察到绿色荧光标记,而对侧未损伤血管则无绿色荧光出现。经过TRITC标记的CD31表达处会呈现出红色荧光。与冰冻切片同一视野比较发现,对照组增生内膜中无CD31和EGFP的表达;血管增生内膜有CD31和EGFP表达,结果提示,重组腺病毒载体成功转染至BMSCs内,结合到损伤部位后定向分化促进血管内皮的生成。见图3。
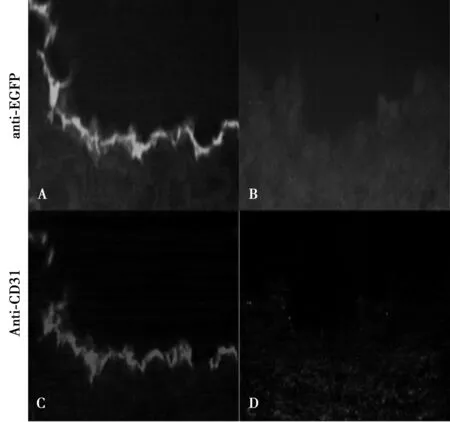
A、C:hRAMP1-BMSCs组,B、D:对照组图3 细胞移植28 d BMSCs归巢至损伤的血管并分化为血管内皮细胞(×400)
2.4VEGF和NF-κB血清学检测 心肌梗死后28 d,与对照组比较,BMSCs组及hRAMP1-BMSCs组VEGF表达均显著增高(P<0.01),NF-κB水平显著下降(P<0.01);与BMSCs组比较,hRAMP1-BMSCs组VEGF表达显著增高,NF-κB水平显著下降(均P<0.01)。见表1。
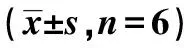
表1 各组VEGF和NF-κB表达水平及心脏超声检测结果比较
与对照组比较:1)P<0.01;与BMSCs组比较:2)P<0.01
2.5各组心脏超声检测结果比较 与对照组比较BMSCs组LVDd、LVDs均降低,LVFS、LVEF均增加,但差异无统计学意义(均P>0.05);hRAMP1-BMSCs组LVDd和LVDs均显著降低(P<0.01),LVFS和LVEF均显著增加(P<0.01)。
3 讨 论
AMI是冠状动脉闭塞至心肌急性、持续性缺血缺氧及坏死,常伴有血清心肌酶活性增强并伴有进行性心电图动态变化,甚至可并发心律失常,引起休克或心力衰竭。尽管经皮冠状动脉介入治疗(PCI)能显著改善AMI患者的预后,然而PCI术后患者出现的血管再狭窄,仍是目前面临的瓶颈,而促进损伤血管快速再内皮化,防止血管再狭窄是改善AMI心功能的重要策略及环节。本课题组前期研究表明,单纯BMSCs移植一定程度上能够通过自身的分化为内皮细胞或通过旁分泌机制促进损伤动脉的内皮修复,降低血管再狭窄风险,但效果并不十分理想〔4〕。降钙素基因相关肽(CGRP)是生物学方法发现的第一种活性多肽,由37 个氨基酸组成,与其受体结合后,可通过升高腺苷酸环化酶(cAMP),发挥内源性扩血管活性〔5,6〕。CGRP受体包含受体活性修饰蛋白(RAMP)-1和降钙素受体样受体(CRLR)亚单位。研究显示,CGRP在心血管系统具有扩血管、抑制血管平滑肌细胞增殖、参与血管损伤内皮修复等活性〔7,8〕,而RAMP-1则是CGRP执行生物学功能的关键。研究表明,CGRP与其受体结合后可抑制梗死区域局部NF-κB介导趋化性因子的产生〔9〕,其机制可能为通过BMSCs分化为血管内皮细胞并参与血管生成。本研究结果表明,BMSCs移植可促进血管内皮细胞分化并参与兔心肌梗死模型损伤血管生成,有利于缺血组织再血管化。本研究结果提示,hRAMP1基因修饰的BMSCs移植后可以更好地减轻AMI后由于心室重构导致的心功能降低,加强对延缓或阻止左室重构的发展及对心功能的保护作用。基于上述本研究结果,推测其机制可能为,hRAMP1修饰可能增强CGRP活性或调节旁分泌效应分泌促血管生成因子〔10~12〕,如一氧化氮(NO)、VEGF、NF-κB等,有利于心肌梗死区血管内皮细胞的生成及损伤血管内皮的修复,调节BMSCs移植后梗死区域局部微环境,改善心功能保护心脏。综上,本研究显示,hRAMP1修饰的BMSCs移植后可诱导BMSCs向损伤血管归巢,并可定向分化为血管内皮细胞,且对延缓或阻止左室重构及心功能保护具有积极作用。
4 参考文献
1高晓津,杨进刚,杨跃进,等.中国急性心肌梗死患者心血管危险因素分析〔J〕.中国循环杂志,2015;30(3):206-10.
2张 凯,王 毅,邢国胜.间充质干细胞的生物学特性及多向分化潜能〔J〕.中国组织工程研究与临床康复,2008;12(3):539-42.
3龙仙萍,赵然尊,石 蓓,等.hRAMP1修饰的骨髓间充质干细胞移植对兔球囊损伤血管再狭窄及心功能的影响〔J〕.中华医学杂志,2012;92(30):2134-9.
4刘志江,石 蓓,许官学,等.骨髓间充质干细胞移植对兔颈动脉球囊损伤后再狭窄的影响〔J〕.中国动脉硬化杂志,2013;21(1):22-7.
5Holmes D,Campbell M,Harbinson M,etal.Protective effects of intermedin on cardiovascular,pulmonary and renal diseases:comparison with adrenomedullin and CGRP〔J〕.Curr Protein Pept Sci,2013;14(4):294-329.
6Kaiser EA,Kuburas A,Recober A,etal.Modulation of CGRP-induced light aversion in wild-type mice by a 5-HT(1B/D)agonist〔J〕.J Neurosci,2012;32(44):15439-49.
7Bullen ML,Miller AA,Andrews KL,etal.Nitroxyl(HNO)as a vasoprotective signaling molecule〔J〕.Antioxid Redox Signal,2011;14(9):1675-86.
8Kezeli T,Rukhadze T,Gongadze N,etal.Effect of calcitonin gene-related peptide antagonist on the cardiovascular events,mortality,and prostaglandin E2 production by nitrate-induced tolerant rats with acute myocardial infarction〔J〕.EPMA J,2016;7(1):6.
9Shi B,Long X,Zhao R,etal.Transplantation of mesenchymal stem cells carrying the human receptor activity-modifying protein 1 gene improves cardiac function and inhibits neointimal proliferation in the carotid angioplasty and myocardial infarction rabbit model〔J〕.Exp Biol Med(Maywood),2014;239(3):356-65.
10Zhao YB,Wang YZ,Yue YH,etal.Variation of plasma levels of endothelin,calcitonin gene-related peptide,nitric oxide,and malondialdehyde in acute myocardial ischemia reperfusion injury in a rabbit model〔J〕.Genet Mol Res,2015;14(2):5577-84.
11Guo ZJ,Guo Z.Non-excitatory electrical stimulation attenuates myocardial infarction via homeostasis of calcitonin gene-related peptide in myocardium〔J〕.Peptides,2015;65:46-52.
12Gao Y,Song J,Chen H,etal.TRPV1 activation is involved in the cardioprotection of remote limb ischemic postconditioning in ischemia-reperfusion injury rats〔J〕.Biochem Biophys Res Commun,2015;463(4):1034-9.

