老年胃间质瘤组织中DOG1表达及对预后的影响
魏 娜
(中航工业三六三医院消化内科,四川 成都 610000)
胃间质瘤(GST)是一种起源于胃间叶组织的肿瘤,是消化系统较为常见的肿瘤之一〔1〕。该肿瘤具有一定的恶性度,根据其恶性程度划分有极低,低,中,高度危险性等,对于肿瘤直径大于4 cm,核分裂象>5/50 HPF考虑恶性可能较大。该病的发病机制尚不明确,可能与c-kit基因或血小板源生长因子(PDGF)的基因突变有关〔2〕。可于各年龄段起病,但以中老年人群最为常见,其中40岁以后发病率较高。该病早期临床症状不明显,等肿瘤增长到一定程度常表现为上腹部不适,消化道出血等症状〔3〕。GST的诊断缺乏特异性的标准,临床上以免疫组化标记CD117为确诊间质瘤的重要参考〔4〕。此外需要结合肿瘤的形态学改变,例如肿瘤呈现梭形、核分裂象增多等〔5,6〕。但对于镜下形态学不典型的肿瘤常不能完全确定其来源及性质,因此,临床上急需扩充间质瘤的诊断指标,特别是能用于判断患者预后的指标。GST中发现的蛋白(DOG)1由960个氨基酸组成,可能是一种通过钙离子激活的氯离子通道蛋白,近年发现,DOG1蛋白与GST发生、发展密切相关的指标〔7〕。本研究分析DOG1在瘤体内的表达及对老年GST患者预后的判断价值。
1 资料与方法
1.1一般资料 2013年1月至2016年12月在中航工业三六三医院接受外科手术治疗的老年GST患者86例,纳入标准:年龄≥60岁,经临床、影像学及病理学检测明确诊断为GST(高危),患者及家属术前均告知相关情况,并自愿签署知情同意书。排除标准:①合并其他组织起源的恶性肿瘤;②严重的肝肾功能障碍;③合并自身免疫性疾病;④活动性感染;⑤临床资料缺失。其中男35例,女51例,平均年龄(66.1±4.2)岁,平均病程(7.3±2.6)个月。以相对DOG1水平中位数(7.26)为界,将患者分为DOG1高水平组(DOG1≥7.26,n=43)及DOG1低水平组(DOG1<7.26,n=43)。
1.2标准及检测 GST的诊断标准参照中国胃肠间质瘤诊断治疗共识(2013年版)〔8〕。患者均接受同一组医师所施行的手术治疗,术前准备及术后处理均由同一组医师评估和指导,术后留取肿瘤组织及瘤旁正常组织。手术标本一部分采用甲醛溶液固定,制作石蜡切片采用免疫组化标记CD117及DOG1。一部分手术标本采集后充分研磨,提取蛋白后采用Western印迹半定量检测CD117及DOG1的水平。比较间质瘤中不同水平DOG1患者术后1年累积复发率。
1.3统计学方法 采用SPSS21.0统计软件进行t检验,复发率应用Kaplan-Meier曲线计算,采用Log-rank检验。
2 结 果
2.1DOG1及CD117在GST中的表达 免疫组化染色证实间质瘤中表达CD117及DOG1。Western印迹检测表明,间质瘤组织中CD117(6.7±1.30)与DOG1表达水平(7.2±1.50)显著高于瘤旁正常组织(1.0±0.27,1.0±0.30)(P<0.05)。见图1和图2。

图1 GST组织DOG1和CD117表达(×200,免疫组化)
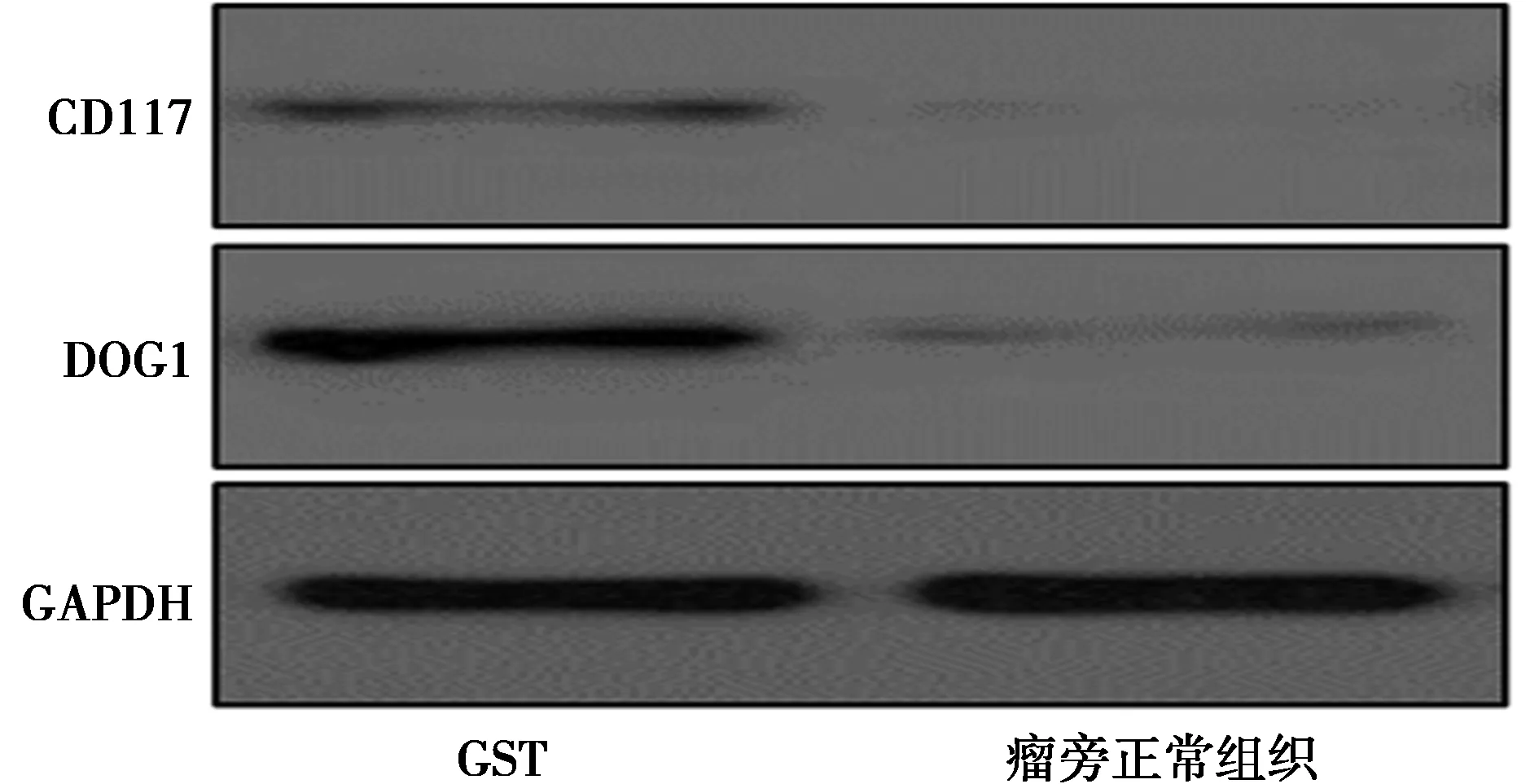
图2 DOG1及CD117在GST中的表达Western印迹检测
2.2GST中DOG1表达与CD117表达相关性 DOG1表达与CD117表达呈正相关(P<0.01)。见图3。
2.3GST中不同水平DOG1患者术后1年累积复发率的比较 DOG1高水平组术后1年累积复发率(25.58%)显著高于DOG1低水平组(9.30%)(P=0.042),见图4。

图3 GST中DOG1表达与CD117表达相关性
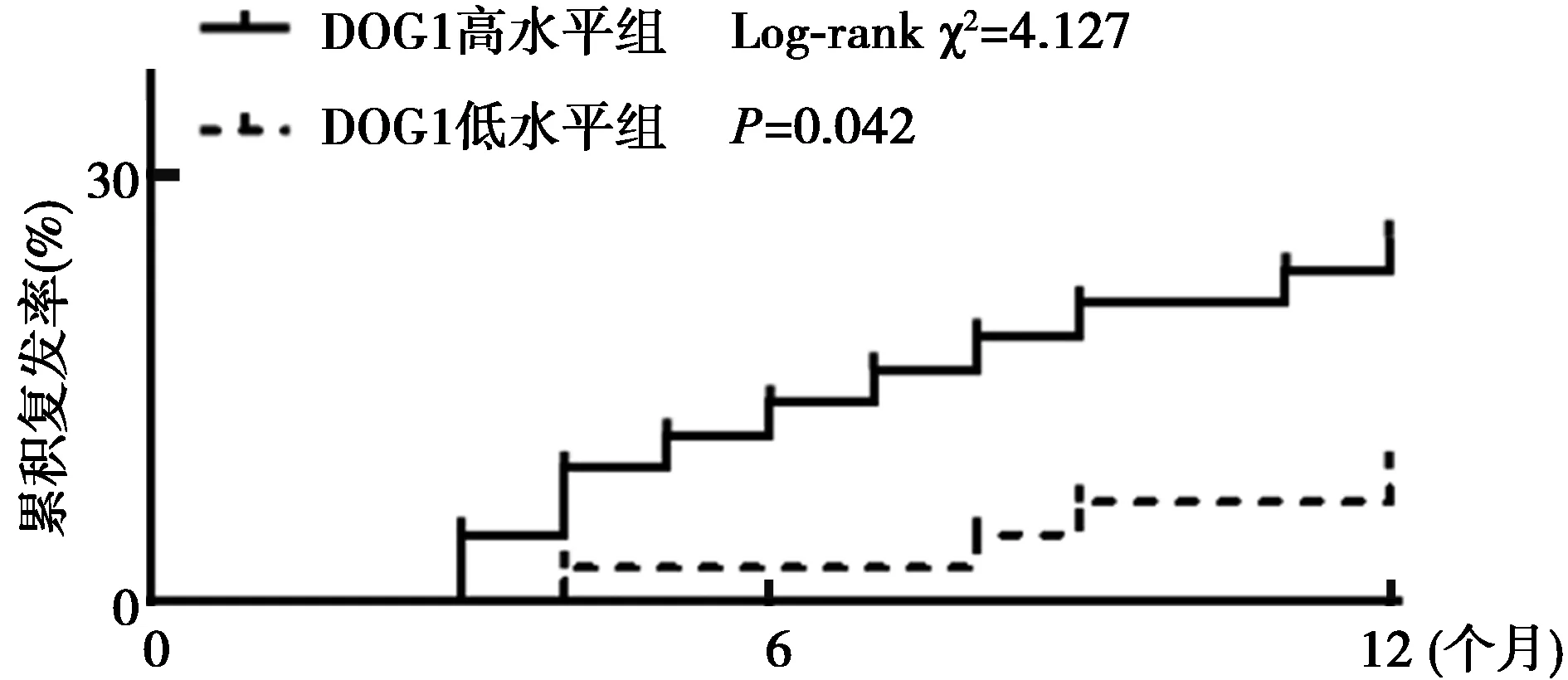
图4 GST中不同水平DOG1患者术后1年累积复发率的比较
3 讨 论
胃肠道间质瘤是一种起源于胃肠道间叶组织肿瘤,其发病率在消化道系统肿瘤中约占2%,可发生消化道的任何部位,其中胃的发病率最高。男女发病相当,常见于50岁以上的中老年人,年轻患者也可发病,儿童较为罕见。李军川等〔9〕研究认为,间质瘤的危险因素和肿瘤发生部位、年龄和性别等无明显关系。间质瘤主要起源于胃肠道平滑肌,较少来源于血管和神经等组织,但却与神经功能密切相关,是一种性质不明的肿瘤。消化道间质细胞起源于中胚层,分化程度较低,具有多种分化潜能,可分化为成纤维细胞、脂肪细胞、血管内皮细胞和滑膜细胞等。由于早期无明显特异性症状,随着肿瘤生长,可表现为胃肠道系统多种症状,如腹部包块、出血、梗阻等,可出现血液转移和局部侵犯,临床容易漏诊和误诊〔10〕。部分间质瘤为恶性或可发展为恶性间质瘤。胃肠间质瘤在腹部CT和磁共振成像(MRI)表现无特异性,早期病变在内镜下主要变现为隆起型病变,对于怀疑为间质瘤患者常需结合超声内镜,操作较复杂。需和平滑肌瘤、神经鞘瘤、炎性肌纤维母细胞瘤和恶性间皮瘤等多种疾病相鉴别。胃肠间质瘤是起源于平滑肌细胞和神经组织的肿瘤,且按照其大小、镜下细胞的形态学改变,是否合并出血、坏死等鉴定其良恶性。吴红梅等〔11〕从临床病理学研究发现,肿瘤直径,手术是否残留,核分裂数及细胞形态和异形性显著影响患者预后。但近年来研究认为,其判定为良性的间质瘤也可发生转移,因此对于根据病理学镜下特点鉴别良恶性具有一定的局限性〔12〕。目前该病的确诊方法主要依靠病理学检测,特别是CD117的免疫组化检测。因间质瘤具有一定的致死率,特别是分级为高危的间质瘤,具有高复发率和低生存期。单纯依据CD117的表达来诊断间质瘤具有一定局限性,且少数间质瘤可呈现CD117阴性的情况〔12〕。DOG1是新近发现的与间质瘤发生发展密切相关的指标。DOG1定位于人类11q13上细胞周期蛋白(CCN)D1基因座,含有26个外显子,是一种8次穿膜蛋白〔12〕。研究发现DOG1分布在各种内分泌上皮细胞、视网膜和感觉神经元细胞等,肝内外胆管上皮细胞和睾丸间质细胞及胃肠间质瘤等多处〔13〕。多项研究均显示DOG1在人类胃肠道间质瘤中的表达阳性率超过90%〔10,14〕。
CD117是c-kit基因的表达产物,是多次跨膜的酪氨酸激酶受体,高度表达以胃间质瘤细胞膜和细胞质中,目前诊断胃间质瘤的主要手段采用形态学镜下观察和免疫组化,其中免疫组化重要的依据就是检测CD117的表达〔15〕。既往认为,CD117阳性是诊断间质瘤的“金标准”,近年来发现,胃间质瘤中约95%患者表达CD117,通过大体标本情况和镜下细胞形态并结合免疫组化检测CD117可准确诊断胃间质瘤,但部分患者由于c-kit基因的缺失或变异,导致CD117表达阴性,尚需要其他指标来诊断〔16,17〕。临床中对于CD117阴性患者及部分形态不典型的患者常需选取CD34蛋白辅助诊断,由于CD34在总体胃肠道间质瘤(GIST)中的阳性率约70%,且在原始造血干细胞、内皮细胞和肌成纤维细胞中均有表达,临床特异性不高。近年来研究发现,DOG1在胃肠道间质瘤中高度表达不受c-kit基因等的表达影响,DOG1是Cajal间质细胞中钙离子调节的氯通道蛋白,对于间质瘤具有高度特异性。研究表明在CD117阴性情况下,多数患者标本DOG1仍高度表达,因此对于临床特征不明显、免疫组化诊断不明时患者行DOG1检测,对于准确诊断为间质瘤具有重要意义〔18~20〕。
本研究提示DOG1与CD117类似,对间质瘤的诊断具有一定价值,这与许春伟等〔21〕研究结果一致。本文结果和李宝江等〔22〕的研究结果一致,李宝江等〔22〕认为,DOG1的表达与患者年龄、性别、肿瘤的起源部位、肿瘤的细胞起源、有无侵袭性等因素均无显著相关。提示DOG1与CD1117在胃间质瘤中均高度表达,且DOG1也具有和CD117程度相当的诊断准确性,亦有可能两种蛋白在间质瘤的发生过程中存在内在共同的联系,但具体机制尚需进一步研究以明确。间质瘤是一种具有潜在恶性行为的交界性肿瘤。虽然行边缘阴性的手术切除术有望使患者获得根治,但术后仍然有一部分患者存在复发倾向〔6,23〕。本文提示DOG1在瘤体内水平对患者术后复发具有一定辅助判断价值,为临床中预后的判断提供量化标准。本研究由于样本量有限所得结果可能存在一定的偏倚,尚需更多样本量和多中心性研究加以验证;此外,本研究虽然发现DOG1在间质瘤中的水平改变对胃间质瘤的临床预后有一定的影响,但DOG1在间质瘤发生发展中的具体作用和对复发等的影响,尚需进一步实验加以论证。
4 参考文献
1Banerjee JK,Saranga BR,Singh P,etal.Laparoscopy-assisted resection of CD117 and CD34 negative gastrointestinal tumor of stomach following tyrosine kinase inhibitor therapy〔J〕.Med J Armed Forces India,2016;72(Suppl 1):S205-9.
2赵文娣,祁义军,王岳君,等.胃肠道间质瘤临床病理及免疫组化表达的分析〔J〕.安徽医科大学学报,2012;47(4):454-7.
3陈 平.十二指肠间质瘤的临床病理学特点和外科治疗进展〔J〕.中国肿瘤临床,2017;44(4):186-90.
4马庆锋.胃肠道间质瘤免疫组织化学特征〔J〕.中国老年学杂志,2012;32(22):4887-90.
5Yamamoto H,Handa M,Tobo T,etal.Clinicopathological features of primary leiomyosarcoma of the gastrointestinal tract following recognition of gastrointestinal stromal tumours〔J〕.Histopathology,2013;63(2):194-207.
6Yamauchi K,Iwamuro M,Ishii E,etal.Gastroduodenal intussusception with a gastric gastrointestinal stromal tumor treated by endoscopic submucosal dissection〔J〕.Intern Med,2017;56(12):1515-9.
7Wada T,Tanabe S,Ishido K,etal.DOG1 is useful for diagnosis of KIT-negative gastrointestinal stromal tumor of stomach〔J〕.World J Gastroenterol,2013;19(47):9133-6.
8中国CSCO胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗共识(2013年版)〔J〕.中华胃肠外科杂志,2014;17(4):393-8.
9李军川,竺红宇,陈廷煊,等.胃肠道间质瘤危险性分级与临床病理因素关系探讨〔J〕.临床和实验医学杂志,2013;12(1):7-10.
10Baskin Y,Kocal GC,Kucukzeybek BB,etal.PDGFRA and KIT Mutation status and its association with clinicopathological properties,including DOG1〔J〕.Oncol Res,2016;24(1):41-53.
11吴红梅,马 蓉,王欣栋.消化道间质瘤的临床病理特征及其与预后的相关性〔J〕.海南医学,2017;28(4):578-80.
12Seo HS,Hyeon JY,Shin OR,etal.C-kit-negative gastrointestinal stromal tumor in the stomach〔J〕.J Gastric Cancer,2015;15(4):290-4.
13甄丽影,李 岩,徐 灿.DOG1蛋白在胃肠道间质瘤中的表达及相关性分析〔J〕.中华消化杂志,2010;30(9):585-7.
14Sui XL,Wang H,Sun XW.Expression of DOG1,CD117 and PDGFRA in gastrointestinal stromal tumors and correlations with clinicopathology〔J〕.Asian Pac J Cancer Prev,2012;13(4):1389-93.
15赵润珍,田 林,陈永宏,等.CD34、CD117、平滑肌肌动蛋白、S-100蛋白在胃肠道间质瘤中的表达及意义〔J〕.中国基层医药,2015;22(10):1499-502.
16李 鹏,黄 振,赵 宏,等.外科治疗胃间质瘤的预后分析〔J〕.中国医刊,2015;50(11):36-40.
17杨 昆,薛 奇,程贵余,等.食管间质瘤的临床分析及外科治疗〔J〕.中华医学杂志,2012;92(41):2924-6.
18陈 东,刘庆猛,谭卫峰.CD117和DOG-1在胃肠道间质瘤中的表达及意义〔J〕.实用肿瘤杂志,2015;30(3):262-4.
19蔡 旭,毕 蕊,王 坚,等.胃肠道间质瘤CD117、DOG1免疫组织化学室间质评结果分析〔J〕.中华病理学杂志,2016;45(3):221-2.
20田 野,高 静,李 健,等.180例野生型胃肠间质瘤患者的临床病理特征分析〔J〕.中华胃肠外科杂志,2015;18(4):342-5.
21许春伟,韩鸿雁,王晶晶,等.CD117、PDGFRA蛋白单独及联合DOG1检测在胃肠道间质瘤中的诊断价值〔J〕.临床与病理杂志,2015;35(2):252-7.
22李宝江,姜忠敏,张立东,等.DOG1蛋白在胃肠道间质瘤中的表达意义及其与CD117表达的关系〔J〕.广东医学,2011;32(18):2434-6.
23Hu ML,Wu KL,Changchien CS,etal.Endosonographic surveillance of 1-3 cm gastric submucosal tumors originating from muscularis propria〔J〕.World J Gastroenterol,2017;23(12):2194-200.

