Twist对膀胱癌细胞迁移、侵袭及MMP-2、MMP-9表达的影响
王 刚 杨 涛 彭克楠 郭留雄 孙福振 谷守义 刘俊江
(河北省人民医院泌尿外科,河北 石家庄 050051)
膀胱癌具有发病率高、致死率强等特点,且易转移、易复发〔1,2〕。如何减少肿瘤细胞迁移和侵袭是目前延长肿瘤患者生存期的重要途径〔3〕。Twist是一种高度保守的转录因子,其表达上调是诱导肿瘤细胞发生上皮间质转化(EMT)的重要原因,也是肿瘤细胞迁移和侵袭的重要诱导因子〔4〕。Twist在肺癌、口腔癌等肿瘤中高表达,研究显示,Twist表达下调后可以降低胃癌、结肠癌等癌细胞的侵袭能力〔5~8〕。本研究旨在探讨Twist对膀胱癌细胞侵袭和迁移的影响。
1 材料与方法
1.1材料 膀胱癌5637、T24、BIU-87细胞和正常膀胱SVHUC-1细胞购自中科院细胞库,5637、T24、BIU-87细胞培养于10%胎牛血清的RPMI1640中,SVHUC-1细胞培养于含有10%胎牛血清的Ham′F12K中,细胞均放在37℃,5% CO2培养箱培养。Prime Script RT逆转录试剂盒、SYBR Premis Ex Taq PCR试剂盒购自大连Takara;RNA提取试剂盒购自北京BioTeke;辣根过氧化物酶(HRP)标记的二抗购自美国ImmunoReagents Inc;波形蛋白(Vimentin)一抗、基质金属蛋白酶(MMP)-9一抗购自美国santacruze;上皮钙黏附素(E-cadherin)一抗、MMP-2一抗购自美国Abcam;Lipofectamine2000购自美国Thermo。
1.2qRT-PCR测定Twist表达 收集膀胱癌5637、T24、BIU-87细胞和正常膀胱SVHUC-1细胞,用RNA试剂盒提取细胞总RNA,同时检测各细胞RNA样品A260/A280的比值(1.8~2.0)。用Prime Script RT反转录合成cDNA后,用SYBR Premis Ex Taq进行qRT-PCR,GAPDH为内参,分析Twist mRNA表达。引物:GAPDH上游5′-AATGGGCAGCCGTTAGGAAA-3′,下游5′-TGAAGGGGTCATTGATGGCA-3′。Twist上游5′-GGAGTCCGCAGTCTTACGAG-3′,下游5′-TCTGGAGGACCTGGTAGAGG-3′。引物均由上海英俊生物公司合成。
1.3Western印迹测定Twist表达 收集膀胱癌5637、T24、BIU-87细胞和正常膀胱SVHUC-1细胞,分别用磷酸盐缓冲液(PBS)洗涤细胞2次,添加裂解液,在冰上孵育20 min,期间震荡3次。将细胞转移到离心管中,4℃离心10 min。吸取上清,保存于-80℃。用二喹啉甲酸(BCA)法测定浓度。取蛋白样品,加入到等体积的十二烷基硫酸钠-聚丙烯酰胺凝脉电泳(SDS-PAGE)上样缓冲液中,在沸水中煮5 min。变性后的蛋白保存在-80℃。变性蛋白样品按照每个泳道40 μg添加,先用80 V电泳大约0.5 h以后,此时溴酚蓝达到分离胶,再把电压调大至120 V,2 h后,取出凝胶,在4℃,200 mA进行电转。用5%脱脂奶粉封闭1.5 h以后,再与1∶600稀释的Twist一抗在保鲜膜密封的蜡板上4℃过夜。再与1∶2 000稀释HRP标记的二抗放在室温下孵育2 h。电化学发光(ECL),用Image J对各条带进行灰度分析,以GAPDH为内参,计算Twist灰度值÷GAPDH灰度值,比值作为Twist蛋白水平。
1.4细胞分组及转染 T24细胞分为3组,T24细胞用Lipofectamine2000转染shRNA Twist后记为sh-Twist组,转染shRNA control后记为sh-NC组,以不做任何处理的T24细胞记为Con组。细胞转染步骤参照脂质体转染试剂说明书,shRNA Twist、shRNA control由上海吉玛合成。各组细胞在转染后分别培养24 h,参照上述qRT-PCR和Western印迹法分别测定各组细胞中的Twist mRNA和蛋白水平。
1.5Transwell小室测定各组细胞迁移和侵袭能力 细胞侵袭和迁移能力测定均用Transwell小室进行检测,侵袭实验前用基质胶将Transwell湿化(用不含血清的培养液将基质胶以1∶3稀释,在小室中添加40 μl,放在37℃孵育2 h),迁移实验不用基质胶湿化,其他步骤相同,简述如下:Transwell小室放在24孔的培养板中,在实验开始前分别用不含血清的细胞培养液将各组膀胱癌细胞调整为每毫升含有106个细胞,每组添加100 μl的细胞悬浮液于小室的上室中,同时在下室内加入600 μl的常规培养液。24 h后,将各组小室取出以后,用4%的多聚甲醛固定,结晶紫染10 min。用PBS洗涤以后,在显微镜下分别选取5个视野计数穿膜的细胞数目。
1.6Western印迹测定Vimentin、E-cadherin、MMP-2、MMP-9蛋白表达 各组细胞按照1.5中方法处理培养24 h以后,提取各组细胞中的总蛋白,用Western印迹方法测定细胞中Vimentin、E-cadherin、MMP-2、MMP-9蛋白水平。抗体稀释分别为:Vimentin(1∶600)、E-cadherin(1∶600)、MMP-2(1∶800)、MMP-9(1∶800)。
1.7统计学分析 采用SPSS21.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1Twist在各细胞中表达比较 膀胱癌5637、T24、BIU-87细胞中Twist mRNA和Twist 蛋白水平均明显高于正常膀胱细胞SVHUC-1(P<0.05),并且T24细胞中Twist mRNA和Twist 蛋白水平明显高于5637、BIU-87细胞(P<0.05)。见图1和表1。Twist在膀胱癌细胞中过度表达,后续选用表达水平最高的T24做后续试验。
2.2shRNA Twist下调膀胱癌细胞中Twist的表达 sh-Twist组Twist mRNA和蛋白水平均明显低于Con组(P<0.05),sh-NC组Twist mRNA和蛋白水平与Con组相比差异无统计学意义(P>0.05)。见图2和表2。shRNA Twist下调膀胱癌细胞中Twist的表达和转录。
2.3各组细胞侵袭和迁移能力比较 sh-Twist组迁移细胞数目、侵袭细胞数目和MMP-2、MMP-9蛋白水平均明显低于Con组(P<0.05),sh-NC组迁移细胞数目、侵袭细胞数目和MMP-2、MMP-9蛋白水平与sh-Twist组相比差异无统计学意义(P>0.05)。见图3和表2。shRNA Twist能够降低膀胱癌细胞的侵袭和迁移能力,减少基质金属蛋白酶MMP-2、MMP-9的表达。

表1 Twist在膀胱癌5637、T24、BIU-87细胞和正常膀胱SVHUC-1细胞中的表达水平
与SVHUC-1相比:1)P<0.05;与T24相比:2)P<0.05

图1 Western印迹测定Twist在膀胱癌5637、T24、BIU-87细胞和正常膀胱SVHUC-1细胞中的表达

图2 Western印迹测定转染后的各组细胞中Twist蛋白表达

表2 各组Twist mRNA及蛋白、迁移细胞数目、侵袭细胞数目及MMP-2、MMP-9、Vimentin、E-cadherin蛋白水平比较
与Con相比:1)P<0.05

图3 Western印迹测定各组细胞中MMP-2、MMP-9蛋白表达
2.4各组Vimentin及E-cadherin表达比较 sh-Twist组Vimentin蛋白水平明显低于Con组,E-cadherin水平明显高于Con组(P<0.05),sh-NK组Vimentin、E-cadherin蛋白水平与Con组相比差异无统计学意义(P>0.05)。见图4和表2。shRNA Twist能够抑制膀胱癌细胞EMT。
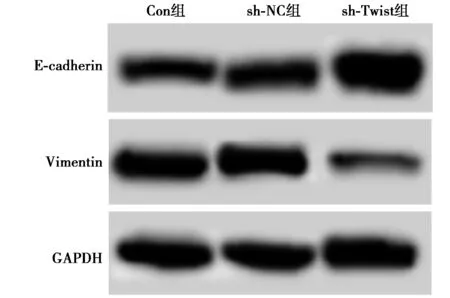
图4 Western印迹测定各组细胞中Vimentin、E-cadherin蛋白表达
3 讨 论
Twist是一种最早发现于果蝇中的转录因子,其编码的蛋白质能够与DNA结合,含有1个内含子和2个外显子,Twist与肿瘤有关,参与肿瘤细胞EMT,能够促使肿瘤细胞形成新的转移灶〔9〕。研究证实,Twist可以诱导黑素细胞转化为黑色素瘤,并且与前列腺癌患者的预后有关,鼻咽癌中发现Twist在肿瘤侵袭中具有重要作用〔10~12〕。研究表明,Twist在膀胱癌中表达上调,并且与膀胱癌细胞的生长、凋亡等有关,其表达下调后可以发挥抗肿瘤作用〔13,14〕。本实验结果说明Twist在膀胱癌细胞中表达异常升高,这与上述实验报道〔9~14〕相一致。
肿瘤转移需要突破组织屏障,避免被免疫细胞清除,最终达到新的组织或者器官形成新的病灶,肿瘤转移的分子机制较为复杂,细胞黏附能力、血管生成、细胞外基质降解等都与肿瘤转移有关〔15〕。Twist作为一种癌基因参与细胞的EMT过程,在细胞EMT发生时,细胞之间的黏附能力下调,E-cadherin表达水平降低,上皮细胞特性逐渐消失,细胞逐渐表现出间质细胞特性,细胞的这一系列变化能够促进细胞运动,诱导细胞迁移和侵袭〔16〕。E-cadherin能够抑制肿瘤的转移,其表达下调是肿瘤侵袭能力增加的重要标志,Vimentin是间质细胞标志蛋白,其在肿瘤中表达上调〔17〕。研究显示,Twist表达上调后可以促进膀胱癌细胞中Vimentin的表达,降低E-cadherin蛋白水平,诱导膀胱癌细胞发生EMT〔18〕。本实验结果表明,Twist敲低后的膀胱癌细胞中Vimentin水平降低,E-cadherin水平升高,细胞EMT水平下降,这与上述实验结果类似,说明Twist敲低可以阻碍膀胱癌细胞EMT。
肿瘤转移与肿瘤细胞突破组织屏障有关,肿瘤细胞可以分泌大量的蛋白酶,而这些蛋白酶可以降解细胞外基质,为肿瘤的转移提供有利条件〔19〕。MMPs几乎可以降解所有的细胞外基质,是肿瘤转移的重要蛋白酶,MMP-2、MMP-9是MMPs家族中目前研究的与肿瘤转移关系最为密切的两个成员,其可以降解细胞外基质中的Ⅳ型胶原酶促进肿瘤转移〔20〕。本实验结果提示Twist敲低可以通过下调MMP-2、MMP-9蛋白表达降低膀胱癌细胞的侵袭和迁移能力。
Twist是一种癌基因,参与肿瘤的转移,在膀胱癌细胞中高表达,下调其表达后可以抑制膀胱癌细胞EMT,降低膀胱癌细胞侵袭和迁移能力,减少细胞表达MMPs,其具体作用机制仍需进一步探讨。
4 参考文献
1王 一,韩 婧,邢庆菲.代谢综合征及其相关因素与膀胱癌关系的研究进展〔J〕.山东医药,2016;56(24):106-8.
2Soria F,Allasia M,Oderda M,etal.Hyperthermia for non-muscle invasive bladder cancer〔J〕.Expert Rev Anticancer Ther,2016;16(3):313-21.
3GatrRtz M,Galli U,Longerich T,etal.De novo synthesis of C4.4A in hepatocellular carcinoma promotes migration and invasion of tumor cells〔J〕.Oncol Rep,2017;38(5):2697-704.
4Cao C,Sun D,Liang Z,etal.miR-186 affects the proliferation,invasion and migration of human gastric cancer by inhibition of Twist1〔J〕.Oncotarget,2016;7(48):79956-63.
5Su J,Wu S,Wu H,etal.CD44 is functionally crucial for driving lung cancer stem cells metastasis through Wnt/β-catenin-FoxM1-Twist signaling〔J〕.Mol Carcinog,2016;55(12):1962.
6孙昊轩,冯红超,宋宇峰.Twist在口腔鳞状细胞癌中的表达及其与鳞状细胞癌上皮间质化的关系〔J〕.华西口腔医学杂志,2015;33(5):534-8.
7Wang T,Hou J,Li Z,etal.miR-15a-3p and miR-16-1-3p negatively regulate twist1 to repress gastric cancer cell invasion and metastasis〔J〕.Int J Biol Sci,2017;13(1):122-34.
8尹 伟.沉默Twist基因影响结肠癌细胞系HCT116侵袭转移的体内实验〔D〕.天津:天津医科大学,2014.
9Mudry JM,Massart J,Szekeres FL,etal.TWIST1 and TWIST2 regulate glycogen storage and inflammatory genes in skeletal muscle〔J〕.J Endocrinol,2015;224(3):303-13.
10Jinushi M,Nakazaki Y,Carrasco DR,etal.Milk fat globule EGF-8 promotes melanoma progression through coordinated Akt and twist signaling in the tumor microenvironment〔J〕.Cancer Res,2008;68(21):8889-98.
11熊正文,王庆丰,李 伟,等.Twist蛋白在前列腺癌组织中的表达及预后关系〔J〕.中国医师杂志,2012;14(2):170-2.
12Li CH,Wu DF,Ding H,etal.Berberine hydrochloride impact on physiological processes and modulation of twist levels in nasopharyngeal carcinoma CNE-1 cells〔J〕.Asian Pac J Cancer Prev,2014;15(4):1851-7.
13Fantony JJ,Longo TA,Gopalakrishna A,etal.Urinary NID2 and TWIST1 methylation to augment conventional urine cytology for the detection of bladder cancer〔J〕.Cancer Biomark,2017;18(4):1-7.
14Fondrevelle ME,Kantelip B,Reiter RE,etal.The expression of Twist has an impact on survival in human bladder cancer and is influenced by the smoking status〔J〕.Urol Oncol,2009;27(3):268-76.
15Kong D,Sethi S,Li Y,etal.Androgen receptor splice variants contribute to prostate cancer aggressiveness through induction of EMT and expression of stem cell marker genes〔J〕.Prostate,2015;75(2):161-74.
16Li J,Zhou BP.Activation of β-catenin and Akt pathways by Twist are critical for the maintenance of EMT associated cancer stem cell-like characters〔J〕.BMC Cancer,2011;11(1):1-11.
17Fendrich V,Waldmann J,Feldmann G,etal.Unique expression pattern of the EMT markers Snail,Twist and E-cadherin in benign and malignant parathyroid neoplasia〔J〕.Eur J Endocrinol,2009;160(4):695-703.
18王小林,曹广鑫,侯建全.Twist1基因对膀胱癌上皮间质转化的影响〔J〕.交通医学,2015;29(3):231-3.
19Jiming GU,Lulu WU,Chen J.Expression and significance of Twist,MMP-2 and MMP-9 in colorectal carcinomas〔J〕.Jiangsu Med J,2010;36(16):1895-6.
20Che YL,Luo SJ,Li G,etal.The C3G/Rap1 pathway promotes secretion of MMP-2 and MMP-9 and is involved in serous ovarian cancer metastasis〔J〕.Cancer Lett,2015;359(2):241-9.

