中性粒细胞/淋巴细胞比值与老年肺癌合并慢阻肺肺功能及术后并发症的相关分析
任帅 朱建平 纪林林 李久振 郭凡 孙大强
老年肺癌患者合并慢性阻塞性肺疾病(即慢阻肺,chronic obstructive pulmonary disease,COPD)较常见,此部分患者术后并发症发生率较高,并且气流受限越严重,术后并发症发生率越高[1]。因此术前准确评估慢阻肺患者的严重程度,给予合理的肺保护治疗,对术后减少肺部并发症意义重大[2]。慢性炎症是COPD的主要发病机制,外周血中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)可以反映全身炎性状态,研究证明NLR与 COPD 患者的疾病严重程度、病情变化、预后等相关[3~5]。而目前鲜有针对NLR与老年肺癌合并COPD这一特殊群体的临床特征的相关性研究。本研究采用回顾性对照研究,探讨老年肺癌合并慢性阻塞性肺疾病患者外周血NLR与肺功能指标及术后并发症的关系。
1 材料与方法
1.1 一般情况 收集2014年1月~2017年12月天津市胸科医院胸外科因肺癌手术治疗的患者的临床资料。纳入标准:①入院年龄≥65岁;②行单肺叶切除+系统淋巴结清扫术;③术后病理明确诊断为非小细胞肺癌;④合并慢性阻塞性肺疾病。排除标准:①行楔形切除、局部切除、肺段切除、袖式切除、双肺叶或全肺切除、未标准淋巴结清扫者;②术前接受辅助性放化疗者;③入院前1月内使用抗生素,入院2周内未行手术者;④肺功能检查、血常规检查由外院完成者;⑤白细胞计数<4×109/L或>10×109/L者;⑥临床资料不全者。最终入组89例患者,平均年龄(70.1±3.8)岁,男58例,女31例。
1.2 方法 分析患者入院时血常规指标,计算中性粒细胞与淋巴细胞的比值。手术均由副主任以上职称医师完成。首先依据NLR均值分为高NLR组和低NLR组,比较两组一般情况及肺功能指标(FEV1%Pre、DLco%Pre、FCV%Pre、PEF%Pre)的差异,并对有差异的肺功能指标与NLR进行相关分析。进一步依据是否发生术后肺部并发症将患者分为并发症组与非并发症组,比较两组间患者一般资料、手术情况、术后病理类型及分期、术前肺功能指标、血红蛋白、白蛋白、纤维蛋白原、NLR的差异,分析影响术后肺部并发症的因素。
1.3 统计学方法 采用SPSS 19.0软件进行统计学分析,定性资料采用卡方检验或Fisher精确检验进行分析,定量资料使用独立样本t检验。相关分析采用Pearson相关分析。单因素分析有统计学意义的变量进一步行二元Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
89例患者术后出现并发症者31例(34.83%),共43例次,主要为肺部感染16例次,持续肺漏气15例次,肺不张7例次,呼吸衰竭5例次。所有患者经积极处理后无围术期死亡发生。
89例患者NLR均值为3.65,高于均值的36例定义为高NLR组,低于均值的53例定义为低NLR组。两组间一般情况比较,差异无统计学意义。高NLR组FEV1%Pre、FVC%Pre显著低于低NLR组,差异有统计学意义(P<0.05)。而两组间DLco%Pre、PEF%Pre无统计学差异(P>0.05),见表1。
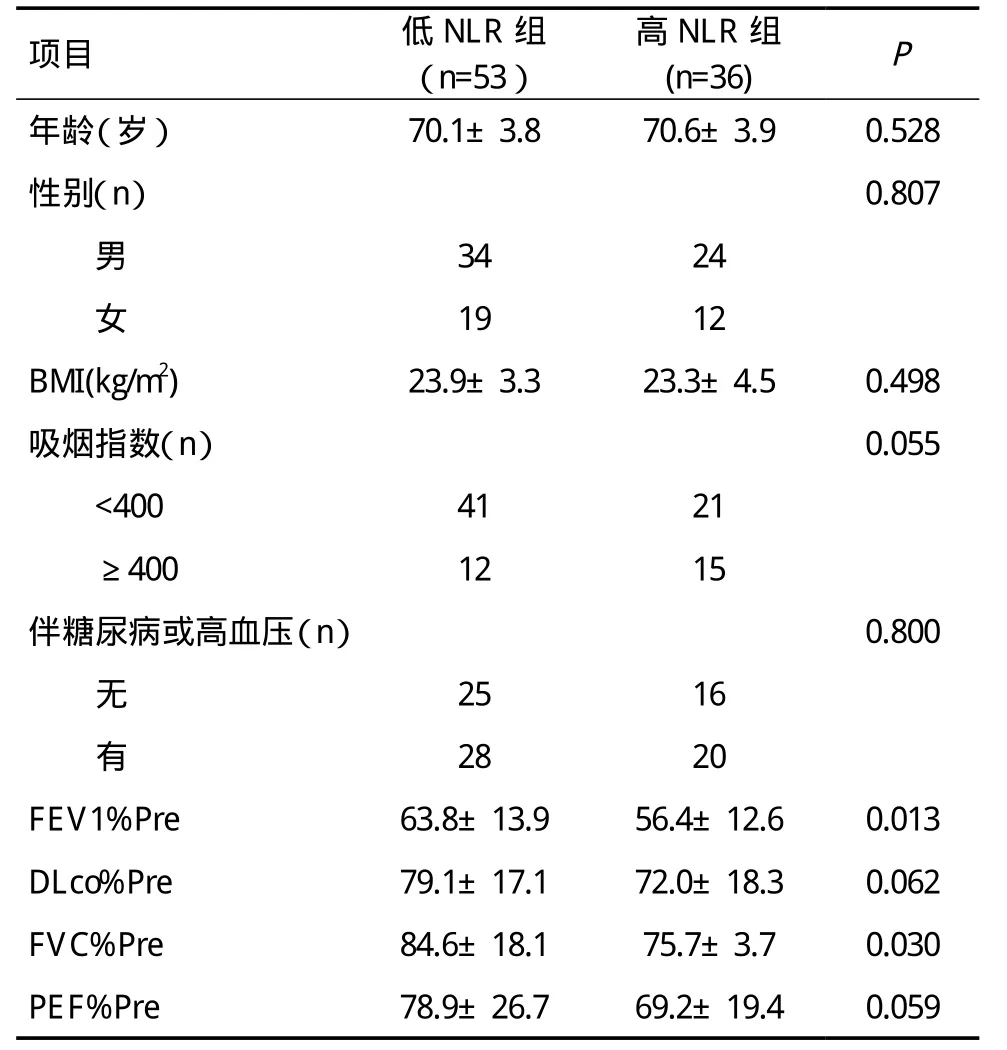
表1 两组患者一般情况及肺功能指标比较
将高NLR组与低NLR组有差异的肺功能指标与术前NLR进行相关分析。结果显示,NLR与FEV1%Pre呈负相关(r=-0.300,P=0.004),而 NLR与 FVC%Pre不具有相关性(r=-0.195,P=0.068)。
单因素分析显示,并发症组与非并发症组吸烟指数、手术时间、FEV1%Pre、FVC%Pre、NLR有统计学差异(P<0.05),而年龄、性别、BMI、慢性病病史、手术方式、术中出血、肿瘤位置、病理类型及分期、血红蛋白、白蛋白、FIB、DLco%Pre、PEF%Pre无统计学差异(P>0.05),见表2。多因素分析显示手术时间长、FEV1%Pre降低、NLR增高是老年肺癌合并慢阻肺患者术后出现肺部并发症的独立危险因素,见表3。

表2 单因素分析术后并发症的危险因素
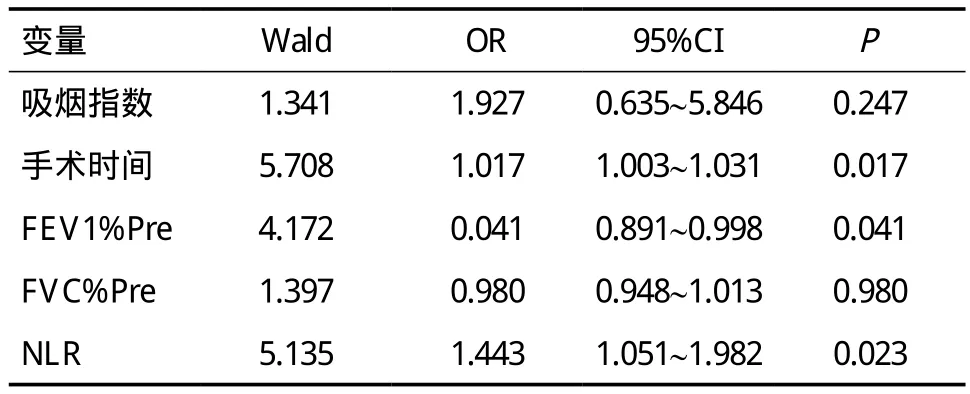
表3 多因素分析术后并发症的危险因素
3 讨论
COPD患者患肺癌的机率较高,COPD也是肺部手术后并发症及围术期死亡的危险因素[6,7]。并发COPD的肺癌患者老年人居多,老年人生理机能减退,因此术前更需准确评估老年肺癌合并COPD患者的肺脏功能状态。目前胸外科常用6分钟步行实验、爬楼实验、肺功能仪器等间接评估慢阻肺严重程度,然而这些指标并不能直接反映慢阻肺真实的病理生理状态。因此临床需要探索更多简单、方便、廉价且能与慢阻肺病理生理相联系的评估指标,以降低手术风险,减少术后并发症,从而改善预后。中性粒细胞、巨噬细胞、T淋巴细胞等在慢阻肺患者的气道、肺实质及肺血管的慢性炎症反应中具有重要作用。COPD患者的这种肺部慢性炎症同时会伴随不同程度的全身性炎症反应[8]。研究已证实外周血TNF-α、IL-6、IL-8 等炎性介质与慢阻肺的严重程度相关[9],并可在一定程度上预测合并COPD肺癌患者的术后并发症,但这些指标临床不常用。
血常规检查在临床中普遍应用,目前中性粒细胞与淋巴细胞的比值已作为炎症指标在多种疾病中应用。关于NLR与慢阻肺肺疾病的研究,近几年国内外报道越来越多。Lee等[3]一项回顾性病例对照研究证明NLR与慢阻肺患者的6分钟步行实验等相关,可作为慢阻肺急性加重的炎性标志物。Lee等[4]一项纳入885例稳定期慢阻肺患者的多中心队列研究证明,NLR与气流受限程度相关,并且可以作为预测未来COPD急性加重的指标。吴春明等[5]回顾分析了96例COPD患者,认为NLR对慢阻肺发作风险及严重程度有正向预测价值,即NLR越高,发作风险越高,程度越严重。与以上报道一致,本研究中高NLR组FEV1%Pre、FVC%Pre低于低NLR组,NLR与反映气流受限程度的FEV1%Pre呈负相关,证明NLR可以反映慢阻肺严重程度。中性粒细胞介导机体非特异性炎症反应,释放弹性蛋白酶等活性物质,在破坏气道等结构中发挥作用。淋巴细胞是机体的重要免疫细胞之一,在免疫调节和免疫应答中起核心作用。NLR综合了这两种细胞的作用,NLR 增大代表中性粒细胞介导的非特异性炎症反应增加和(或)淋巴细胞介导的免疫减弱,即机体处于较高的炎性状态,因而NLR增高可以说明慢阻肺患者气流受限较严重。
在此基础上,本研究进一步探讨了术前NLR与老年肺癌合并COPD患者术后肺部并发症的相关性。结果表明并发症组NLR平均值明显高于非并发症组,多因素回归分析显示术前NLR增高同FEV1%Pre降低、手术时间长是术后肺部并发症的独立危险因素。Kang等[10]认为NLR可以反映全身炎症状态,为克罗恩病患者术后并发症的独立危险因素,当术前NLR≥4.1时,术后并发症的风险将增加2.782倍。Forget等[11]认为手术引起的全身炎症反应可引起术后并发症,术后第7天的NLR水平与腹部手术术后1月内的并发症相关。Son等[12]纳入369例因头颈部肿瘤手术治疗的患者资料,证明术前NLR高的患者术后伤口容易感染。与以上研究观点相同,作者认为NLR增高的慢阻肺患者体内处于较高水平的炎症状态,气流受限程度较重,容易发生肺部感染等并发症。此外,NLR增高可能与机体营养不良导致淋巴细胞降低有关,营养不良会加重术后并发症的发生[13]。
本研究存在一定的局限性。首先,研究已证明NLR与肺癌的发生、发展、侵袭相关[14],本研究未探讨肿瘤因素对机体NLR的影响;其次,作为回顾性研究,本研究只统计了主要并发症,难免存在偏倚;再者,由于本研究样本较少,未探讨 NLR预测术后并发症的最佳截断值。总之,NLR与老年肺癌合并慢阻肺患者的肺功能及术后肺部并发症可能具有相关性。如能得到大样本、前瞻性、多中心的研究来进一步验证,可作为廉价、方便、快速的术前评估指标评价气流受限程度,指导肺保护治疗,从而减少术后肺部并发症。
1 Sekine Y,Suzuki H,Yamada Y,et al.Severity of chronic obstructive pulmonary disease and its relationship to lung cancer prognosis after surgical resection[J].Thorac Cardiovasc Surg,2013,61(2):124-130
2 车国卫,支修益.肺癌合并慢性阻塞性肺疾病患者围手术期气道管理现状 [J].中国肺癌杂志,2014,17(12):884-888
3 Lee SJ, Lee HR, Lee TW, et al.Usefulness of neutrophil to lymphocyte ratio in patients with chronic obstructive pulmonary disease: a prospective observational study[J].Korean J Intern Med,2016,31(5):891-898
4 Lee H,Um SJ,Kim YS,et al.Association of the neutrophil-tolymphocyte ratio with lung function and exacerbations in patients with chronic obstructive pulmonary disease[J].PLoS One,2016, 11(6):e0156511
5 吴春明,陈兴无.中性粒细胞/淋巴细胞比率及血小板平均体积对慢阻肺发作风险和严重程度预测价值[J].临床肺科杂志,2017,22(10):1824-1829
6 Qiang G, Liang C, Xiao F,et al.Impact of chronic obstructive pulmonary disease on postoperative recurrence in patients with resected non-small-cell lung cancer[J].Int J Chron Obstruct Pulmon Dis,2015,29(11):43-49
7 de Torres JP, Marin JM, Casanova C, et al.Lung cancer in patients with chronic obstructive pulmonary disease-incidence and predicting factors[J].Am J Respir Crit Care Med,2011,184:913-919
8 Walter RE, Wilk JB, Larson MG, et al.Systemic inflammation and COPD: the Framingham Heart Study[J].Chest,2008,133(1):19-25
9 Shahriary A,Panahi Y,Shirali S,et al.Relationship of serum levels of interleukin 6, interleukin 8, and C-reactive protein with forced expiratory volume in first second in patients with mustard lung and chronic obstructive pulmonary diseases:systematic review and meta-analysis[J].Postepy Dermatol Alergol,2017,34(3):192-198
10 Kang WM,Zhu CZ,Yang XX,et al.Application of the Onodera prognostic nutrition index and neutrophil-to-lymphocyte ratio in risk evaluation of postoperative complications in Crohn's disease[J].Sci Rep,2017,7(1):8481
11 Forget P,Dinant V,De Kock M.Is the Neutrophil-to-Lymphocyte Ratio more correlated than C-reactive protein with postoperative complications after major abdominal surgery?[J].Peer J,2015,13(3):e713
12 Son HJ,Roh JL,Choi SH,et al.Nutritional and hematologic markers as predictors of risk of surgical site infection in patients with head and neck cancer undergoing major oncologic surgery[J].Head Neck,2018,40(3):596-604
13 Inaoka K,Kanda M,Uda H,et al.Clinical utility of the plateletlymphocyte ratio as a predictor of postoperative complications after radical gastrectomy for clinical T2-4 gastric cancer[J].World J Gastroenterol,2017,23(14):2519-2526
14 Wang L,Liang D,Xu X,et al.The prognostic value of neutrophil to lymphocyte and platelet to lymphocyte ratios for patients with lung cancer[J].Oncol Lett,2017,14(6):6449-6456

