猪圆环病毒2型与链球菌7型协同感染研究
周德方,崔熙尧,郑高颖,郑乾坤,成子强,*
(1.山东农业大学动物科技学院,山东泰安 271018;2.山东得利斯食品股份有限公司,山东潍坊 261000)
猪圆环病毒(Porcine circovirus,PCV)为二十面体对称、无囊膜、单股环状DNA病毒。病毒粒子直径为17 nm,是迄今发现的一种最小的致病性动物病毒[1]。根据PCV对猪的致病性、抗原性和核酸序列的差异,可将其分为PCV-1 和PCV-2两个基因型。PCV-1基因组全长为1 759 nt,是由Tischer I等[2]首次作为PK-15细胞的污染物报道,而不引起猪发病,血清学研究发现其在许多地区广泛存在。PCV-2具有致病性,基因组全长1 767 nt或1 768 nt[3-4],可引发多种疾病导致猪群产生严重免疫抑制。二者序列同源性小于80%,但PCV-1毒株间的核苷酸序列同源性大于99%,PCV-2毒株间的核苷酸序列同源性大于96%。
猪链球菌(Streptococcussuis)是一种重要的人畜共患病原,也是近年来国内外报道最多的一种重要的细菌性病原。猪链球菌流行最广,对猪的致病性亦最强,可引起猪败血症和淋巴结脓肿,临床上以败血症、化脓性淋巴结炎、脑膜炎及关节炎等多见[5-6],也可引起人的发病和死亡[7]。目前,根据其荚膜多糖抗原的不同可将链球菌分为35种血清型,即1-34型及1/2型[8-9]。
PCV-2主要引起断奶仔猪多系统衰竭综合征(PMWS)、皮炎肾病综合征(PDNS)等多种疾病。然而,多种协同因素,包括传染性协同因子被认为可促进该病的发展。一旦感染本病毒,会使猪对疫苗的免疫应答性能降低,自身免疫功能亦逐渐降低,从而继发或并发其他传染病,同时可加重其他传染病的临床表现和病理过程,并呈现致病上的协同作用。随着链球菌7型菌株在全世界病猪中的频繁发现[10-11],对其各方面特性的研究也显得非常重要。2016年10月山东省临沂市某猪场40日龄猪群发病,至100日龄死亡率高达30%,通过临床症状观察、病理剖检、病理组织学检查、PCR及序列测定、病毒分离鉴定及细菌分离鉴定等方法确定了该病为猪圆环病毒2型与链球菌7型协同感染。
1 材料与方法
1.1 材料
1.1.1 细胞及病料 山东省临沂市某猪场病猪的淋巴结、肝脏、肺脏、脾脏置液氮保存备用。无PCV污染的PK-15细胞由本实验室保存,100 mL/L胎牛血清在体积分数为5%的二氧化碳培养箱中37℃培养。
1.2 方法
1.2.1 血涂片制备 送检病猪血液进行涂片,瑞氏-吉姆萨试剂染色,光镜观察。
1.2.2 剖检及病理组织学检测 将送检3头病猪进行剖检,观察大体病变。取肝脏、脾脏、肾脏、心脏、肺脏、大脑、淋巴结于100 mL/L福尔马林液固定,石蜡包埋,切片,HE染色,光镜观察。
1.2.3 PCR检测
1.2.3.1 引物设计与合成 根据文献[12]设计的PCR引物:猪圆环病毒(PCV-2):(F)5′-AAGGGCTGGGTTATGGTATG-3′,(R)5′-CGCTGGAGAAGGAAAAATGG-3′,片段大小为353 bp;猪瘟病毒(CSFV):(F)5′-GTCGTCAGTAGTTCGACG-3′,(R)5′-ATGCTCTTTTGGGGCTAT-3′,片段大小为777 bp;猪伪狂犬病病毒(PRV):(F)5′-GGGGTTGGACAGGAAGGACACCA-3′,(R)5′-AACCAGCTGCACGCGCTCAA-3′,片段大小为198 bp;猪繁殖与呼吸综合征病毒(PRRSV):(F)5′-GAGTTTCAGCGGAACAATGG-3′,(R)5′-GCCGTTGACCGTAGTGGAG-3′,片段大小为451 bp;猪细小病毒(PPV):(F)5′-AGTTAGAATAGGATGCGAGGAA-3′,(R)5′-AGAGTCTGTTGGTGTATTTATTGG-3′,片段大小为265 bp。所有引物均由华大基因公司合成。
1.2.3.2 PCR模板制备 取3头病猪肝脏,每个肝脏样品取100 mg,消化缓冲液研磨,蛋白酶K(100 μg/mL)于56℃消化过夜,再用酚-氯仿抽提,制备基因组DNA,置-20℃保存备用。
1.2.3.3 PCR反应 反应体系25 μL :PCR master mix 12.5 μL,上、下游引物各0.5 μL,模板DNA 1 μL,ddH2O补足25 μL。反应程序为:95℃ 5 min;94℃ 30 s, 56℃ 30 s,72℃ 50 s,30个循环;72℃ 10 min; 4℃结束反应。产物经琼脂糖凝胶电泳检测。
1.2.3.4 PCR 产物序列分析 将纯化后的目的基因送公司测序,用DNA Star 软件对序列结果和GenBank中收录的序列进行比较、同源性分析以及绘制系统进化树。
1.2.4 病毒分离培养
1.2.4.1 组织匀浆破碎 取液氮中冻存的肝脏组织于灭菌1.5 mL EP管内剪碎,重悬研磨破碎,反复冻融3次,超声破碎仪破碎,10 000 r/min离心10 min取上清,一次性灭菌滤器过滤。
1.2.4.2 病毒分离细胞培养 取滤过液上清接种到无PCV污染的PK-15细胞,37℃感作2 h,同时设空白对照,弃掉细胞培养液,300 mmol/L D-氨基葡萄糖处理20 min,弃D-氨基葡萄糖,无菌PBS冲洗2~3次,换成10 mL/L 胎牛血清细胞维持液,置于37℃二氧化碳培养箱内,定期观察细胞生长情况传代培养,收集病毒液。
1.2.4.3 PCR反应 收集PK-15细胞悬液,反复冻融3次后,12 000 r/min离心5 min取上清,按试剂盒步骤提取DNA为模板,按照步骤1.2.3.3进行PCR扩增,琼脂糖凝胶电泳检测。
1.2.5 细菌学检测
1.2.5.1 尿液涂片制备 无菌取病猪膀胱内潴留的尿液涂片,革兰染色后镜检。
1.2.5.2 分离培养 无菌环境下将尿液接种于哥伦比亚血琼脂平板置37℃恒温培养24 h后观察,挑取单菌落进行纯培养。
1.2.5.3 16S rRNA鉴定 提取菌液、不同单菌落形态的菌株基因组DNA为模板;用16S rRNA引物[13]进行PCR反应,片段大小为1 600 bp,引物序列如下:(F)5′-AGAGTTTGATCCTGGCTCAG-3′, (R)5′-GGTTACCTTGTTACGACTT-3′,由华大基因公司合成;反应体系25 μL :PCR master mix 12.5 μL,上、下游引物各0.5 μL,模板DNA 1 μL,ddH2O补足25 μL;反应程序为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min 45 s,共32个循环;72℃ 10 min;4℃结束反应。PCR产物经琼脂糖凝胶电泳检测;参照凝胶回收试剂盒回收纯化PCR产物,将纯化后的目的基因产物送至华大基因公司进行序列测定。
1.2.5.4 PCR 产物序列同源性分析 将细菌16S rRNA基因序列中间1 600 bp片段序列导入NCBI网站(http://www.ncbi.nlm.nih.gov) BLAST在线软件,获取与16 S rRNA基因序列同源的序列以及对应的细菌名称。将测序结果与GenBank中不同血清型的分离株序列进行比对,用DNA Star软件进行同源性分析。
1.2.6 动物回归试验
1.2.6.1 试验用动物感染及饲养 选取35日龄的PCV-2阴性健康断奶仔猪9头,分别为攻毒组和对照组,随机分为3组,每组3头。第1组感染PCV-2和链球菌7型,第2组感染PCV-2细胞培养液,第3组为空白对照。接种方法为滴鼻和颈部肌肉注射,接种剂量为2 mL/头。各组严格隔离饲养。攻毒后每日测量试验动物体温,观察采食量与临床症状,每3 d采血1次,每周称重1次。在接种后21 d处死,取不同脏器进行病理组织学观察。
1.2.6.2 临床症状的观察 用日体温平均值绘制体温变化折线图,并做t检验。用周体重均值绘制折线图,并做t检验。根据预先制定的临床症状评分标准(表1),对各组试验动物临床症状的严重程度给予评分,用累积分值评价感染的严重程度,以各组不同时间累积分值做折线图,并做t检验。
1.2.6.3 免疫器官指数测定 处死试验猪后,取脾、扁桃体、肺门淋巴结、腹股沟浅淋巴结、颈前背测淋巴结、髂内淋巴结、肠系膜淋巴结、下颌淋巴结等主要免疫器官进行称重,计算免疫器官指数,公式如下:免疫器官指数=免疫器官重量(kg)/猪活体重(kg)。
2 结果
2.1 临床症状及剖检病变
病猪生长迟缓,精神委顿,全身发紫,消瘦,呼吸困难,卧地不起(图1 A)。病猪鼻腔发紫且内有带气泡的黏液(图1 B)。横切和纵切气管均可见黏液渗出(图1 C、D)。肺脏表面大量灰黄色纤维素渗出,实变呈橡皮样,散在有大小不等的褐色实变区(图1 E)。淋巴结肿大、出血(图1 F)。肾脏肿大,呈灰白色,切面皮质变薄,髓质增厚(图1 G)。膀胱积尿,且底部可见针尖大出血点(图1 H)。
二是加大政府投入。商城县政府应加大财政资金投入力度,建立旅游业发展专项资金,用于完善旅游目的地基础设施建设、旅游宣传促销、旅游特色景观和重点旅游项目建设等。
2.2 血细胞变化
血液中大量红细胞皱缩,淋巴细胞、中性粒细胞数量明显增多(图2A、B)。
2.3 病理组织学病变
病猪病理组织学病变明显,主要表现为肺出血,巨噬细胞和淋巴细胞浸润(图3A),肺泡浆液性渗出(图3B);淋巴结血管内皮细胞肿胀,髓质内弥漫性出血(图3C、D);肾脏呈现间质性肾炎,髓质部淋巴细胞浸润和组织细胞增生 (图3E);肝小叶门管区淋巴细胞浸润、结缔组织增生(图3F);脾出血,单核巨噬细胞浸润(图3G);大脑脑室内膜表现为局灶性脑膜脑炎(图3H)。
2.4 组织病料及培养细胞PCR病原检测结果
提取肝脏样品基因组DNA为模板,PCR检测猪瘟病毒、猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪细小病毒和猪圆环病毒2型,扩增产物经琼脂糖凝胶电泳,结果显示PCV-2为阳性,其他病毒均为阴性(图4A)。取部分病料进行试验,结果显示,3头病猪PCV-2全为阳性,在343 bp处有一明显的条带(图4B ),产物均匀一致,阴性对照未扩增出条带。同样,病料感染的PK-15细胞PCR也为PCV-2阳性(图4C)。
2.5 病毒基因序列分析比对
通过细胞培养获得1株PCV-2病毒,将扩增的基因序列与从GenBank收录的毒株序列中选取11株PCV-2毒株经DNA Star软件进行序列分析,可以看出,同源性介于99.4%~99.7%(图5)。

A.病猪精神委顿,消瘦,全身发紫;B.病猪鼻部发紫,鼻腔内有黏液;C、D.气管内黏液渗出;E.肺脏实变呈橡皮样,大量纤维素渗出,散在有大小不等的褐色实变区;F.淋巴结肿大、出血;G.肾脏肿大,呈灰白色,皮质变薄,髓质增厚;H.膀胱底部针尖大出血点
A.Affected pig showed depression,emaciation and purple body; B.The nose of pig was purple,nasal cavity filled with mucus; C,D.Tracheal mucus was exuded; E.Lung was rubber-like,a large number of fibrins were exuded,and brown consolidation areas with varying sizes were scattered; F.Lymph node swelling and hemorrhage; G.Kidney swelled,and turned to gray,with thinning cortex,and thickening medulla; H.Pinpoint-sized bleeding point seen at the bottom of the bladder
图1送检病猪的大体病变
Fig.1 General pathological lesions of tested pigs

A、B.大量红细胞形态变形、淋巴细胞、中性粒细胞数量增多(400×、1000×)
A,B.The deformed red blood cells,increased number of lymphocytes and neutrophils in blood(400×,1000×)
图2送检病猪血细胞变化
Fig.2 Blood smear observation of sick pigs
2.6 细菌学检测
2.6.1 尿液涂片镜检 见有大量直径约为1 μm~2 μm的革兰阳性圆球形细菌,呈单个、成对或长短不一的短链状排列;由于膀胱底部出现针尖大出血点,说明膀胱损伤,见有脱落的上皮细胞存在于尿液中,且呈空泡变性(图6)。
2.6.2 分离培养 无菌环境下将尿液接种于哥伦比亚血琼脂平板,置37℃恒温培养24 h后,肉眼可见单一的菌落形态,呈针尖大小、灰白色、圆形、光滑、边缘整齐的细小菌落。
2.6.3 16S rRNA鉴定 PCR鉴定结果显示,2个样品全为阳性,扩增片段大小约为1 600 bp(图7),与预期片段大小相符,条带产物均匀一致,阴性对照未扩增出相应条带。
2.6.4 16S rRNA序列分析 在GenBank上对于16S rRNA基因测序结果进行比对分析,结果表明扩增序列与GenBank上公布的猪链球菌7型同源性为100%(图8),表明该链球菌为猪链球菌7型。
2.7 动物回归试验的临床结果与分析

A.肺出血,巨噬细胞和淋巴细胞浸润(1 000×);B.肺泡浆液性渗出(200×);C、D.淋巴结出血(200×、1 000×);E.肾间质性肾炎 (1 000×);F.肝淋巴细胞浸润、结缔组织增生、(400×);G.脾出血,单核巨噬细胞浸润 (1 000×);H.局灶性脑膜炎(200×)
A.Pulmonary hemorrhage,infiltration of macrophages and lymphocytes (1 000×); B.Alveolar serous exudation(200×); C,D.Lymph node hemorrhage (200×,1 000×); E.Renal interstitial nephritis (1 000×); F.Connective tissue proliferation,lymphocyte infiltration in liver (400×); G.Spleen hemorrhage and infiltration with mononuclear macrophages(1 000×); H.Focal meningitis (200×)
图3送检病猪的组织病理学变化(HE染色)
Fig.3 Histopathological lesions of tested pigs(HE staining)
2.7.2 体重的变化 PCV-2和链球菌7型共感染组体重呈负增长趋势,其他两组均为上升趋势。PCV-2感染组和空白对照组的平均日增重差异不显著(P>0.05)。空白对照组极显著高于PCV-2和链球菌7型共感染组(P<0.01),PCV-2感染组显著高于PCV-2和链球菌7型共感染组(P<0.05)(图10)。
2.7.3 临床表现 根据表1所示标准评判试验动物症状严重程度,统计结果绘制成折线图(图11)。PCV-2和链球菌7型共感染组和PCV-2感染组均极显著高于空白对照组(P<0.01)。同时,共感染组和PCV-2感染组之间差异显著(P<0.05)。PCV-2和链球菌7型共感染组发病率为100%(8/8),死亡率为50%(4/8)。PCV-2感染组发病率为62.5%(5/8),死亡率为0。空白对照组发病率为0,死亡率为0。
2.7.4 免疫指数测定 PCV-2和链球菌7型共感染组和PCV-2感染组的脾、全身淋巴结指数均高于空白对照组,差异显著(P<0.05),个别差异极显著(P<0.01)。各组扁桃体无显著差异(P>0.05)。同时,共感染组的全身淋巴结指数均高于PCV-2感染组,差异显著(P<0.05),个别差异极显著(P<0.01)。
2.7.5 大体剖检病变 空白对照组未发现明显变化。接毒组病变部位主要在淋巴结、肺、肾、脾,肺门淋巴结肿胀明显,其他淋巴结轻度肿胀。脾淤血肿胀。其中共感染组的腹股沟浅淋巴结和下颌淋巴结肿胀程度明显严重于PCV-2感染组。
2.7.6 组织学病变 除空白对照组外,接毒组的脏器均有不同程度的组织病理变化。接毒组全身淋巴结均见充血、出血。PCV-2感染组脾红髓充血、出血,白髓部分淋巴细胞核浓缩深染或崩解破碎。共感染组髓质区见嗜酸性粒细胞浸润,白髓部分淋巴细胞缺失现象明显。接毒组肝脏有淋巴细胞浸润,肺脏小血管有血栓,并伴有不同程度的间质性肺炎。其严重程度为共感染组大于PCV-2感染组,与猪场病例基本一致。
3 讨论
近年来,PCV-2的优势亚基因型正在从PCV-2a向PCV-2b变化,这种变化可能会增强猪圆环病毒相关疾病(PVCAD)的严重性和提高其发病率[3,14]。而有关PCV-2协同感染普遍性的研究很少有发表的文献,其表现出发病急、症状明显、病死率明显提高、宿主范围扩大等特点;临床症状、病理变化更加相似,难以鉴别诊断,不利于疾病的确诊和防治。猪圆环病毒2型感染可引起猪的免疫抑制,从而使机体更易协同感染其他病原,呈二重感染或多重感染。在我国,链球菌7型的报道相对较少。因此,控制好原发病,对于防治多种病原的协同感染至关重要。本次病例采用多种方法进行诊断,根据猪群发病情况、临床症状、剖检病变、组织学病变、病原分离鉴定、PCR检测结果以及动物回归试验,认定该群为猪圆环病毒2型与链球菌7型混合感染,并呈现致病上的协同作用。

A.PCR扩增特异性试验结果。M.DNA标准DL 1 000;1.猪圆环病毒2型;2.猪瘟病毒;3.猪伪狂犬病病毒;4.猪繁殖与呼吸综合征病毒;5.猪细小病毒;6.阴性对照
B.病料PCV-2特异性PCR结果。M.DNA标准DL 1 000;1~3.检测样品;4.阳性对照;5.阴性对照
C.细胞PCV-2特异性PCR结果。M.DNA标准DL 1 000;1.第8代病毒细胞培养PCR扩增产物;2.阳性对照;3.阴性对照
A.Specificity test results of PCR amplification.M.DNA Marker DL 1 000;1.PCV-2;2.CSFV;3.PRV;4.PRRSV;5.PPV;6.Negative control
B.PCR amplification results of PCV-2.M.DNA Marker DL 1 000;1-3.Detected samples;4.Positive control;5.Negative control
C.PCR amplification results of PCV-2 in the cells.M.DNA Marker DL 1 000; 1.PCR products of the eighth cells infected with PCV-2;2.Positive control;3.Negative control
图4病猪肝脏及培养细胞PCR检测结果
Fig.4 PCR amplification results of liver samples of pigs and the cells infected with PCV-2
病变分布于全身器官、组织,呈广泛性病理损伤。主要表现为高度弥漫性间质性肺炎,证实PCV-2和链球菌7型的协同作用所致的肺炎,比其中任何一种病原单独感染时更严重,因此,还需要进一步认识PCV-2如何与其他病原协同作用而加重呼吸道疾病的严重程度;重度的多灶性间质性肾炎、以肝细胞的单个坏死为特征的肝炎,证实感染PCV-2后的肝脏、肾脏的病变因协同感染链球菌7型而加重;在PCV-2与链球菌7型的协同作用下,全身淋巴结肿大,多个脏器均可见淋巴细胞、中性粒细胞以及血液中大量红细胞形态变形、淋巴细胞、中性粒细胞数量明显增多。在无菌条件下,直接取尿液涂片染色,可见大量长短不一、单个、成对或数个短链状排列的革兰阳性球菌以及脱落的上皮细胞存在于其中,此方法通过临床渗出物直接涂片、染色可以快速的做出诊断,方法简便,值得推广。因此,可通过剖检病变、血液涂片、尿液涂片、病理组织学观察以及动物回归试验做出诊断,证明猪圆环病毒2型(PCV-2)与链球菌7型对于加重病变和临床症状具有明显的协同作用。猪圆环病毒2型是DNA病毒,易于抽提核酸,并从核酸水平对病毒进行检测和研究,在病猪的鼻黏膜、支气管、肺、肾、小肠中均可检测到猪圆环病毒2型;胸腺、脾、支气管等处的淋巴组织中也均有病毒。说明PCV-2严重侵害猪免疫系统,病毒与巨噬细胞、组织细胞相伴随,导致患猪体况下降,形成免疫抑制。在本研究中,PCR 方法可以快速准确检测感染病例组织样品中的PCV-2核酸,该方法敏感、特异,是精确检测PCV-2和实验室诊断猪圆环病毒病的有效手段,以及16S rRNA对猪链球菌的分子鉴定。因此,可通过PCR方法做出诊断,本次疫病系猪圆环病毒2型(PCV-2)与链球菌7型混合感染,并呈现致病上的协同作用。这两种重要病原在猪群中的协同感染警示猪场应重视疫苗免疫结合生物安全措施的应用,避免出现更大的暴发和流行。
虽然在PCV-2相关疾病中都证实了存在PCV-2协同感染,但是PCV-2与其他病原协同作用导致协同感染病情加重的机制仍有待确定,可能是促进了PCV-2在巨噬细胞和其他靶细胞中的复制[15],相对而言,影响细胞分裂因子和其他生长因子也可能间接地上调PCV-2的复制。研究表明,在PK-15细胞,PCV-2可引起自噬体的形成,促进病毒复制,并可能通过Cap蛋白发挥作用[16]。因此,还需要进行更多的研究以便确定在与PCV-2有关的临床综合征发病中PCV-2与其他病原之间相互作用的机理。
该发病猪群曾免疫圆环病毒疫苗,但仍发病,且死亡率高。这表明猪圆环病毒2型与链球菌7型协同感染很大程度上促进了疾病的发生、发展。PCV-2感染的个体可因免疫抑制而导致免疫缺陷,对疫苗接种没有充分的免疫应答,其感染引发的免疫器官及相关器官的损害,无疑会降低机体的体液免疫及细胞免疫的应答能力,从而增加对其他疾病的易感性。再加上PCV-2疫苗对猪的保护只是一种干扰作用,只能干扰PCV-2对机体的作用,而不能防止周围环境的病毒或者细菌进入体内,也不能阻止体内病毒排除体外向周围扩散,此时,当猪群受到圆环病毒入侵时,很容易造成免疫抑制,引发猪群感染发病。猪圆环病毒2型与链球菌7型两种病原相互作用的恶性循环可导致猪群更高的病死率和较差的生产性能。目前世界各国控制本病的经验是对共同感染源做适当的主动免疫和被动免疫,做好免疫接种,确保胎儿和吮乳期仔猪安全。因此,根据不同的可能病原和不同的疫苗对母猪实施合理的免疫程序至关重要。
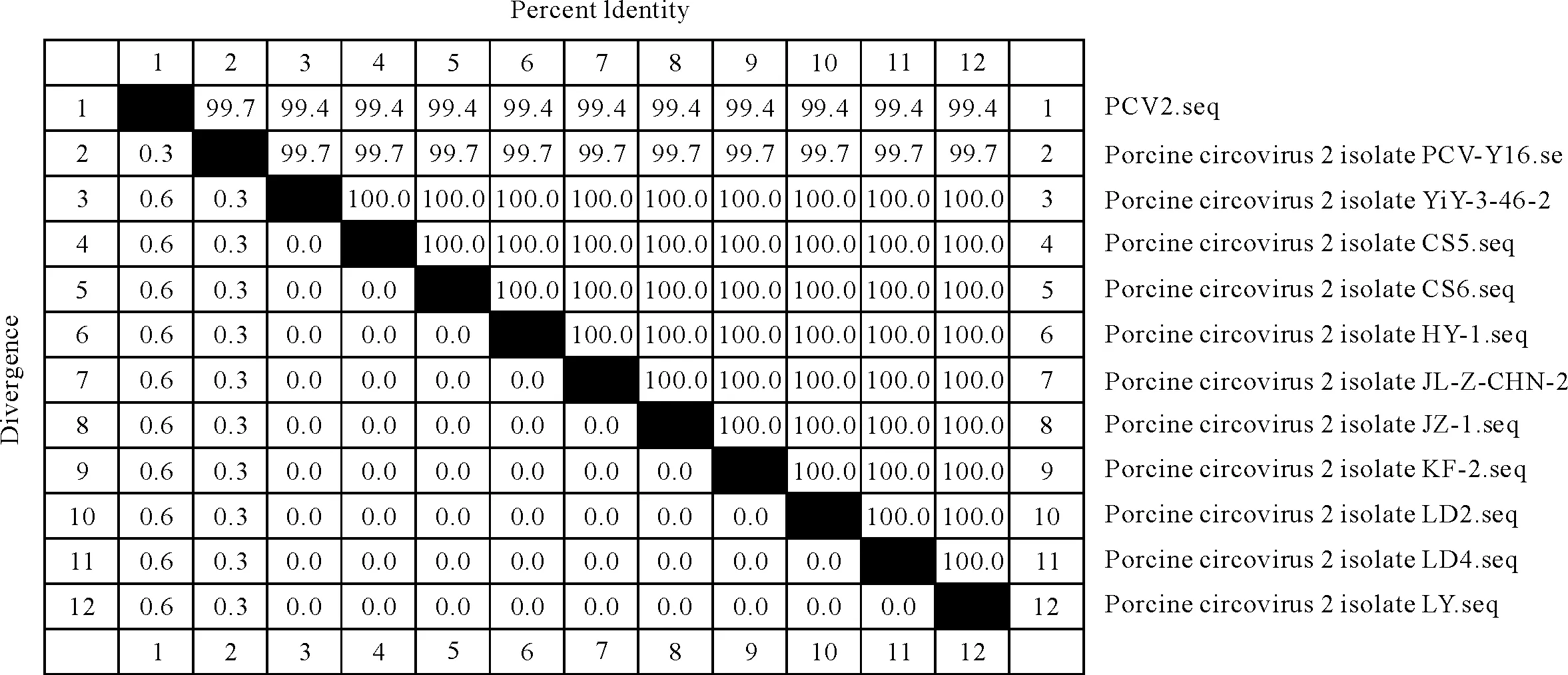
图5A PCV-2毒株基因序列同源性比较

图5B PCV-2分离毒株基因序列的系统进化树

革兰阳性圆球形细菌,呈单个、成对或长短不一的短链状排列,以及脱落的上皮细胞存在于尿液中(1 000×)
A number of Gram-positive cocci,single,pairs or different length and shedding epithelial cells present in the urine(1 000×)
图6病猪尿液制片镜检
Fig.6 Urine smear observation of the tested pig

M.DNA标准DL 2 000;1.菌液PCR扩增产物;2.菌粒PCR扩增产物;3.阴性对照
M.DNA Marker DL 2 000;1.PCR products of bacteria liquid;2.PCR products of the bacteria;3.Negative control
图7细菌PCR扩增结果
Fig.7 PCR amplification results of bacteria

图8 链球菌分离株基因序列的系统进化树

图9 各感染组平均体温的变化

图10 各感染组体重的变化

图11 各感染组平均临床症状积分的变化
参考文献:
[1] Ellis J,Spinato M.Porcine circovirus 2-associated disease in Eurasian wild boar [J].J Vet,2003,15(4):364-368.
[2] Tiscather I,Rasch R.Characterization of papovavirus-and picornavirus-like particles in permanent pig kidney cell lines [J].Zentralbl Bakteriol Orig A,1974,226:153-167.
[3] 郭龙军,陆月华,危艳武,等.我国部分地区猪圆环病毒2型分离株的遗传变异分析 [J].中国预防兽医学报,2009,31(11):856-859.
[4] Dupont K,Nielsen E O,Bkbo P,et al.Genomic analysis of PCV-2 isolates from Danish archives and a current PMWS case-control study supports a shift in genotypes with time [J].Vet Microbiol,2008,128(1-2):56-64.
[5] Chanter N,Jones P W,Alexander T J L.Meningitis in pigs caused byStreptococcussuis-a speculative review [J].Vet Microbiol,1993,36:39-55.
[6] Gottschalk M,Segura M.The pathogenesis of the meningitis caused byStreptococcussuis:the unresolved questions [J].Vet Microbiol,2000,76:259-272.
[7] Arends J P,Zanen H C.Meningitis caused byStreptococcussuisin humans [J].Rev Infect Dis,1988,10:131-136.
[8] Gottachalk M G,Higgins R,Jaques M,et al.Characterization of six new capsular types(23 through 28) ofStreptococcussuis[J].Clin Microbiol,1991,29:2590-2594.
[9] Higgins R,Gottchalk M,Boudreau M,et al.Description of six new capsular types (29-34) ofStreptococcussuis[J].Vet Invest,1995(7):405-406.
[10] Machenman M,Fester G,Dick K,et al.Streptococcussuisserotypes 7,8 and 14 from diseased pigs in Scotland [J].Vet Rec,1996,139:423-424.
[11] Aaretrup F M,Jorsal S E,Jensen N E.Serological characterization and antimicrobial susceptibility ofStreptococcussuisisolates from diagnostic samples in Denmark during 1995 and 1996 [J].Vet Microbiol,1998,15:59-66.
[12] Xu X G,Chen G D,Huang Y et al.Development of muitiplex PCR for simultaneous detection of six swine DNA and RNA viruses [J].Virol Meth,2012,183:69-74.
[13] Weisburg W G,Barns S M,PelletlerD A,et al.16S Ribosomal DNA amplification for phylogenetic study [J].J Bacteriol,1991,173(2): 697-703.
[14] Fang W,Xin G,Ge X,et al.Genetic variation analysis of Chinese strains of porcine circovirus type 2 [J].Virus Res,2009,145(1):151-156.
[15] Ellis J,Clank E,Haines D,et al.Porcine circovirus-2 and concurrent infections in the field [J].Vet Microbiol,2004,98(2):159-63.
[16] Olovera A,Cortey M.Molecular evolution of porcine circovirus type 2 genomes:Phylogeny and clonality [J].Virology,2007,357(2):175-185.

