铅暴露对成骨细胞MC3T3-E1细胞线粒体的影响
, , , [陆军军医大学(第三军医大学)第二附属医院骨科,重庆 400037]
铅是一种在工业生产中广泛应用的重金属毒物,可对包括血液系统、神经系统、泌尿系统和生殖系统等各组织器官造成损伤[1]。有研究表明,骨骼同样是铅中毒的重要靶器官,铅可对动物成骨细胞功能造成损害,铅中毒还可导致儿童血清中骨钙素的水平下降[2]。成骨细胞是参与骨骼形成的主要细胞,对体内骨组织生长与发育、骨代谢的平衡以及损伤修复发挥关键作用[3],成骨细胞过度凋亡,会影响骨骼修复,甚至进而导致骨质疏松的发生[4]。
线粒体是细胞内重要的细胞器,对细胞内的能量代谢、离子平衡以及对外界因素的应激方面发挥着重要的作用。因此,线粒体也是诸多外源性化合物最为敏感的靶点,尤其是在氧化损伤最主要的靶细胞器[5-7]。为研究铅对成骨细胞损伤的作用与机制,本研究通过对MC3T3-E1细胞染毒后培养,观察并测定线粒体形态与功能变化,为揭示铅对骨骼发挥毒性的机制提供依据。
1 材料与方法
1.1 主要试剂及配制
醋酸铅[Pb(Ac)2,分析纯]购买于上海化学试剂四厂,MC3T3-E1细胞株购买于中科院上海细胞库,BCA蛋白浓度试剂盒、三磷酸腺苷(ATP)试剂盒、JC-1线粒体膜电位试剂盒、细胞色素c试剂盒购买于碧云天生物技术研究所。CCK-8细胞增殖毒性试剂盒购买于东仁化学科技公司。DMEM培养基购买于Hyclone公司。胎牛血清购买于Gibco公司。
1.2 实验方法
1.2.1 细胞培养 培养MC3T3-E1细胞采用的DMEM培养基含体积分数10%的FBS、100 ku/L的青霉素和100 mg/L的链霉素,细胞培养箱参数为37 ℃,CO2体积分数5%。
1.2.2 CCK-8细胞增殖毒性检测试验分析细胞存活率 取生长良好的MC3T3-E1细胞,按2×104个/孔接种至96孔板中,分为对照组(Control组,不作任何处理),醋酸铅组(Pb组,加入醋酸铅溶液,使培养液中醋酸铅最终浓度分别为0、1、10、100 μmol/L),每组分别设置5个复孔,分组后,将细胞置于细胞培养箱内培养24 h后加入含10 μL CCK-8的培养液100 μL,孵育1 h,450 nm波长测量OD值进而计算细胞存活率。
1.2.3 细胞提取液制备 取生长良好的MC3T3-E1细胞按106个/瓶接种至100 mL培养瓶,分组与1.2.2项下相同,细胞置于培养箱内培养24 h,将培养液吸取备用。细胞经过胰酶消化后收集至吸取的培养液中。经过600 g 4 ℃ 5 min离心后收集细胞,去上清,用PBS洗涤1次,再去上清,按照100 μL裂解液每200万细胞的比例加裂解液,经重悬沉淀后,冰浴裂解15 min,经4 ℃ 16 000~20 000 g 15 min离心后,吸取上清部分,BCA方法测得蛋白浓度后于-80 ℃冻存备用。
1.2.4 细胞线粒体膜电位的检测 取生长良好的MC3T3-E1细胞(细胞密度8×104个/mL)收集于6孔板中,培养过夜细胞贴壁后,按照1.2.2项下实验分组分别进行加药。实验期满后,加入JC-1探针,共同孵育20 min后用JC-1缓冲液洗涤2次。当线粒体膜电位处于较高水平时,JC-1荧光探针主要聚集在线粒体的基质当中,形成聚合物,从而产生红色荧光;当线粒体膜电位处于较低水平时,JC-1荧光探针大部分不能聚集在基质中,难以形成聚合物,因而JC-1单体产生绿色荧光。因此,可以使用TCS-SP5激光共聚焦显微镜通过检测红色与绿色荧光比例的增减来反映线粒体膜电位的变化。具体操作步骤按试剂盒(碧云天)说明书执行。
1.2.5 细胞ATP含量测定 ATP含量的测定通过ATP含量试剂盒(碧云天)完成,利用Tecan荧光酶标仪对结果进行检测,具体操作步骤按试剂盒(碧云天)说明书执行。
1.2.6 细胞色素c含量测定 首先通过细胞线粒体分离试剂盒(碧云天)分离出线粒体和浆蛋白。然后将线粒体和浆蛋白分别溶解于裂解缓冲液之中,用BCA方法分别测定对应的蛋白浓度。利用ELISA试剂盒(碧云天),分别检测线粒体和浆蛋白中细胞色素c的含量,具体操作步骤按试剂盒(碧云天)说明书执行。
1.2.7 Caspases-3活性检测 Caspases-3的活性通过Caspase-3活性检测试剂盒完成。与前述方法相同,先制备各组的细胞裂解液,并通过BCA方法测定对应的蛋白浓度。催化底物Ac-DEVD-ρNA产生黄色的ρNA,之后用酶标仪通过测量405 nm处的吸光度,反映Caspases-3的活性。
1.2.8 透射电镜观察线粒体形态 取生长良好的MC3T3-E1细胞按2×105个/孔接种于100 mL培养皿中,采用与1.2.2相同分组,细胞于培养箱内培养24 h,分别将细胞移入离心管中300 g离心5 min,弃上清,4 ℃预冷PBS漂洗1次。样品经固定、脱水、浸透、包埋、切片、染色等步骤后通过透射电镜观察线粒体形态的改变。
1.3 统计学分析
2 结果
2.1 铅暴露对线粒体膜电位及ATP合成的影响
如图1所示,MC3T3-E1细胞暴露于(0、1、10 μmol/L)醋酸铅溶液24 h后,与对照组(Control)相比,各暴露组[Pb(1),Pb(10),Pb(100)]线粒体膜电位去极化程度显著增加,差异有统计学意义(P<0.05),表明线粒体膜电位降低,且体现出明显的剂量依赖性;同样,ATP含量测量显示,与对照组相比,各暴露组[Pb(1)、Pb(10)、Pb(100)]的ATP合成显著减少,差异有统计学意义(P<0.05),且随着醋酸铅浓度增高,ATP合成量下降更为显著。本结果表明铅暴露24 h后引起MC3T3-E1细胞线粒体膜电位的降低,ATP合成减少。
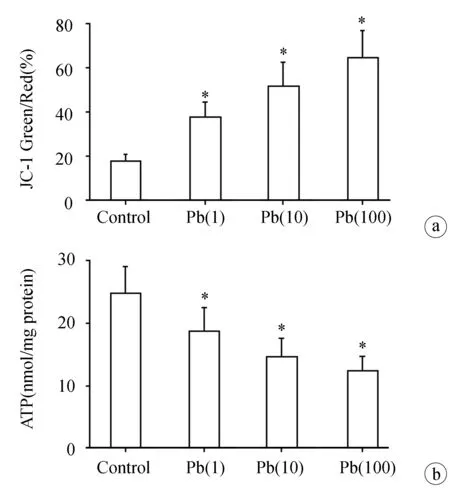
a:JC-1探针标记后,绿色荧光与红色荧光的比例来反映线粒体膜电位去极化的程度(n=5);b:利用ATP含量测定试剂盒(碧云天)进行ATP含量测定(n=5) *:与对照组相比,P<0.05
图1铅暴露对线粒体膜电位及ATP合成的影响
2.2 铅暴露对线粒体细胞色素c含量的影响
分离细胞胞浆和线粒体,分别检测胞浆和线粒体内细胞色素c的含量。如图2所示,MC3T3-E1细胞暴露于各浓度醋酸铅溶液24 h后,与对照组相比,各暴露组[Pb(1),Pb(10),Pb(100)]的胞浆内细胞色素c含量显著上升,差异有统计学意义(P<0.05),而线粒体内细胞色素c含量显著下降,差异有统计学意义(P<0.05),表明铅暴露24 h后引起MC3T3-E1细胞内细胞色素c从线粒体到胞浆的释放增加。
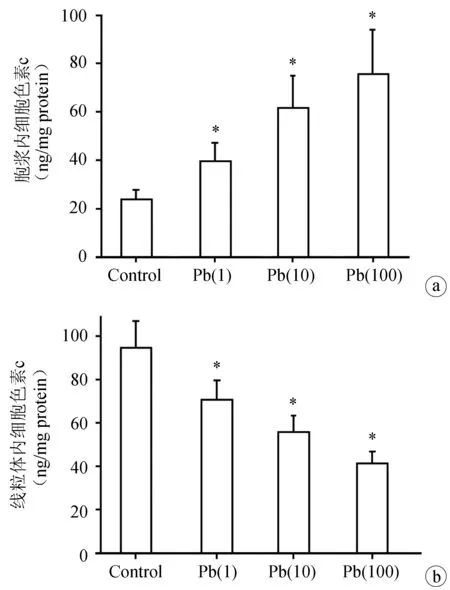
a:胞浆内细胞色素c的含量(n=5);b:线粒体内细胞色素c的含量(n=5) *:与对照组相比,P<0.05
图2铅暴露对线粒体细胞色素c含量的影响
2.3 铅暴露对线粒体形态及Caspase-3活性的影响
透射电镜结果显示,MC3T3-E1细胞暴露于100 μmol/L醋酸铅溶液[Pb(100)]24 h后,与对照组相比,线粒体明显肿胀,细胞核边集,细胞出现凋亡,见图3。
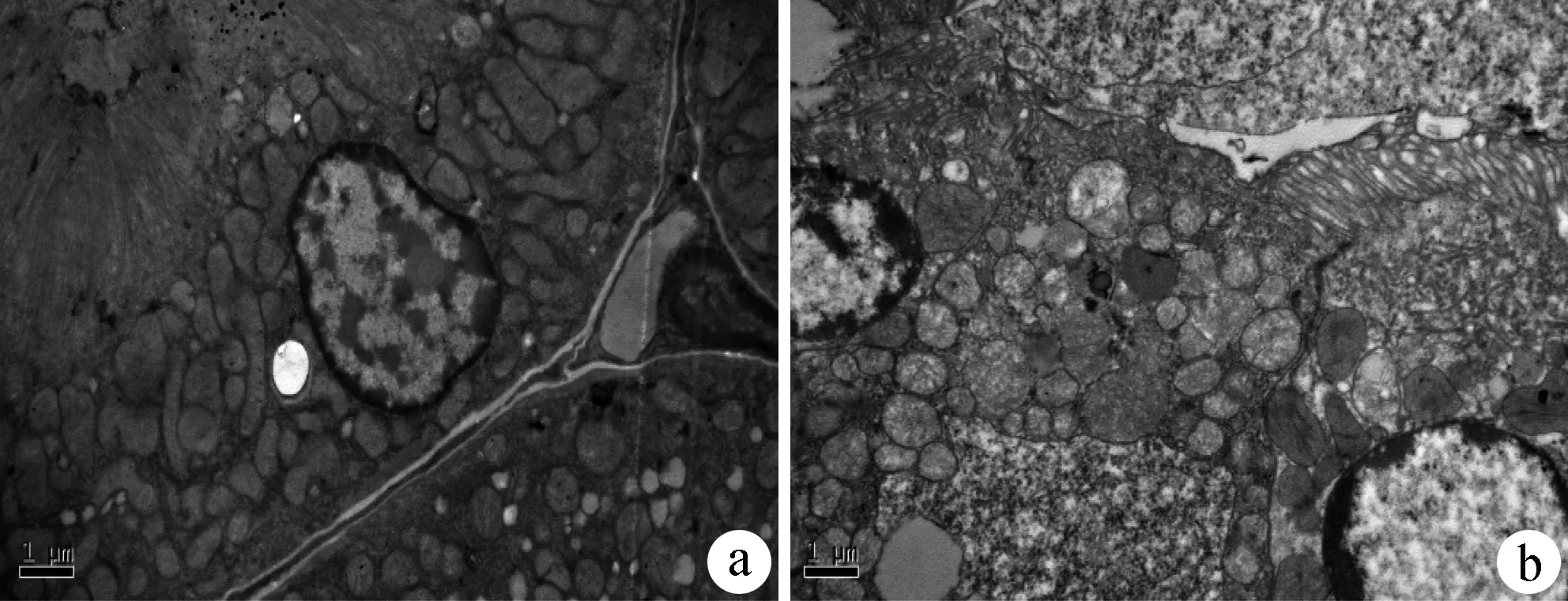
图3 铅暴露对细胞线粒体形态的影响
利用对应试剂盒(碧云天)进行Caspase-3活性测量结果显示,MC3T3-E1细胞暴露于各浓度醋酸铅溶液24 h后,与对照组相比,各暴露组[Pb(1),Pb(10),Pb(100)]的Caspase-3活性显著上升,差异有统计学意义(P<0.05),且表现出明显的剂量依赖性,说明铅暴露24 h后引起MC3T3-E1细胞凋亡增加,且随着剂量的增大,凋亡程度增加,见图4。
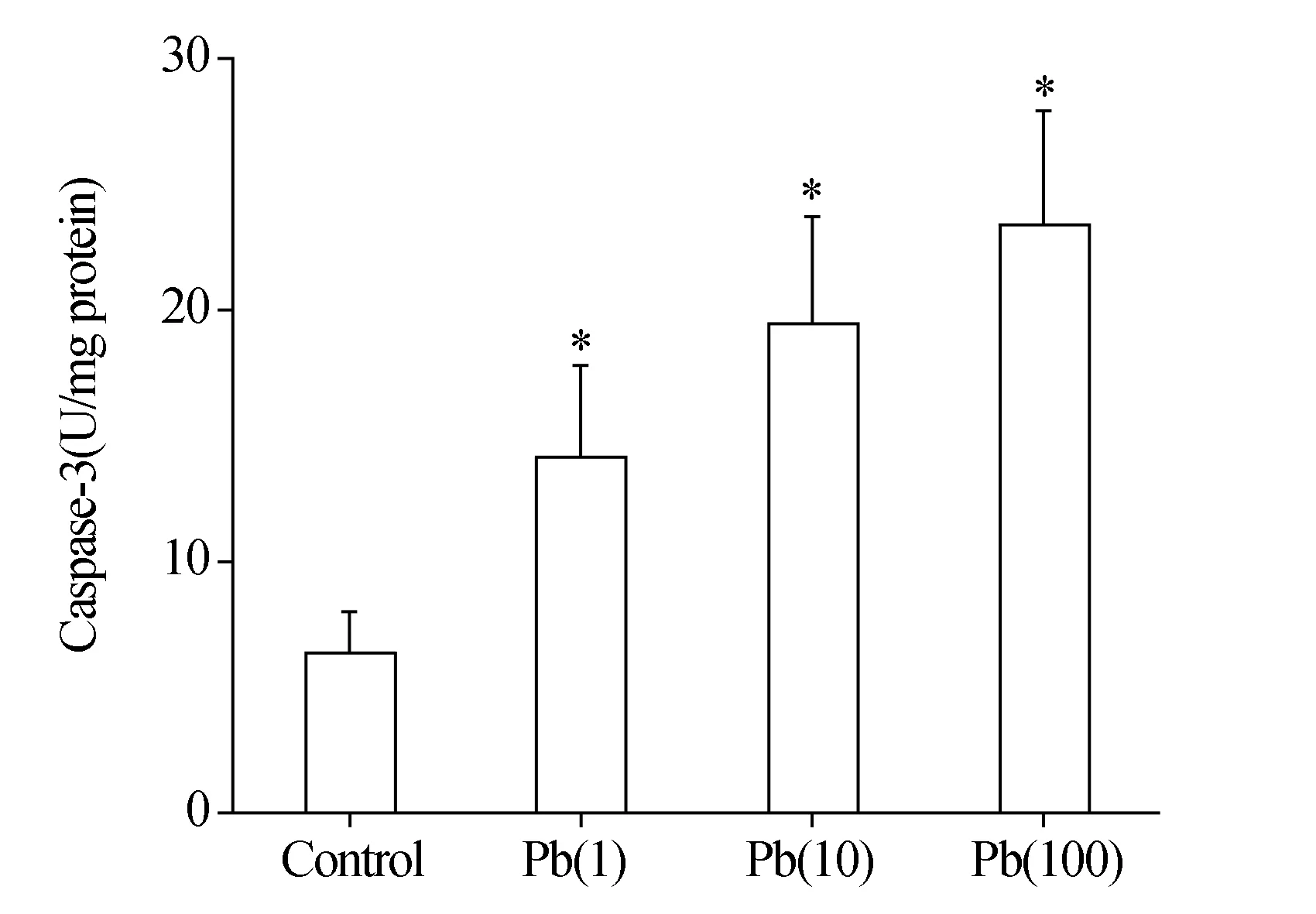
*:与对照组相比,P<0.05
3 讨论
铅是一种广泛应用于工业与生活的的重金属毒物,铅暴露对骨骼的毒性一直以来没有得到确切的证实。近年来,越来越多的研究显示,骨骼也是铅发挥其毒性作用的重要靶器官,铅暴露可直接地或间接地改变骨骼各细胞功能[8-9]。目前,一般认为细胞凋亡途径主要包括线粒体介导的细胞内途径、死亡受体介导的细胞外途径以及内质网应激途径。有研究认为,铅可通过激活c-JUN氨基末端活化蛋白激酶(JNK)信号通路与磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路诱导大鼠肝内内质网应激和氧化应激,也可引起星形胶质细胞发生内质网应激[10-12];铅暴露可引起PC12细胞发生凋亡,其凋亡机制可能与死亡受体介导的细胞外途径有关;关于造血干细胞和睾丸支持细胞的研究则证明了醋酸铅暴露可导致线粒体的结构与功能损伤,表明铅具有明显的线粒体毒性[13]。但在成骨细胞上,铅暴露引起线粒体损伤从而导致细胞凋亡的研究鲜有报道。
线粒体作为细胞能量与代谢的中心,控制着细胞内呼吸链和氧化磷酸化,也在细胞凋亡与信号转导的过程中发挥着重要的作用。许多关于细胞凋亡调控机制的研究认为,线粒体的结构与功能障碍是多种刺激因素诱导细胞发生凋亡的关键事件,线粒体内的凋亡诱发因子因此释放,从而对细胞凋亡进行调控[14]。本研究通过研究MC3T3-E1细胞暴露于各浓度醋酸铅溶液后线粒体相关功能及细胞状态的变化,进一步在细胞水平上证实了铅暴露对成骨细胞的毒性。后续通过测量线粒体膜电位去极化程度与ATP合成量,胞浆与线粒体内细胞色素c含量以及Caspase-3活性,并结合透射电镜观察细胞线粒体形态变化,探究了铅对成骨细胞损伤的一种可能机制。
本研究通过线粒体膜电位与ATP合成量检测证明了铅暴露可致成骨细胞MC3T3-E1线粒体膜电位降低,ATP合成减少。线粒体作为细胞凋亡的控制中心,线粒体功能障碍可诱导细胞凋亡级联反应的发生。大量研究表明,线粒体膜的去极化是细胞凋亡早期的重要事件[15-16]。线粒体膜上的凋亡相关蛋白通过控制线粒体膜的通透性,从而可以调控线粒体内的促凋亡因子如细胞色素c等的释放,进而可通过激活Caspase途径诱导细胞凋亡。本研究通过测得胞浆内细胞色素c的含量显著上升而线粒体内细胞色素c的含量显著下降,证明细胞内细胞色素c从线粒体到胞浆的释放增加。线粒体跨膜电位的去极化、ATP合成减少、线粒体肿胀及线粒体内膜的嵴减少或消失都会诱导细胞色素c以及相关凋亡因子从线粒体释放至细胞浆,本研究的超微病理结果显示,高浓度铅暴露组线粒体出现明显肿胀,也进一步证明了此结论。目前的研究普遍认为,细胞色素c是线粒体在细胞凋亡过程中释放的重要凋亡因子,线粒体释放到膜外的细胞色素c,在ATP/dATP的参与下可以和Apaf-1结合,从而使Apaf-1的构象发生改变,继而使Apaf-1寡聚化[17];Apaf-1氨基端和Caspase-9前体结合,可形成分子量为700~1 400 kD的“凋亡小体”,并在胞浆中的dATP的作用下进一步使Caspase-9复合体发生自发激活。活化后的Caspase-9能继续激活作为细胞凋亡执行者的Caspase-3,Caspase-3进而通过级联反应,裂解特异性底物从而导致细胞凋亡。Caspase-3执行细胞凋亡信号,介导执行触发细胞凋亡的多种因素。同时,Caspase-3与细胞凋亡时的一些特征标志,如DNA的片段化以及染色体凝聚等,也有着直接的关系[18]。本研究中测得的Caspase-3活性结果也证实了暴露组线粒体损伤更为严重,细胞色素c释放量更多,进而Caspase-3活性更高,从而导致细胞凋亡程度更为严重。
综上所述,本研究探究了铅暴露导致成骨细胞凋亡的一种可能机制——铅暴露可导致成骨细胞线粒体膜电位降低、ATP合成减少,导致细胞色素c释放量增加,Caspase-3活性增加,进而诱导细胞凋亡。
[参考文献]
[1] 何剪太,朱轩仪,巫放明,等.铅中毒和驱铅药物的研究进展[J].中国现代医学杂志,2017,27(14):53-57.doi:10.3969/j.issn.1005-8982.2017.14.011.
[2] 郝称莉,孟 静,王 洋,等.钙对染铅大鼠骨骼损伤的保护机制[J].营养学报,2016,38(6):572-574.doi:10.3969/j.issn.0512-7955.2016.06.014.
[3] Chen X,Wang Z,Duan N,et al.Osteoblast-osteoclast interactions[J].Connect Tissue Res,2018,59(2):99-107.doi:10.1080/03008207.2017.1290085.
[4] 王秉义,潘 剑.丹参素拮抗氧化应激所致骨质疏松并通过PI3k/Akt通路减少成骨细胞的凋亡[J].中国骨质疏松杂志,2017,23(1):1-5.doi:10.3969/j.issn.1006-7108.2017.01.001.
[5] Steiner JL,Lang CH.Etiology of alcoholic cardiomyopathy:mitochondria,oxidative stress and apoptosis[J].Int J Biochem Cell Biol,2017,89:125-135.doi:10.1016/j.biocel.2017.06.009.
[6] Jong CJ,Ito T,Prentice H,et al.Role of mitochondria and endoplasmic reticulum in taurine-deficiency-mediated apoptosis[J].Nutrients,2017,9(8):E795.doi:10.3390/nu9080795.
[7] Iuliis GND,Baker MA,Jobling MS,et al.Oxidative stress and male reproductive health[J].Asian J Androl,2014,16(1):31-38.doi:10.4103/1008-682x.122203.
[8] Banijamali M,Rabbani-Chadegani A,Shahhoseini M.Lithium attenuates lead induced toxicity on mouse non-adherent bone marrow cells[J].J Trace Elem Med Biol,2016,36:7-15.doi:10.1016/j.jtemb.2016.03.008.
[9] Conti MI,Bozzini C,Facorro GB,et al.Lead bone toxicity in growing rats exposed to chronic intermittent hypoxia[J].Bull Environ Contam Toxicol,2012, 89(4):693-698.doi:10.1007/s00128-012-0753-1.
[10] Huang C,Lai C,Xu P,et al.Lead-induced oxidative stress and antioxidant response provide insight into the tolerance of phanerochaete chrysosporium to lead exposure[J].Chemosphere,2017,187:70-77.doi:10.1016/j.chemosphere.2017.08.104.
[11] Liu CM,Zheng GH,Ming QL,et al.Protective effect of quercetin on lead-induced oxidative stress and endoplasmic reticulum stress in rat liver via the IRE1/JNK and PI3K/Akt pathway[J].Free Radic Res,2013,47(3):192-201.doi:10.3109/10715762.2012.760198.
[12] 王超云,胡春卉,郭怀兰.Fas/FasL信号通路在铅暴露致PC12细胞凋亡中的作用[J].中国热带医学,2017,17(2):114-117.doi:10.13604/j.cnki.46-1064/r.2017.02.02.
[13] Liu J,Jia DY,Cai SZ,et al.Mitochondria defects are involved in lead-acetate-induced adult hematopoietic stem cell decline[J].Toxicol Lett,2015,235(1):37-44.doi:10.1016/j.toxlet.2015.03.007.
[14] Xu F,Ren L,Song M,et al.Fas- and mitochondria-mediated signaling pathway involved in osteoblast apoptosis induced by AlCl3[J].Biol Trace Elem Res,2017.doi:10.1007/s12011-017-1176-y.
[15] 高健美,李海波.菟丝子通过线粒体通路抗叔丁基过氧化氢诱导的MC3T3-E1细胞凋亡[J].中药药理与临床,2014,30(5):89-92.doi:10.13412/j.cnki.zyyl.2014.05.029.
[16] Schweikl H,Petzel C,Bolay C,et al.2-Hydroxyethyl methacrylate-induced apoptosis through the ATM- and p53-dependent intrinsic mitochondrial pathway[J].Biomaterials,2014,35(9):2890-2904.doi:10.1016/j.biomaterials.2013.12.044.
[17] Saikia M,Jobava R,Parisien M,et al.Angiogenin-cleaved tRNA halves interact with cytochrome c, protecting cells from apoptosis during osmotic stress[J].MolCell Biol,2014,34(13):2450-2463.doi:10.1128/mcb.00136-14.
[18] Wang X,Luo Y,Sun H,et al.Dynamic expression changes of Bcl-2,Caspase-3 and Hsp70 in middle cerebral artery occlusion rats[J].Brain Injury,2015,29(1):93-97.doi:10.3109/02699052.2014.945958.

