莱州湾扇贝养殖区表层沉积物质量评价
杨俊丽,吴 雪,李希磊,崔龙波
( 烟台大学 生命科学学院,山东 烟台 264005 )
莱州湾位于渤海南部,山东半岛西北部,面积69 000 km2,是黄、渤海渔业生物的主要产卵场、栖息地和传统渔场[1]。由于黄河、小清河等众多河流的注入,以及莱州湾沿岸城市化、工业化和农业的快速发展,导致大量陆源污染物输入莱州湾,再加上扇贝养殖过程中产生的自我污染,使得莱州湾扇贝养殖区的环境污染问题日益突出[2]。沉积物作为氮、磷、碳等生源要素重要的“源”与“汇”,沉积物内源的释放对污染水体的修复具有一定的抑制作用,从而使环境污染问题进一步恶化[3],因此,对沉积物中氮、磷、碳等生源要素的研究具有重要意义。此外,异养细菌作为海洋生态环境的重要分解者,其含量的变化对海洋生态环境的物质循环起着重要作用。弧菌(Vibrio)作为扇贝、鱼、虾等海洋生物的主要致病菌之一,同样也是海洋(特别是养殖区)生态环境研究不可缺少的一部分。而近年来,对莱州湾表层沉积物的研究较多,但多集中在沉积物重金属[4-5],对总磷、总氮、总有机碳以及硫化物等指标研究较少,特别是对该海域养殖区表层沉积物的研究较少。笔者根据莱州湾扇贝养殖区的养殖状况,选择扇贝养殖传统地区莱州市和招远市的4个养殖区,对其表层沉积物pH、氧化还原电位、硫化物、总磷、总氮、总有机碳以及细菌(弧菌和异养细菌)等8个指标进行了检测,分析了不同养殖区各检测指标的异同、月际变化规律以及各指标间的相互关系,并采用有机污染指数法和内梅罗环境质量综合评价法对其进行了评价,以期为扇贝健康养殖提供理论参考。
1 材料与方法
1.1 采样时间与地点
2015年4—11月,每月中旬采样一次,采样地点位于莱州湾东侧的4个传统扇贝养殖区(筏式养殖),分别命名为1#、2#、3#、4#(图1),每个养殖区设置4个平行采样点。1#~4#养殖区平均水深分别为10~12 m、7.5~9 m、7~8 m和12 m,1#养殖区的底质为泥沙底,其余为泥质底。
1.2 样品采集与分析
使用Ekman-Binge/Lenz采泥器(德国HYDRO-BIOS公司)采集表层0~2 cm的沉积物,现场用美国奥立龙便携式分析仪(520M-01A)测定pH及氧化还原电位;取适量沉积物于玻璃瓶中,用于测定总磷、总氮、总有机碳;取适量沉积物于充氮气采样袋中,用于测定硫化物;用灭菌的不锈钢小勺采集沉积物于无菌采样袋中,用于测定异养细菌和弧菌。
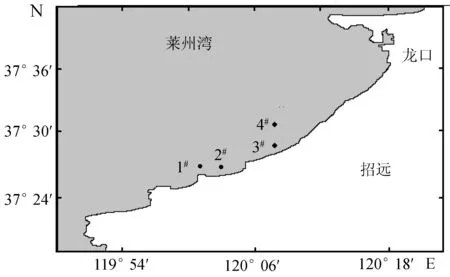
图1 沉积物采样点位置
按照《海洋监测规范》[6]规定的方法进行试验操作与分析。其中总磷的测定采用高氯酸—硫酸消解法(HClO4-H2SO4法),总氮的测定采用凯氏定氮法,总有机碳的测定采用重铬酸钾氧化—还原容量法,硫化物的测定采用亚甲基蓝分光光度法,异养细菌和弧菌的计数采用平板计数法,其采用的培养基分别为2116E海洋细菌培养基和硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂选择培养基。
1.3 评价方法
采用有机污染指数法[7]来衡量扇贝养殖区表层沉积物是否遭受有机污染:
A=MTOC×MON
MON=MTN×95%
式中,A为有机污染指数,MTOC为有机碳的质量分数,MON为有机氮的质量分数,MTN为总氮的质量分数。
评价标准见表1。
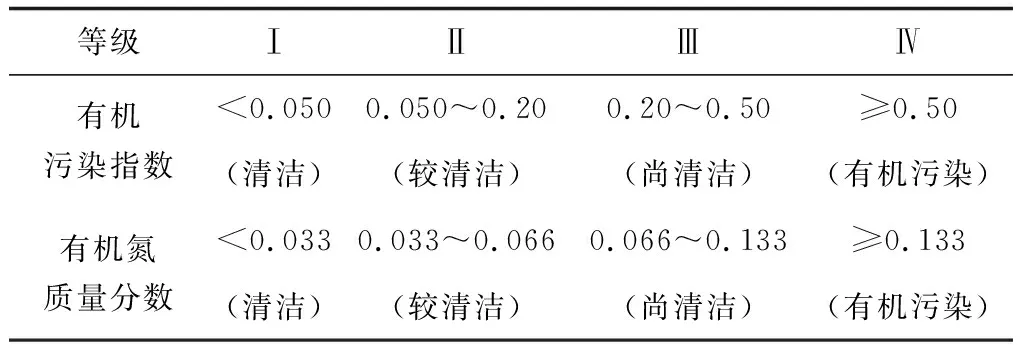
表1 沉积物有机指数评价标准
注:括号内为所属的环境质量类型.
目前,国内外对海洋沉积物环境评价尚缺乏统一的标准。本研究采用内梅罗环境质量综合评价指数[8]对养殖区表层沉积物进行评价(表2):
式中,P为内梅罗综合指数,Pmax为参数中最大的污染指数,Pi为某污染因子的污染指数,Ci为某污染因子的实测含量,Ci0为某污染因子的评价标准(总氮和总磷的Ci0分别选用550、600 mg/kg[9];总有机碳和硫化物的Ci0采用一类海洋沉积物标准,分别为2.0%和300 mg/kg)。
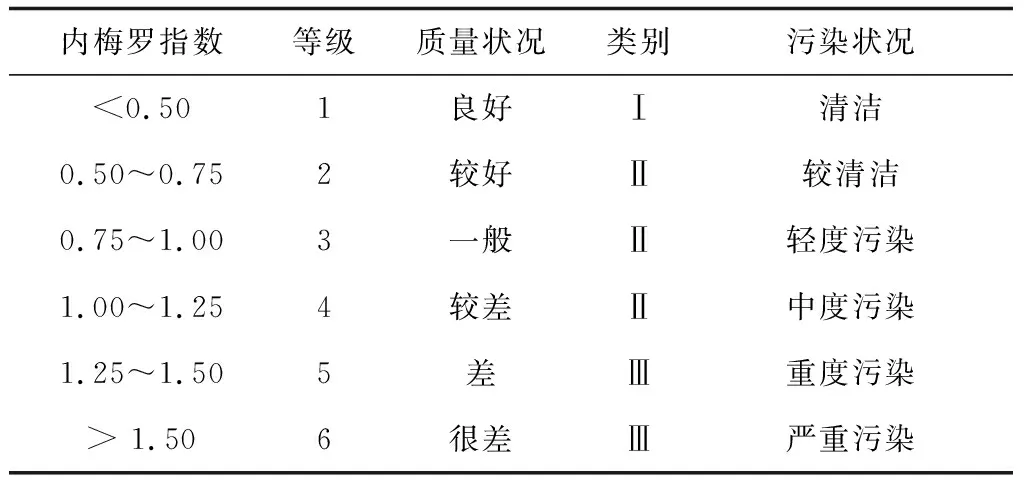
表2 扇贝养殖生态环境质量分级标准
2 结果与分析
2.1 莱州湾扇贝养殖区沉积物各种指标的含量及其变化
2.1.1 pH和氧化还原电位
4—11月1#~4#养殖区表层沉积物的pH变化分别为7.54~8.30、7.17~7.97、7.29~7.56和7.28~7.59(图2),总体呈中性—弱碱性,氧化还原电位的变化分别为-287.10~-170.30、-360.90~-296.90、-368.30~-319.20 mV和-363.50~-326.20 mV(图3),根据Chien[10]的判定标准,4个养殖区的底泥均处于高度还原态。其中1#养殖区表层沉积物的pH和氧化还原电位明显高于其他3个养殖区,且变化幅度较大。
2.1.2 总氮、总磷和总有机碳
4—11月1#~4#养殖区表层沉积物中总氮的变化分别为0.038~0.897、0.079~0.706、0.103~0.716 mg/g和0.055~0.776 mg/g(图4),均表现出明显的季节差异性,其中8月和9月含量最高,为0.605~0.897 mg/g。此外,2#养殖区总氮含量的变化幅度较其他3个养殖区略小,该养殖区为贝参混养,而其他3个养殖区只养殖了扇贝,刺参的养殖或许会对贝类养殖的排泄物具有一定吸收作用。相比总氮的变化,总磷无明显的季节差异性,但养殖区之间差异较大,含量变化分别为0.130~0.340、0.236~0.401、0.300~0.496 mg/g和0.340~0.554 mg/g(图5)。4个养殖区沉积物中总有机碳变化分别为0.029%~0.201%、0.079%~0.445%、0.085%~0.264%和0.054%~0.530%(图6),呈现随着月份逐渐增加的趋势,但不明显。

图2 pH月份变化趋势

图3 氧化还原电位月份变化趋势
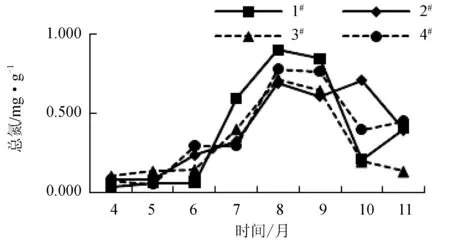
图4 总氮月份变化趋势

图5 总磷月份变化趋势
2.1.3 硫化物
4—11月1#~4#养殖区表层沉积物的硫化物变化分别为4.43~49.54、1.66~168.97、8.61~129.60 mg/kg和7.56~184.11 mg/kg(图7),均低于沉积物二类标准(300 mg/kg),适用于海水养殖[11]。除1#养殖区硫化物含量较低且较稳定之外,其他3个养殖区呈现明显的季节变化,且9月含量最高。

图6 总有机碳月份变化趋势
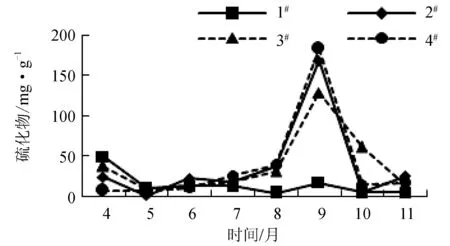
图7 硫化物月份变化趋势
2.1.4 异养细菌和弧菌
4—11月1#~4#养殖区表层沉积物中异养细菌数量的变化分别为1.43×103~1.25×104、6.67×102~1.55×104、3.00×102~8.20×104cfu/g和1.63×103~5.40×104cfu/g(湿质量,图8)。3#和4#养殖区在4—10月异养细菌的数量与1#、2#养殖区相近且数量较稳定,但到11月数量骤然增加到原来的5~6倍。
4个养殖区表层沉积物中弧菌数量的变化分别为0.50~1.64×103、1.85×101~1.99×103、0.50~3.90×103cfu/g和0.50~2.30×103cfu/g(湿质量,图9)。在4月和5月4个养殖区弧菌数量极少或未检出,而6月3#和4#养殖区、7月1#和2#养殖区弧菌数量出现最高值,表明6月或7月可能是弧菌的繁殖季节。
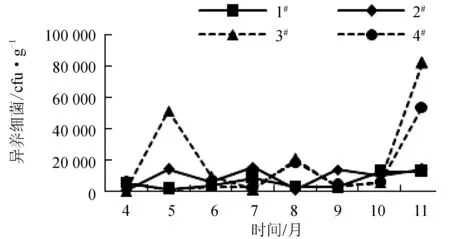
图8 异养细菌月份变化趋势
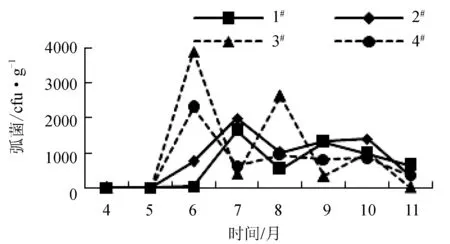
图9 弧菌月份变化趋势
2.2 表层沉积物碳-氮-磷耦合研究
总有机碳与总氮的比值在某种程度上可以反映有机质的来源,一般水生生物为2.8~3.4,藻类为5~14,高等植物为14~23[6]。1#~4#养殖区总有机碳与总氮的比值表现出明显的季节差异性,7—9月总有机碳与总氮的比值较小,为1.85~6.33,表明沉积物有机质主要来源于水生生物,而其他月份主要来源于藻类(表3)。
沉积物中总氮和总磷含量及其比值通常是沉积物溶出、释放及水中总氮和总磷聚集、沉积两种动态过程的综合反映[12],总氮与总磷的比值在某种程度上还能反映海洋的富营养化状态。由表3可见,1#~4#养殖区表层沉积物总氮与总磷的比值在7—9月明显偏高,特别是1#养殖区,但与一些发生富营养化养殖区的总氮与总磷的比值(数值)相比,仍略为偏低,表明这些养殖区营养程度较低,赤潮发生的可能性也较低。
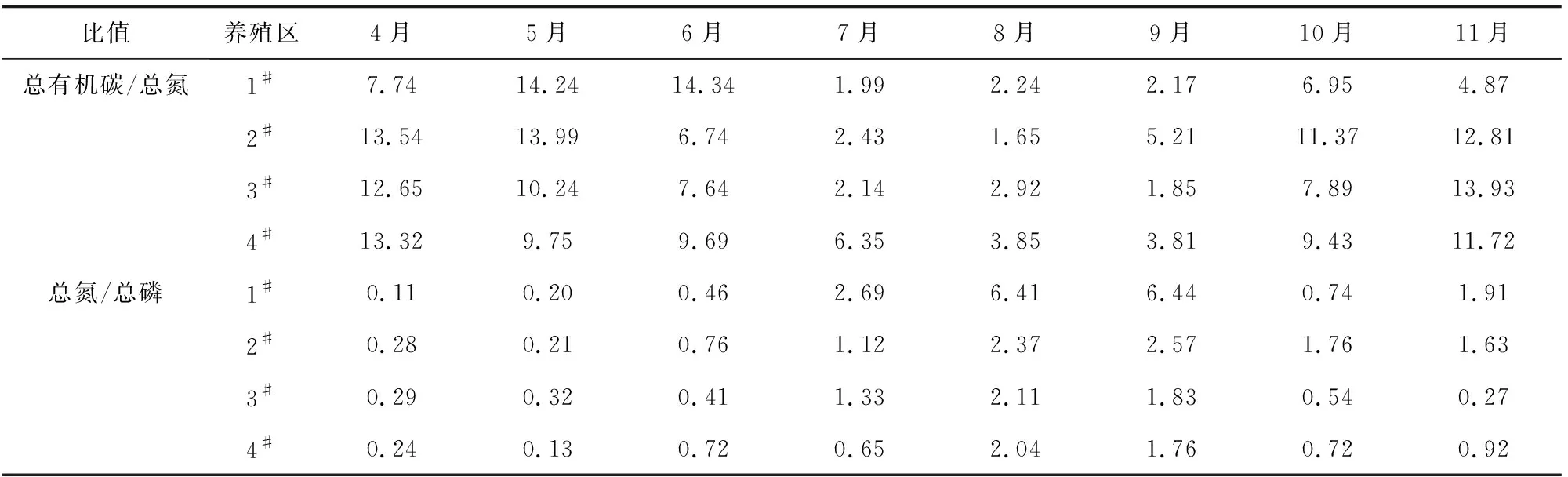
表3 沉积物的总有机碳/总氮和总氮/总磷
2.3 表层沉积物有机污染评价
采用有机污染指数法对4个扇贝养殖区表层沉积物有机污染状况进行评价(表4),根据沉积物有机指数评价标准(表1)和表4中的数据作出判断:(1)4个养殖区中表层沉积物的有机污染指数均低于0.05,均属于标准Ⅰ级,处于清洁状态;(2)相比有机指数来说,有机氮污染值得注意,除了4月、5月和6月处于清洁状态之外,4个养殖区在其他月均表现出不同程度的有机氮干扰,其中8月和9月最严重,尽管尚未达到有机污染水平;4个养殖区受有机氮的污染程度依次为1#>4#>3#>2#。

表4 莱州湾扇贝养殖区沉积物有机污染评价
2.4 表层沉积物综合质量评价
采用内梅罗环境质量综合评价指数法对莱州湾扇贝养殖区表层沉积物进行评价,其各评价因子污染指数和表层沉积物综合质量指数见表5。由表5可知,1#~4#养殖区表层沉积物中的硫化物、总有机碳和总磷在4—11月的标准指数均<1,符合一类沉积物质量标准,表明这4个养殖区沉积物未受到这3种评价因子的污染。然而4个养殖区沉积物中的总氮污染状况不容乐观,如1#养殖区在7—9月、2#养殖区在8—10月以及3#和4#养殖区在8月和9月总氮的标准指数均>1,表明这4个养殖区在这些月中受到总氮不同程度的污染。不同扇贝养殖区在同一时间以及同一养殖区在不同时间的沉积物综合质量差异较明显,其中4—6月综合质量较好,大部分为1级,处于良好水平,而7—10月大部分处于3~4级,达到轻度污染甚至中度污染水平。总体来看,莱州湾扇贝养殖区表层沉积物质量基本上符合扇贝养殖环境Ⅰ类区或Ⅱ类区的要求(表2),适合用于扇贝养殖。然而,要注意7—10月对这些养殖区的保护,特别注意氮元素的输入。
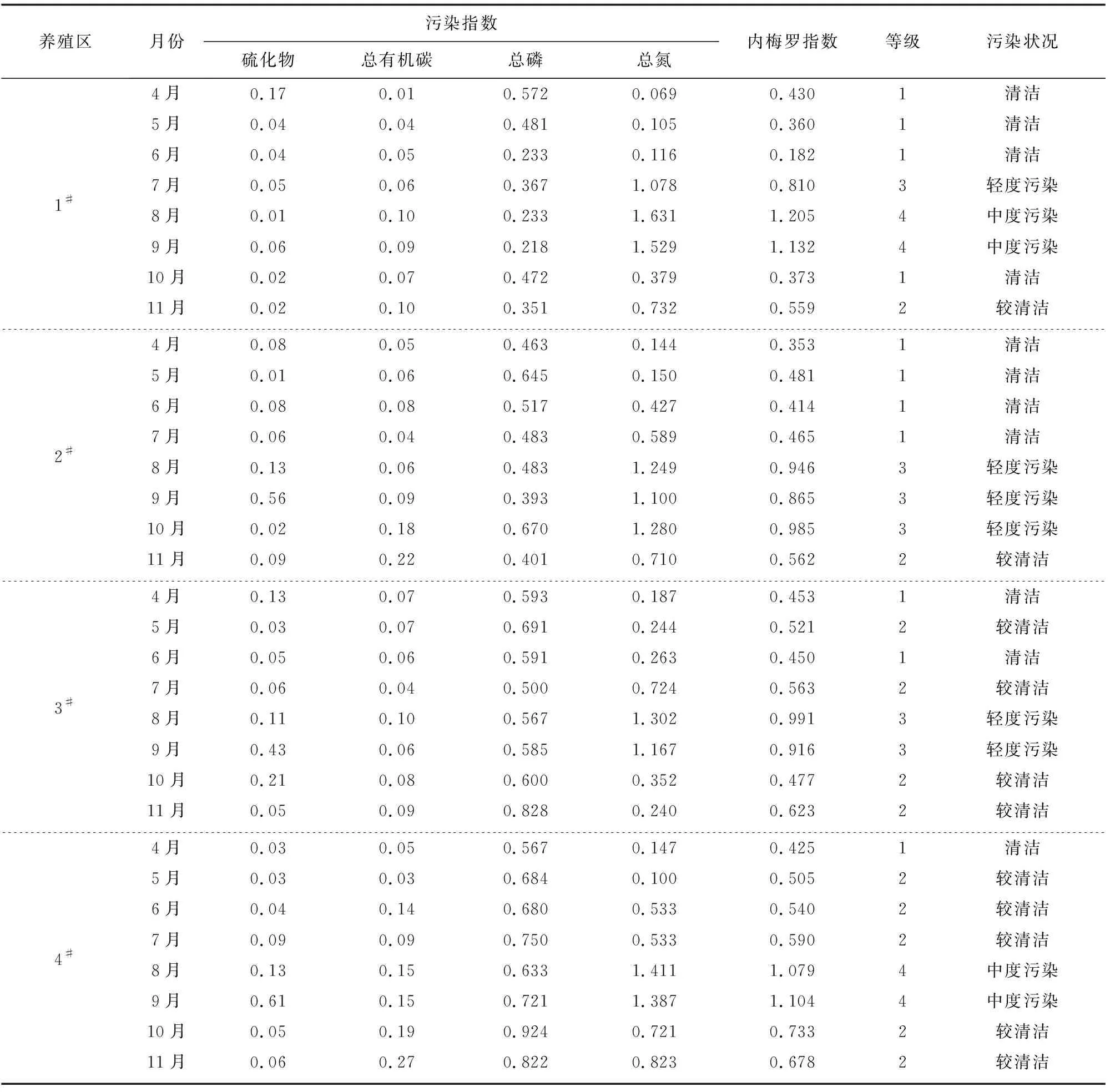
表5 莱州湾扇贝养殖区表层沉积物各评价因子污染指数和综合质量指数
3 讨 论
3.1 扇贝养殖区沉积物pH和氧化还原电位的特点
pH和氧化还原电位是反映沉积物环境良好与否的重要指标,它们直接影响着沉积物(及孔隙水)中元素的地球化学行为、自生矿物的形成和转化以及成岩作用进程等[13]。本研究表明,莱州湾不同扇贝养殖区的pH和氧化还原电位的变化分别为7.33~8.30 mV和-368.30~-170.30 mV,呈中性—弱碱性,处于高度还原态,且1#养殖区表层沉积物的pH和氧化还原电位明显高于其他3个养殖区,且变化幅度较大,说明pH和氧化还原电位的大小与底质类型有关。相比青岛及周边海区[14],莱州湾扇贝养殖区的电位值总体表现较低。刘冉等[15]对仿刺参(Apostichopusjaponicus)池塘的研究表明,底泥长期处于还原化状态,会促进还原性细菌的生长,加速水中氧气的消耗,增加还原性物质的积累,转而进一步降低底泥氧化还原电位,形成恶性循环,影响仿刺参的生长。本研究区域为浅海筏式扇贝养殖区,扇贝生长在离海底较远水层,加之海洋比池塘的流通性大,且自身具有调节功能,所以扇贝的生长受氧化还原电位的影响较小。
3.2 扇贝养殖区沉积物总氮、总磷和总有机碳的特点
海洋沉积物是营养物质积累和间歇性再生的重要场所,沉积物营养物质中总氮、总磷和总有机碳可通过与上覆水间的相互作用实现在沉积物—海水之间的转换,所以沉积物中总氮和总磷的含量在一定程度上可以反映水体的富营养化程度[6]。本研究结果表明,4个养殖区表层沉积物中总氮、总磷和总有机碳含量在4—11月的变化分别为0.038~0.897 mg/g、0.131~0.554 mg/g和0.029%~0.560%,其中总氮含量在7—9月最高,具有明显的季节性,主要可能与该时期浮游生物繁殖与消亡旺盛、氮的释放增加有关,总磷整体变化不大,而总有机碳呈逐渐增加趋势,可能与扇贝养殖过程中产生的生物沉淀有着密切的关系。相比天津环渤海海域表层沉积物含量(总氮为0.7~1.5 mg/g,总磷为0.7~1.0 mg/g)[16],该研究海域的总氮和总磷的含量处于较高水平,而与莱州湾表层沉积物含量[总氮为(0.3±0.2) mg/g,总有机碳为(0.24±0.17)%][17]相当。
3.3 扇贝养殖区沉积物硫化物的特点
硫化物含量的高低是衡量海洋底质环境优劣的一项重要指标。在厌氧环境及硫酸盐还原菌的作用下,会加速沉积物中硫化物的生成,同时产生大量的硫化氢,而硫化氢的溶解又会进一步消耗海水中的溶解氧,使环境更加恶化,进而直接或间接影响扇贝的生存和生长[18]。有研究表明,当硫化物含量达到400~1500 mg/kg时,耗氧速率达到最大,而大于1700 mg/kg,沉积物环境基本处于无生物状态[19]。本试验结果表明,4个养殖区表层沉积物中硫化物的含量变化为1.66~184.11 mg/kg,1#养殖区含量较其他3个养殖区稳定,说明硫化物含量受底质类型的影响,另外2#~4#养殖区在8月和9月含量较高,而此时海水温度也较其他月份高,符合温度越高、硫化物形成速度越快的特点,与杨庆宵等[11]的研究较一致。
3.4 扇贝养殖区沉积物异养细菌和弧菌的特点
异养细菌能分解有机质,对海洋沉积物的矿化以及水域环境的改善起着至关重要的作用,其含量的多少在一定程度上可以反映海洋环境的污染程度。弧菌是鱼类、扇贝等海洋生物的条件性致病菌,对我国扇贝养殖造成了巨大的损失。本研究结果表明,4个养殖区表层沉积物中异养细菌和弧菌数量变化分别为3.0×102~8.2×104cfu/g(湿质量)和0.5×103~7.9×103cfu/g(湿质量),明显低于象山港大黄鱼(Pseudosciaenacrocea)网箱养殖区[21]和粤东深澳湾养殖区[22]的含量,整体处于较低水平,并未对扇贝养殖造成危害,但应注意6月和7月对弧菌数量的监测,防止弧菌的大量繁殖,减少弧菌病产生的几率。
4 结 论
(1)4个养殖区表层沉积物整体呈中性—弱碱性,属于高度还原态;硫化物含量波动较大,但均在扇贝养殖环境安全范围内,其数值的大小受温度的影响较大;异养细菌和弧菌数量相比其他海域的养殖区,均处于较低水平,对贝类养殖的危害均较小,但应注意6月和7月对弧菌的检测;总磷和总有机碳的含量均在扇贝养殖安全范围之内,而总氮在7—10月出现不同程度的超标现象,应特别注意扇贝养殖期间对氮元素的输入。
(2)有机污染评价表明,4个养殖区中表层沉积物处于清洁状态,虽在7—10月受到有机氮沾污,但未达到污染状态。
(3)表层沉积物综合质量评价表明,虽然1#和4#养殖区在8月和9月达到中度污染水平,但总体均符合贝类养殖环境1类区或2类区的要求,总体环境质量良好。
[1] 邓景耀,金显仕.莱州湾及黄河口水域渔业生物多样性及其保护研究[J].动物学研究,2000,21(1):76-82.
[2] 张龙军,夏斌,桂祖胜,等.2005年夏季环渤海16条主要入海河流的污染状况[J].环境科学,2007,28(11):2409-2415.
[3] 褚瑶瑶,张艳,崔正国,等.威海近海人工鱼礁区沉积环境要素的时空分布与沉积物质量评价[J].中国农学通报,2016,32(2):99-105.
[4] 陈江麟, 刘文新, 刘书臻, 等. 渤海表层沉积物重金属污染评价[J]. 海洋科学, 2004, 28(1):16-21.
[5] 刘峰, 王海亭, 王德利. 莱州湾滨海湿地沉积物重金属的空间分布[J]. 海洋科学进展, 2004, 22(4):486-492.
[6] 中华人民共和国国家质量监督检验检疫总局.GB 17378—2007,海洋监测规范[S].北京:中国标准出版社,2007.
[7] 易文利.渭河宝鸡段表层沉积物营养盐分布特征及污染评价[J].河南科学,2014,32(4):616-619.
[8] 崔力拓.河北省海域扇贝养殖区生态环境质量评价研究[J].安徽农业科学,2011,39(10):6004-6006,6010.
[9] 第二次全国海洋污染基线调查领导小组办公室. 第二次全国海洋污染基线调查技术规程[M].北京:海洋出版社,1997.
[10] Chien Y H. Study on the sediment chemistry of tiger prawn, kuruma prawn, and red tail prawn ponds in I-Lan Hsien[J]. Council of Agriculture Fisheries Series, 1989(6):257-275.
[11] 国家质量监督检验检疫总局.GB 18668—2002,海洋沉积物质量[S].北京:中国标准出版社,2002.
[12] 杨丽原,土晓军,刘恩峰.南四湖表层沉积物营养元素分布特征[J].海洋湖沼通报,2007(2):40-44.
[13] 中国科学院地球化学研究所.高等地球化学[M].北京:科学出版社,1998:300-301.
[14] 王江涛,齐红菊,李宁,等.青岛及周边海区沉积物的氧化还原环境[J].中国海洋大学学报:自然科学版,2009,39(增刊):184-188.
[15] 刘冉,吴雪,王琛,等.3种仿刺参养殖池塘底质特性的研究[J].水产科学,2017,36(1):29-35.
[16] 李任伟, 李原. 渤海沿岸环境沉积调查:As、重金属、氮和磷污染[J]. 沉积学报, 2008, 26(1):128-138.
[17] 张明亮, 姜美洁, 付翔, 等. 莱州湾沉积物有机质来源[J]. 海洋与湖泊, 2014, 45(4):741-746.
[18] 陈皓文.海洋硫酸盐还原菌及其活动的经济重要性[J].黄渤海海洋,1998,16(4):64-74.
[19] 肖兰芳.中国南海资源的开发及存在问题[M].广州:广东经济出版社,1998:451-461.
[20] 杨庆宵,蒋岳文,张昕阳.虾塘残饵腐解对养殖环境影响的研究[J].海洋环境科学,1999,18(3):11-15.
[21] 廖红芳,郑忠明,冯坚,等.象山港大黄鱼(Pseudosciaenacrocea)网箱养殖区及邻近海域沉积物中异养细菌生态分布[J].海洋与湖沼,2014,45(6):1308-1316.
[22] 杜虹,黄显兵,郑兵,等.粤东深澳湾养殖区域异养细菌和弧菌的动态分布[J].热带海洋学报,2010,29(6):110-117.

