罗氏沼虾致病性溶藻弧菌的鉴定及药敏分析
苗鹏飞,杨 映,谭淑雯,陈言峰,彭钟琴,吴勇亮,于 辉
( 佛山科学技术学院 生命科学与工程学院,广东 佛山 528231 )
罗氏沼虾(Macrobrachiumrosenbergii)亦称马来西亚大虾、金钱虾、淡水长臂大虾、万氏对虾等,属长臂虾科、沼虾属,原产地在厄瓜多尔沿岸,是世界上养殖量最高的三大对虾之一[1]。该品种具有生长快、食性广、肉质营养成分好、养殖周期短等优点,是深受养殖户喜爱的养殖品种。自东南亚地区引进我国后,经过30多年的养殖,罗氏沼虾已经成为我国重要的淡水虾类,养殖广泛分布在江苏、广东、上海、福建、广西、浙江等16个省市,养殖面积约3.34×104hm2,年产量逾1.2×105t[2]。随着罗氏沼虾养殖业不断发展,高密度、高换水率的养殖模式严重影响周边的水体环境,破坏了水体生态的平衡,继而导致罗氏沼虾的病害发生[3-4]。细菌是导致罗氏沼虾病害发生的一个主要因素[5],弧菌(Vibrio)、气单胞菌(Aeromonas)和假单胞菌(Pseudomonas)被认为是罗氏沼虾感染细菌性疾病的主要原因[6]。笔者从广东省湛江市某养殖场患病罗氏沼虾体内分离到一株优势菌QY170324,对其进行细菌形态观察、生理生化特征鉴定、16S rDNA序列分析、药敏试验,旨在为罗氏沼虾疾病研究提供理论依据,为罗氏沼虾健康养殖提供一些参考资料。
1 材料与方法
1.1 试验材料
患病幼虾采自广东省湛江市某罗氏沼虾养殖场。症状为患病幼虾行动迟缓、大部分浮于水面、红体等。健康的幼虾取自广东省佛山市某养殖场。
硫代硫酸盐—柠檬酸盐—胆盐—蔗糖弧菌选择性培养基、营养肉汤、营养琼脂、碱性蛋白胨水购于广东环凯微生物科技有限公司;SuperMix、GelStain核酸染料(1000×)、琼脂糖购于北京全式金生物技术有限公司;DNA Maker DL2000购于大连宝生物工程公司;细菌DNA提取试剂盒购于北京艾莱德生物科技有限公司;1%NaCl葡萄糖产气、1%NaCl葡萄糖磷酸盐冻水(V-P)、1%NaCl蛋白胨水、1%NaCl蔗糖、1%NaCl甘露糖、1%NaCl阿拉伯糖、1%NaCl肌醇、1%NaCl赖氨酸脱羧酶、1%NaCl精氨酸双水解酶、无盐胨水、3%NaCl胨水、6%NaCl胨水、8%NaCl胨水、10%NaCl胨水14种生化鉴定管购于广东环凯微生物科技有限公司。
1.2 病原菌的分离、纯化和保存
患病幼虾于无菌状态下匀浆处理后,用接种划线针接种于硫代硫酸盐—柠檬酸盐—胆盐—蔗糖培养基上,28 ℃培养24 h;挑取形态一致、单个优势菌落接种于含3%NaCl的营养肉汤中,28 ℃,200 r/min摇床培养18 h。菌液中加入体积系数为30%的甘油,置于-80 ℃冰箱中保存。
1.3 病原菌的生理、生化鉴定
用硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基培养致病菌,观察其形态、菌落大小。对单个优势菌落进行革兰氏染色,于显微镜下观察。挑取新鲜菌落接种于含3%NaCl的营养肉汤中培养18 h,取70 μL含3%NaCl的营养肉汤培养物依次加入微量生化管中,37 ℃下培养8~48 h,观察结果。
1.4 人工感染试验
试验健康虾为淡化后仔虾,平均体长约为2.0 cm。人工感染试验在20 L水族箱中进行,温度控制在28 ℃,连续充氧。试验组与对照组分别放入20尾仔虾,试验前仔虾在水族箱内暂养一周,无异常情况后开始试验。试验组水体中的细菌密度调至108cfu/mL,对照组不加入菌体。每日正常投喂、换气、吸污换水,并观察记录发病症状及死亡情况。
1.5 菌株16S rDNA基因序列分析及系统发育树的构建
将分离得到的弧菌接种于含3%NaCl的营养肉汤中,28 ℃,200 r/min摇床培养16~18 h,用细菌的通用引物扩增16S rDNA,P1:5′-AGAGTTTGATCCTGGCTCAG-3′,P2:5′-ACGGCTACCTTGTTACGACTT-3′。引物由上海生工生物工程有限公司合成。根据细菌基因组DNA抽提试剂盒的说明书提取分离细菌的DNA。PCR反应体系(50 μL):14 μL 2× Easy Taq Super Mix(含Mg2+、dNTP、DNA聚合酶、buffer), 10 mmol/L正向和反向引物各1 μL,2 μL模板,ddH2O 32 μL。PCR反应条件为:94 ℃预变性5 min,94 ℃ 30 s,55 ℃ 45 s,72 ℃ 90 s,30个循环,72 ℃ 5 min。扩增产物经1%琼脂糖凝胶电泳检测后,送至上海生工生物工程有限公司纯化并测序。将测序所得序列与GenBank中的核酸序列进行Blast分析,选取同源性较高的序列,采用Clustal X 1.83软件进行多重序列比对分析,并通过MEGA 6软件采用邻接法构建系统发育树。
1.6 药敏试验
在无菌环境下,取100 μL分离纯化的新鲜菌液,用无菌涂布棒均匀涂布于含3%NaCl的营养琼脂平板上,用镊子无菌操作将每种药敏片轻轻的贴在上面,28 ℃培养24 h,测量抑菌圈直径。根据美国临床实验室标准化研究所抗菌药物敏感性试验执行标准[7],判定该菌对17种抗生素的敏感程度。
2 结果和分析
2.1 病原形态特征
自罗氏沼虾组织中分离获得1株细菌QY170324,在硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂平板上培养18 h后,呈现为圆形光滑、黄色突起的菌落。在含3%NaCl营养肉汤培养时,菌液呈现均匀浑浊。显微镜下观察为革兰氏阴性菌(图1)。
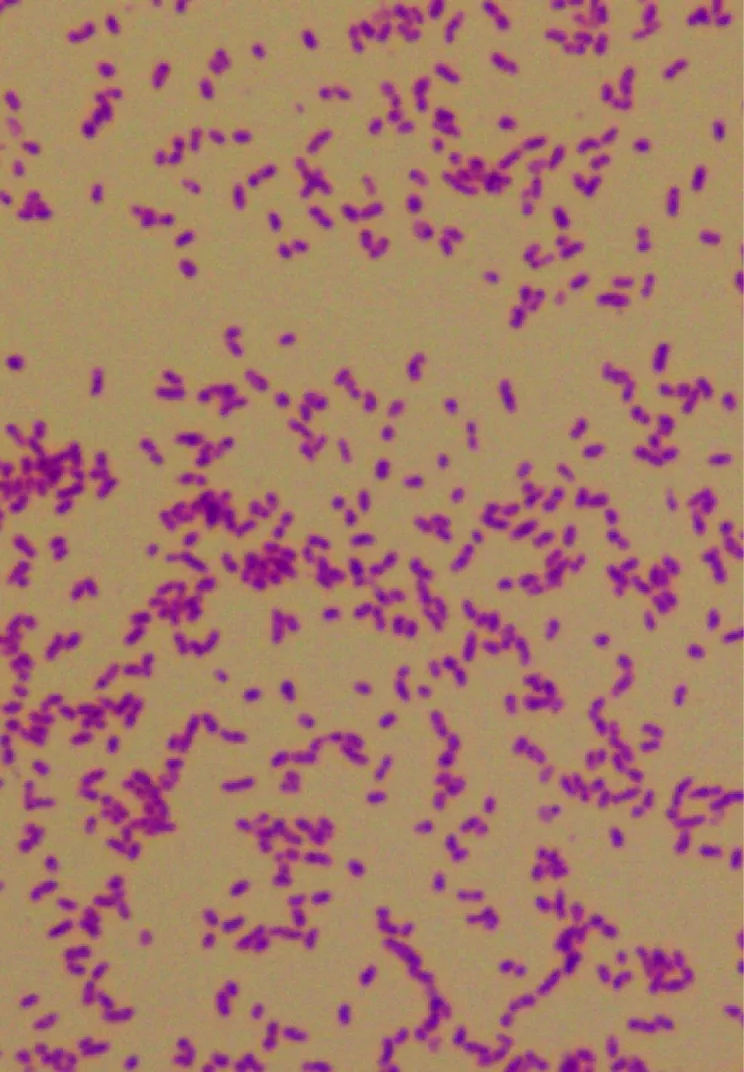
图1 菌株QY170324革兰氏染色结果(1000×)
2.2 病原菌的生理、生化鉴定
由分离菌的生理、生化特性的检测结果可知,该病原菌与溶藻弧菌(V.alginolyticus)极为相似(表1),依据《伯杰氏细菌鉴定手册》,初步鉴定该病原菌为溶藻弧菌。
2.3 人工感染试验
人工感染3 d后,罗氏沼虾开始出现死亡,7 d后全部死亡,病死率达100%。观察期内取感染死亡仔虾匀浆处理后进行细菌分离,并进行革兰氏染色镜检、生化鉴定及分子生物学鉴定,结果显示分离菌特征与原感染菌基本一致,所以初步判断广东省湛江市某养殖场罗氏沼虾发病是由该致病菌所致。

表1 分离菌的生理生化特征
注:“+”表示反应为阳性,“-”为阴性,“d”为结果未定.
2.4 菌株16S rDNA基因序列的鉴定及发育树的构建
将分离菌所扩增的16S rDNA基因序列提交到GenBank,获得序列号为MF187358,Blast比对结果显示,菌株QY170324基因与溶藻弧菌相应基因相似率达99%。所构建的系统发育树见图2,菌株QY170324与溶藻弧菌聚为一支。
2.5 药敏试验
药敏试验结果显示,溶藻弧菌QY170324对庆大霉素、四环素、氧氟沙星、哌拉西林、头孢他啶、复方新诺明等抗生素敏感,对头孢曲松、卡那霉素、新霉素、米诺环素、麦迪霉素、头孢唑林、多黏菌素B中度敏感,对克林霉素、羧苄西林、头孢氨苄耐药(表2)。
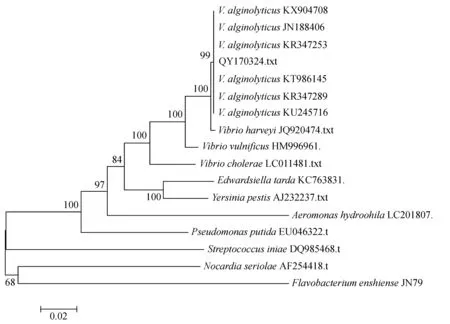
图2 基于16S rDNA序列所构建的系统发育树
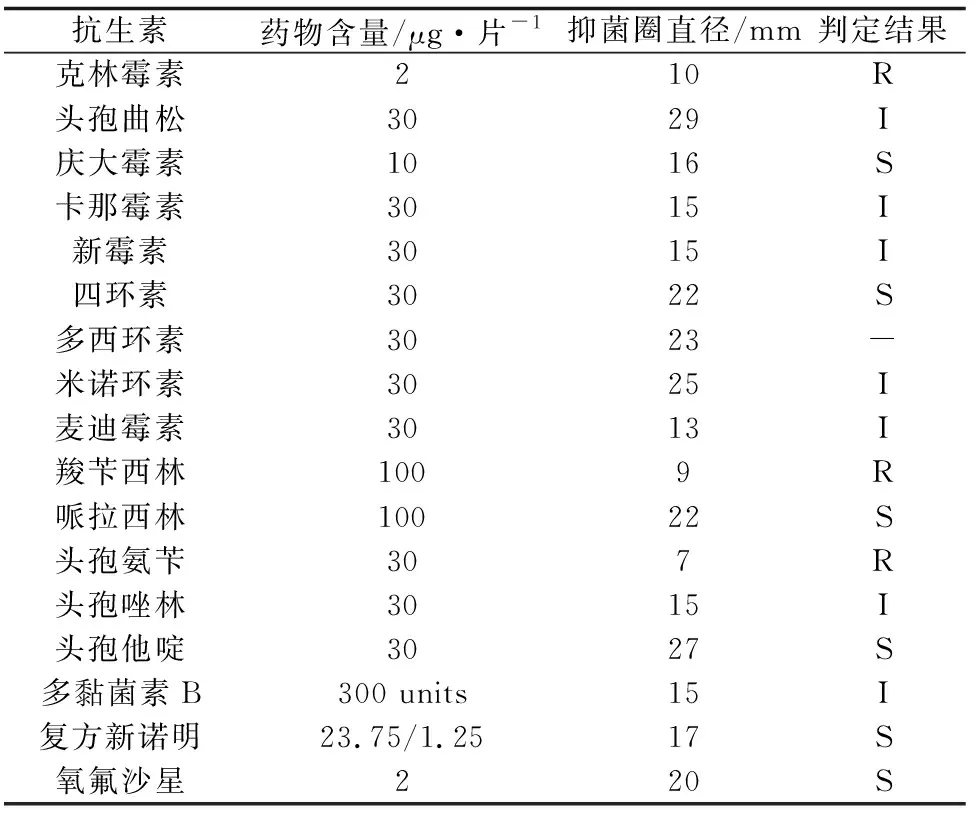
抗生素药物含量/μg·片-1抑菌圈直径/mm判定结果克林霉素210R头孢曲松3029I庆大霉素1016S卡那霉素3015I新霉素3015I四环素3022S多西环素3023-米诺环素3025I麦迪霉素3013I羧苄西林1009R哌拉西林10022S头孢氨苄307R头孢唑林3015I头孢他啶3027S多黏菌素B300 units15I复方新诺明23.75/1.2517S氧氟沙星220S
注:S为高度敏感,I为中度敏感,R为不敏感;-:无对应的参考标准.
3 讨 论
3.1 病原菌的分离鉴定及对罗氏沼虾的致病力
溶藻弧菌属弧菌科、弧菌属,专属性嗜盐,是一类广泛分布于世界范围内的革兰氏阴性菌,在河口处和海水中最多[8]。该菌不仅对水生动物危害大,亦可导致人类的许多疾病,如引起人食物中毒、肠道炎、伤口感染、中耳炎等[9],是重要的食源性病原菌之一。溶藻弧菌能够感染许多水产养殖动物,如紫贻贝(Mytilusgalloprovincialis)[10]、魁蚶(Scapharcabroughtonii)[11]、大黄鱼(Pseudosciaenacrocea)[12-13]、花鲈(Lateolabraxjaponicus)[14]、凡纳滨对虾(Litopenaeusvannamei)[15]、三疣梭子蟹(Portunustrituberculatus)[16]、曼氏无针乌贼(Sepiellamaindroni)[17]等水产动物发病。近几年有学者报道,溶藻弧菌也可以感染半滑舌鳎(Cynoglossussemilaevis)[18],本研究首次报道了在罗氏沼虾养殖过程中溶藻弧菌作为潜在的细菌性病原体也可感染罗氏沼虾导致死亡的案例,说明溶藻弧菌的感染范围在扩大,应引起重视。
本试验在广东省湛江市某养殖场的患病死亡仔虾体内分离得到一株病原菌QY170324,运用分子生物学方法测定16S rDNA基因序列。16S rDNA 基因检测技术目前已成为病原菌检测和鉴定的强有力工具,应用该技术可以实现对病原菌快速、微量和准确的分类鉴定[19]。因此,本研究运用16S rDNA基因、同时结合生理生化试验及回归感染试验,综合判定导致罗氏沼虾死亡的致病菌为溶藻弧菌。本试验分离到了赖氨酸脱羧酶为阴性的致病性溶藻弧菌,与徐晓丽等[18]从半滑舌鳎体内分离到的赖氨酸脱羧酶为阴性的溶藻弧菌结果相同,与Beleneva等[20]提出溶藻弧菌赖氨酸脱羧酶阳性(+)结果不同,可能是细菌代谢受环境、温度等因素影响,导致菌株之间生化特性具一定的差异性。所以,在判定溶藻弧菌的种属时,还应结合生理特征、分子生物学等方面的特性进行综合判断。本试验对分离菌株QY170324的16S rDNA序列进行了分析,序列比对及系统发育树的构建证实该菌为溶藻弧菌。
本研究中,人工感染后罗氏沼虾的症状与自然发病时的症状相似,并自患病的幼虾体内重新分离到了与溶藻弧菌QY170324形态、生化特征一致的细菌,证实这株细菌即为本次导致罗氏沼虾发病的病原菌。
3.2 用于防治罗氏沼虾溶藻弧菌病抗生素的筛选
目前,抗生素治疗仍然是水产养殖动物细菌性疾病治疗的一种重要手段[21]。由药敏试验结果可知,溶藻弧菌QY170324对庆大霉素、四环素、氧氟沙星、哌拉西林、头孢他啶、复方新诺明6种药物高度敏感,对头孢曲松、卡那霉素、新霉素、米诺环素、麦迪霉素、头孢唑林、多黏菌素B 8种药物中度敏感,对克林霉素、羧苄西林、头孢氨苄耐药,所以,在疾病发生后选择药物时应结合药敏试验结果,有针对性地筛选适合的药物来治疗由该菌引起的疾病,避免造成误用、滥用渔药而导致副作用的发生和一些耐药菌株的出现,同时还应考虑到养殖动物对药物的耐受能力,合理安排用药量或者选用一些窄谱抗生素,更加有目的性地对病原菌进行治疗,以至于达到高效、低残留的目的。近些年来,罗氏沼虾大多以工厂化养殖为主,在养殖过程中,应降低养殖密度,定期对循环水设备进行维护,定期监测水体中弧菌总数的变化,同时也可在饲料中添加一定量的免疫增强剂来提高罗氏沼虾的抗病力。
溶藻弧菌对水产养殖业造成巨大的经济损失,同时对食品卫生安全也造成严重的隐患。对溶藻弧菌病原学特征和流行病学的研究,可为养殖场预防及防治溶藻弧菌提供科学依据。
[1] 谢骏,刘波明,俊超,等. 大黄蒽醌提取物对罗氏沼虾高温下抗力与热应激蛋白70基因表达的影响[J]. 水产学报, 2010, 6(34):973-980.
[2] 朱锦裕,卜弘毅,胡冲冲,等, 泼洒糖蜜对池塘养殖罗氏沼虾生长和水质的影响[J]. 水产科学, 2017,36(2):202-206.
[3] Alambra J R, Alenton R R R, Gulpeo P C R, et al. Immunomodulatory effects of turmeric,Curcumalonga(Magnoliophyta, Zingiberaceae) onMacrobrachium[J]. Aquaculture, Aquarium, Conservation & Legislation, 2012(5):13-17.
[4] 刘海春,董学洪,刘志国,等. 罗氏沼虾健康养殖水质调控技术[J]. 江苏农业科学, 2011, 39(10):338-341.
[5] Kennedy B. Bacterial flora associated with the giant freshwater prawnMacrobrachiumrosenbergii,in the hatchery system[J]. Aquaculture, 2006, 261(4):1156-1167.
[6] Lee S W, Najiah M. Multiple antibiotic resistance and heavy metal resistance profile of bacteria isolated from giant freshwater prawn (Macrobrachiumrosenbergii) hatchery[J]. Science Direct,2009,8(6):740-745.
[7] Wikler M A.M100-S18, Performance standards for antimicrobial susceptibility testing: Eighteenth Informationgal Supplement[S]. USA: Clinical and Laboratory Standards Institute, 2008.
[8] 滕勇勇,王琪,吴雷,等. 致病性弧菌的生物学特性和致病因子研究进展[J]. 热带医学杂志, 2014, 14(10):1396-1399.
[9] 陈强,鄢庆枇,马甡,等. 溶藻弧菌致病性研究进展[J]. 海洋科学, 2006, 30(8):83-89.
[10] 林永添. 紫贻贝(MytilusedulisLinnaeus)大量死亡原因的初步研究[J]. 现代渔业信息, 2006, 21(7):23-26.
[11] 韩风杰,徐文娜,刘敏,等. 魁蚶溶藻弧菌分离鉴定与药敏试验[J]. 山东畜牧兽医, 2016,37(5):13-14.
[12] 桑本红,徐晓津,毛勇,等. 大黄鱼溶藻弧菌病组织中巨噬细胞移动抑制因子的检测及意义[J]. 海洋学报, 2014, 36(8):111-116.
[13] 赖迎迢,陶家发,孙承文,等. 鱼源溶藻弧菌生物学特性和病理组织学观察[J]. 微生物学报, 2014, 54(11):1378-1384.
[14] 陈寅儿,金珊,王国良,等. 鲈鱼溶藻弧菌病的血液生理生化指标研究[J]. 台湾海峡, 2005, 24(1):104-108.
[15] 罗词兴,黄旭雄,李桑,等. 溶藻弧菌感染后凡纳滨对虾鳃组织免疫相关基因的表达[J]. 中国水产科学, 2014, 21(1):189-196.
[16] 刘淇,李海燕,王群,等. 梭子蟹牙膏病病原菌—溶藻弧菌的鉴定及其系统发育分析[J]. 海洋水产研究, 2007, 28(4):9-13.
[17] 李正义,贾俊涛,曹际娟,等. 一株分离自冻墨鱼的溶藻弧菌的鉴定及其低温下细胞脂肪酸的变化[J]. 水产科学, 2014, 33(5):317-321.
[18] 徐晓丽,叶红梅,侯纯强,等.半滑舌鳎弧菌病病原的分离鉴定[J]. 中国兽医杂志, 2017(8):86-90.
[19] 程俊茗,万明月,周晋扬,等.鲫源迟缓爱德华氏菌的分离鉴定及其毒力基因的检测[J]. 微生物学通报, 2017, 44(10):2380-2390.
[20] Beleneva I A. Physiological and biochemical characteristics of the halophilic bacteriaVibrioparahaemolyticusandV.alginolyticusisolated from marine invertebrates of Peter the Great Bay, Sea of Japan[J]. Microbiology, 2004, 30(2):96-100.
[21] 刁菁,杨秀生,叶海斌,等. 一种水产迟钝爱德华氏菌快速药敏检测方法的研究[J]. 水产科学, 2014,33(1):22-28.

