水电离产生的氢离子和氢氧根离子浓度计算
阮龙发
(福建省龙岩高级中学 364000)
计算水电离产生的氢离子和氢氧根离子的浓度是高中学生学习化学中的难点,要熟练掌握计算,首先必须明确计算基础.
1.计算公式:pH=-lgc(H+)
Kw=c(H+) ·[OH-](适用纯水、酸、碱、盐等稀溶液)
2.明确溶液中溶质的类型, 电解质的电离,明确H+和OH-的来源.
3.任何情况下:c(H+)水=c(OH+)水.
4.水的电离平衡、弱电解质电离平衡、盐类水解平衡及平衡移动.
5.酸、碱抑制水的电离,盐类水解促进水的电离.
特别要注意:温度对Kw的影响,在没有特别说明的情况下默认为25℃,此时,Kw= 1.0×10-14mol2·L-2.接下来结合电离、盐类水解规律以及对水的电离的影响,按溶质的类型不同分五种情况来分析.
一、酸溶液
在酸(包括强酸和弱酸)溶液中,H+主要来源于酸,酸电离出的H+抑制水的电离.一般情况下,忽略水电离出的H+,酸溶液中的OH-全部来源于水的电离,酸溶液中c(OH+)代表了水的电离程度:c(OH+)=c(OH+)水,要计算水电离出的c(H+)水,先算溶液中的c(OH+).
例1 计算0.001 mol·L-1的HNO3溶液中c(H+)水,即:c(H+)=1×10-3mol·L-1.
解c(OH+)=Kw/c(H+)=1.0×10-14mol2·L-2/10-3mol·L-1=10-11mol·L-1
c(H+)水=c(OH+)水=c(OH+)=10-11mol·L-1
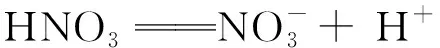
二、碱溶液
在碱(包括强碱和弱碱)溶液中,OH-主要来源于碱,碱电离出的OH-抑制了水的电离.一般情况下,忽略水电离出的OH-,碱溶液中的H+全部来源于水.碱溶液中c(H+)代表了水的电离程度:c(H+)=c(H+)水,要计算水电离出的c(OH+)水,先算溶液中的c(H+).
例2 计算pH=11的氨水溶液中c(OH+)水,即:
c(OH+)=1×10-3mol·L-1.
解c(H+)=Kw/c(OH+)= 1.0×10-14mol2·L-2/ 10-3mol·L-1
c(OH+)水=c(H+)水=c(H+)=10-11mol·L-1
电离原理:只存在
和 H2OOH-+ H+
两种电离,H+全部来源于水,故碱中算c(H+)浓度.
三、纯水和强酸强碱盐

求得溶液中:c(H+)=c(OH+)=c(H+)水=c(OH+)水=1.0× 10-7mol·L-1
变式25℃时,pH=4的HNO3溶液中由水电离出c(H+)水=a;pH=4的Al(NO3)3溶液中由水电离出c(H+)水=b,则a/b=________.
点评酸中算c(OH+);a=c(OH+)=1×10-10mol/L,强酸弱碱盐算c(H+):b=c(H+)=1×10-4mol/L,则a/b=1×10-6.
四、强碱弱酸盐
水解原理:强碱弱酸盐电离出弱酸的阴离子与水电离出的H+结合,生成弱酸.例如:CH3COONa = CH3COO-+Na+,CH3COO-与水电离产生的H+结合生成CH3COOH,使水的电离平衡向右移动,促进了水的电离,从而使得溶液中c(H+) 例3 计算pH=10的CH3COONa溶液中c(H+)水,即:c(H+)=1×10-10mol·L-1 解c(OH+)=Kw/c(H+)=1.0× 10-14mol2·L-2/ 10-10mol·L-1=1×10-4mol·L-1 c(H+)水=c(OH+)水=c(OH+)=1×10-4mol·L-1 平衡原理:CH3COONa溶液只存在: 两种平衡,OH-全部来源于水的电离,故强碱弱酸盐算c(OH+). 水解原理:强酸弱碱盐电离出的弱碱阳离子与水电离出的OH-结合,生成弱碱.例如: Al3+与水电离产生的OH-结合生成Al(OH)3,使水的电离平衡向右移动,促进了水的电离,从而使得溶液中c(H+)>c(OH+).此时,溶液中的c(H+)代表了水的电离程度,要计算水电离出的c(OH+)水,先算溶液中的c(H+). 例4 计算pH=4的Al2(SO4)3溶液中c(OH+)水,即:c(H+)=1×10-4mol·L-1 解c(OH+)水=c(H+)水=c(H+)=1×10-4mol·L-1 平衡原理:Al2(SO4)3溶液只存在: 两种平衡,H+全部来源于水,故强酸弱碱盐算c(H+). 综上,酸碱中算“小的”:酸中算c(OH+)浓度碱中算c(H+)浓度,水解盐算“大的”:强碱弱酸盐算c(OH+)强酸弱碱盐算c(H+). 参考文献: [1]李晓宁.电解质溶液中水的电离[J].青海教育,2010. [2]徐文华.2016年高考理科综合模拟试题(一)[J].试题与研究(高考),2016.

五、强酸弱碱盐


——以大安古河道试验区“古河妈妈”粳米为例

